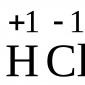Fördelningen av elektroner över energinivåer förklarar de metalliska såväl som icke-metalliska egenskaperna hos ett element.
Elektronisk formel
Det finns en viss regel enligt vilken fria och parade negativa partiklar placeras på nivåer och undernivåer. Låt oss överväga mer i detalj fördelningen av elektroner över energinivåer.Den första energinivån innehåller bara två elektroner. De fyller orbitalen när energireserven ökar. Fördelning av elektroner i en atom kemiskt element motsvarar serienumret. Vid energinivåer med det minsta antalet uttrycks attraktionskraften av valenselektroner till kärnan maximalt.
Ett exempel på att sammanställa en elektronisk formel
Låt oss överväga fördelningen av elektroner över energinivåer med exemplet med en kolatom. Dess atomnummer är 6, därför finns det sex protoner inuti kärnan, som har Positiv laddning. Med tanke på att kol är en representant för den andra perioden, kännetecknas det av närvaron av två energinivåer. Den första har två elektroner, den andra har fyra.Hunds regel förklarar arrangemanget i en cell av endast två elektroner, som har olika snurr. Den andra energinivån innehåller fyra elektroner. Som ett resultat har fördelningen av elektroner i en atom av ett kemiskt element följande form: 1s22s22p2.
Det finns vissa regler enligt vilka elektroner fördelas mellan undernivåer och nivåer.

Pauli princip
Denna princip formulerades av Pauli 1925. Forskaren föreslog möjligheten att placera i en atom endast två elektroner som har samma kvantnummer: n, l, m, s. Observera att fördelningen av elektroner över energinivåer sker när den fria energireserven ökar.
Klechkovskys styre
Fyllningen av energiorbitaler utförs enligt ökningen av kvantantal n + l och kännetecknas av en ökning av energireserven.Låt oss överväga fördelningen av elektroner i en kalciumatom.
I normalt tillstånd är dess elektroniska formel som följer:
Ca 1s2 2s2 2p6 3s2 3p6 3d0 4s2.
För element av liknande undergrupper som tillhör d- och f-element, finns det ett "fel" hos en elektron från en extern undernivå, som har en lägre energireserv, till den tidigare d- eller f-undernivån. Ett liknande fenomen är typiskt för koppar, silver, platina och guld.
Fördelningen av elektroner i en atom förutsätter att undernivåer är fyllda med oparade elektroner som har samma snurr.
Först efter att alla fria orbitaler är helt fyllda med enstaka elektroner, kompletteras kvantceller med andra elektroner. negativa partiklar, utrustad med motsatta snurr.
Till exempel, i det oexciterade tillståndet av kväve:
1s2 2s2 2p3.
Ämnesegenskaperna påverkas av valenselektronernas elektroniska konfiguration. Genom deras kvantitet kan man bestämma den högsta och lägsta valensen och kemiska aktiviteten. Om ett grundämne är i huvudundergruppen av det periodiska systemet kan du använda gruppnumret för att skapa en extern energinivå och bestämma dess oxidationstillstånd. Till exempel innehåller fosfor, som är i den femte gruppen (huvudundergruppen), fem valenselektroner, därför kan den acceptera tre elektroner eller donera fem partiklar till en annan atom.
Alla representanter för sidoundergrupper i det periodiska systemet är undantag från denna regel.

Funktioner av familjer
Beroende på strukturen av den externa energinivån finns det en uppdelning av alla neutrala atomer som ingår i det periodiska systemet i fyra familjer:- s-element finns i den första och andra gruppen (huvudundergrupper); p-familjen är belägen i grupperna III-VIII (A-undergrupper); d-element kan hittas i liknande undergrupper från grupperna I-VIII; f- familjen består av aktinider och lantanider.
D-element i ett oexciterat tillstånd har valenselektroner i både den sista s- och den näst sista d-subnivån.
Slutsats
Tillståndet för varje elektron i en atom kan beskrivas med hjälp av en uppsättning fundamentala tal. Beroende på funktionerna i dess struktur kan vi prata om en viss mängd energi. Med hjälp av Hund, Klechkovsky, Pauli-regeln för alla element som ingår i det periodiska systemet kan du skapa konfigurationen av en neutral atom.Elektronerna som finns i de första nivåerna har den minsta mängden energi i ett oexciterat tillstånd. När en neutral atom värms upp observeras en övergång av elektroner, som alltid åtföljs av en förändring av antalet fria elektroner och leder till en betydande förändring av elementets oxidationstillstånd och en förändring i dess kemiska aktivitet.
Sen när kemiska reaktioner kärnorna i de reagerande atomerna förblir alltså oförändrade Kemiska egenskaper atomer beror främst på strukturen hos atomernas elektronskal. Därför kommer vi att uppehålla oss mer i detalj vid fördelningen av elektroner i en atom och främst de av dem som bestämmer de kemiska egenskaperna hos atomer (de så kallade valenselektronerna), och följaktligen periodiciteten i atomernas egenskaper och deras egenskaper. föreningar. Vi vet redan att elektronernas tillstånd kan beskrivas med en uppsättning av fyra kvanttal, men för att förklara strukturen hos atomernas elektronskal behöver vi känna till följande ytterligare tre grundläggande principer: 1) Pauli-principen, 2) princip lägsta energin och 3) Gund slog till. Paulis princip. 1925 fastställde den schweiziske fysikern W. Pauli en regel, senare kallad Pauli-principen (eller Pauli-uteslutningen): en atom kan ha två elektroner med samma egenskaper. Genom att veta att elektronernas egenskaper kännetecknas av kvanttal kan Pauli-principen formuleras på detta sätt: i en atom kan det inte finnas två elektroner för vilka alla fyra kvanttalen är lika. Minst ett av kvanttalen l, /, mt eller m3 måste nödvändigtvis vara olika. Alltså, elektroner med samma kvan- I det följande kommer vi överens om att grafiskt beteckna elektroner som har värdena s = + lj2> med pilen T, och de som har värdena J- ~lf2 - med pilen. Två elektroner som har samma snurr kallas ofta elektroner med parallella snurr och betecknar ft (eller C). Två elektroner med motsatta spinn kallas elektroner med aptitparallella spins och betecknar | J-totaltalen l, I och mt måste nödvändigtvis ha olika snurr. Därför kan det i en atom bara finnas två elektroner med samma n, / och m, en med m = -1/2, den andra med m = + 1/2. Tvärtom, om snurrarna för två elektroner är desamma måste ett av kvanttalen skilja sig åt: n, / eller mh Genom att känna till Pauli-principen, låt oss nu se hur många elektroner i en atom som kan vara i en viss "omloppsbana" med ett huvudsakligt kvanttal n. Den första ”banan” motsvarar n= 1. Då kan /=0, mt-0 och tl ha ett godtyckligt värde: +1/2 eller -1/2. Vi ser att om n- 1 kan det bara finnas två sådana elektroner. I det allmänna fallet, för ett givet värde på l, kännetecknas elektroner i första hand av ett sidokvantumnummer /, som tar värden från 0 till l-1. För givna värden kan det finnas (2/+1) elektroner med olika värden på det magnetiska kvanttalet m. Detta antal måste fördubblas, eftersom de givna värdena på l, / och m( motsvarar två olika värden på spinprojektionen mx. Följaktligen uttrycks det maximala antalet elektroner med samma kvantnummer l av summan Därför är det tydligt varför det på den första energinivån inte kan finnas mer än 2 elektroner, på den andra - 8, på den tredje - 18, etc. Tänk till exempel på väteatomen iH. Väteatomen iH har en elektron, och denna elektrons spinn kan riktas godtyckligt (dvs. ms^ + ij2 eller mt = -1/2), och elektronen är i s-co-tillståndet vid den första energinivån med l- 1 (kom ihåg igen att den första energinivån består av en undernivå - 15, den andra energinivån - av två undernivåer - 2s och 2p , den tredje är av tre undernivåer - 3*, Zru 3d, etc. d.). Undernivån är i sin tur uppdelad i kvantceller* (energitillstånd bestäms av antalet möjliga värden m(, dvs. 2/4-1). Cellen representeras vanligtvis grafiskt av en rektangel, elektronens riktning spin indikeras med pilar. Därför kan tillståndet för elektronen i atomen väte iH representeras som Ijt1, eller, vilket är samma, Med "kvantcell" menar vi * en orbital som kännetecknas av samma uppsättning värden av kvanttalen n, I och m * i varje cell kan maximalt två elektroner med parallella spinn placeras, vilket betecknas med ti - Fördelning av elektroner i atomer I heliumatomen 2He är kvanttalen n- 1, / = 0 och m(-0 är lika för båda dess elektroner, men kvanttalet m3 är olika. Projektionerna av heliumelektroners spinn kan vara mt = + V2 och ms = - V2 Strukturen hos elektronskalet i heliumatom 2He kan representeras som Is-2 eller, vilket är detsamma, 1S Och låt oss skildra strukturen av elektronskalen för fem atomer av element i den andra perioden periodiska systemet Mendeleev: Att elektronskalen i BS, 7N och BO ska fyllas på detta sätt är inte självklart på förhand. Det givna arrangemanget av snurr bestäms av den så kallade Hund’s regel (första gången formulerad 1927 av den tyske fysikern F. Hund). Hunds regel. Vid ett givet värde på I (dvs inom en viss undernivå) är elektronerna ordnade på ett sådant sätt att det totala hundratalet* är maximalt. Om till exempel tre elektroner behöver fördelas i tre /^-celler i en kväveatom, så kommer de att vara placerade i en separat cell, dvs placerade på tre olika p-orbitaler: I det här fallet, det totala spinnet är lika med 3/2, eftersom dess projektion är lika med m3 - 4-1/2 + A/2+1/2 = 3/2* Samma tre elektroner kan inte ordnas på detta sätt: 2p NI eftersom då projektionen av den totala spinn tm = +1/2 - 1/2+ + 1/2=1/2. Av denna anledning är elektronerna i kol-, kväve- och syreatomerna placerade exakt som beskrivits ovan. Låt oss sedan överväga de elektroniska konfigurationerna av atomer i nästa tredje period. Med början med natrium uNa fylls den tredje energinivån med huvudkvanttalet n-3. Atomerna i de första åtta elementen i den tredje perioden har följande elektroniska konfigurationer: Låt oss nu betrakta den elektroniska konfigurationen av den första atomen i den fjärde perioden, kalium 19K. De första 18 elektronerna fyller följande orbitaler: ls12s22p63s23p6. Det verkar som att; att den nittonde elektronen i kaliumatomen ska falla på 3d undernivå, vilket motsvarar n = 3 och 1 = 2. Men i själva verket är valenselektronen för kaliumatomen belägen i 4s orbital. Ytterligare fyllning av skalen efter det 18:e elementet sker inte i samma sekvens som under de två första perioderna. Elektroner i atomer är ordnade i enlighet med Pauli-principen och Hunds regel, men så att deras energi är minimal. Principen om minsta energi (det största bidraget till utvecklingen av denna princip gjordes av den inhemska forskaren V.M. Klechkovsky) - i en atom är varje elektron placerad så att dess energi är minimal (vilket motsvarar dess största förbindelse med kärnan) . Elektronens energi bestäms huvudsakligen av huvudkvanttalet n och det sekundära kvanttalet /, därför fylls först de undernivåer för vilka summan av värdena för kvanttalen pi/ är den minsta. Till exempel är energin för en elektron på 4s undernivå mindre än på 3d undernivå, eftersom i det första fallet n+/=4+0=4, och i det andra n+/=3+2= 5; vid undernivå 5* (n+ /=5+0=5) är energin mindre än vid Ad (l + /=4+ 4-2=6); med 5p (l+/=5 +1 = 6) är energin mindre än med 4/(l-f/= =4+3=7), etc. d. Det var V.M. Klechkovsky som för första gången 1961 formulerade den allmänna ståndpunkten att en elektron upptar i grundtillståndet en nivå som inte har det minsta möjliga värdet n, utan med det minsta värdet av summan n+/“ I fallet när för två undernivåer summan av värdena för pi/ är lika, fylls först undernivån med det mindre värdet av n i. Till exempel, på undernivåerna 3d, Ap, 5s, summan av värdena för pi/ är lika med 5. I det här fallet fylls först undernivåerna med mindre värden på l, d.v.s. 3dAp-5s etc. I Mendeleevs periodiska system av element är sekvensen av fyllningsnivåer och undernivåer med elektroner som följer (fig. 2.4). Fördelning av elektroner i atomer. Schema för att fylla energinivåer och undernivåer med elektroner Följaktligen, enligt principen om minst energi, är det i många fall energetiskt gynnsammare för en elektron att ockupera en undernivå av den "överliggande" nivån, även om undernivån till den "lägre" nivån är inte ifylld: Detta är anledningen till att under den fjärde perioden fylls 4s undernivån först och först efter det 3d undernivån .
När du distribuerar elektroner mellan kvantceller följer följande riktlinjer:
Baserat på Pauli-principen: en atom kan inte ha två elektroner med samma
en uppsättning värden av alla kvanttal, dvs. atomomlopp inte kan innehålla
tryck på mer än två elektroner, och deras snurrmoment bör vara motsatta
motsatt
↓
Notationssystemet ser generellt ut så här:
där p är den huvudsakliga, ℓ är orbitalkvanttalet; x är antalet elektroner,
i ett givet kvanttillstånd. Till exempel kan 4d3-posten vara
tolkas enligt följande: tre elektroner upptar den fjärde energin
Skidnivå, d-undernivå.
Arten av utvecklingen av energisubnivåer bestämmer tillhörigheten
element till en eller annan elektronisk familj.
I s-element byggs den externa s-delnivån upp, t.ex.
11 Na 1s2 2s2 2p6 3s1
I p-element byggs den externa p-delnivån upp, t.ex.
9 F 1s 2s2 2p5 .
s- och p-familjerna inkluderar element från huvudundergrupperna i det periodiska systemet.
tsy D.I. Mendeleev.
I d-element byggs d-undernivån för den näst sista nivån upp,
Till exempel,
2 2 6 2 6 2 2
22Ti 1s 2s 2p 3s 3p 3d 4s .
D-familjen inkluderar element av sidoundergrupper. Valensen av denna se-
familjer är s-elektroner av den sista energinivån och d-elektroner
näst sista nivån.
I f-elementen byggs f-undernivån för den tredje yttre nivån,
Till exempel,
58Се 1s22s22p63s23p63d l04s24p64d l04f l5s25p65d16s2.
Representanter för f-elektronfamiljen är lantanider och aktinider.
Ett kvanttal kan ha två värden: Därför kan inte mer än elektroner finnas i en atom i tillstånd med ett givet värde:

Grunderna bandteori
Enligt Bohrs postulat kan energin hos en elektron i en isolerad atom anta strikt diskreta värden (de säger också att elektronen är i en av orbitalen).
I fallet med flera atomer kombinerade kemisk bindning(till exempel i en molekyl) delas elektronorbitaler i en mängd som är proportionell mot antalet atomer och bildar så kallade molekylära orbitaler. Med en ytterligare ökning av systemet till en makroskopisk kristall (antalet atomer är mer än 10 20) blir antalet orbitaler mycket stort, och skillnaden i energierna hos elektroner som finns i angränsande orbitaler är på motsvarande sätt mycket liten, energin nivåerna är uppdelade i nästan kontinuerliga diskreta uppsättningar - energizoner. Det högsta av de tillåtna energibanden i halvledare och dielektrika, där vid en temperatur på 0 K alla energitillstånd är upptagna av elektroner, kallas valensbandet, nästa är ledningsbandet. I metaller är ledningsbandet det högsta tillåtna bandet där elektroner finns vid en temperatur på 0 K.
Bandteorin bygger på följande huvudsakliga approximationer:
1. Det fasta ämnet är en perfekt periodisk kristall.
2. Jämviktspositionerna för noderna i kristallgittret är fixerade, det vill säga atomkärnorna anses vara orörliga (adiabatisk approximation). Små vibrationer av atomer runt jämviktspositioner, som kan beskrivas som fononer, introduceras därefter som en störning av det elektroniska energispektrat.
3. Problemet med många elektroner reduceras till ett enelektronproblem: alla de andras inflytande på en given elektron beskrivs av ett genomsnittligt periodiskt fält.
Ett antal väsentligen multielektronfenomen, såsom ferromagnetism, supraledning, och de där excitoner spelar en roll, kan inte konsekvent betraktas inom ramen för bandteorin. Samtidigt med ett mer generellt förhållningssätt till teorikonstruktion fast Det visade sig att många resultat av bandteorin är bredare än dess ursprungliga premisser.
Fotokonduktivitet.
Fotokonduktivitet- fenomenet med en förändring av ett ämnes elektriska ledningsförmåga vid absorption av elektromagnetisk strålning, såsom synlig, infraröd, ultraviolett eller röntgenstrålning.
Fotokonduktivitet är karakteristiskt för halvledare. Den elektriska ledningsförmågan hos halvledare begränsas av bristen på laddningsbärare. När en foton absorberas, rör sig en elektron från valensbandet till ledningsbandet. Som ett resultat bildas ett par laddningsbärare: en elektron i ledningsbandet och ett hål i valensbandet. Båda laddningsbärarna skapar en elektrisk ström när spänning appliceras på halvledaren.
När fotokonduktivitet exciteras i en inneboende halvledare måste fotonenergin överstiga bandgapet. I en dopad halvledare kan absorptionen av en foton åtföljas av en övergång från en nivå som är belägen i bandgapet, vilket gör att ljusets våglängd som orsakar fotokonduktiviteten kan ökas. Denna omständighet är viktig för att detektera infraröd strålning. En förutsättning för hög fotokonduktivitet är också en hög ljusabsorptionshastighet, som realiseras i direktgap-halvledare
Kvantfenomen
37) Kärnstruktur och radioaktivitet
Atomkärna- den centrala delen av atomen, i vilken huvuddelen av dess massa är koncentrerad (mer än 99,9%). Kärnan är positivt laddad, kärnans laddning bestäms av det kemiska element som atomen tillhör. Storleken på kärnorna i olika atomer är flera femtometer, vilket är mer än 10 tusen gånger mindre än själva atomens storlek.
Antalet protoner i kärnan kallas dess laddningsnummer - detta nummer är lika med serienumret på det element som atomen tillhör i Mendeleevs tabell (Periodic Table of Elements). Antalet protoner i kärnan bestämmer strukturen hos elektronskalet hos en neutral atom och därmed de kemiska egenskaperna hos motsvarande element. Antalet neutroner i en kärna kallas dess isotopnummer. Kärnor med samma antal protoner och olika nummer neutroner kallas isotoper. Kärnor med samma antal neutroner men olika antal protoner kallas isotoner. Termerna isotop och isoton används också för att hänvisa till atomer som innehåller dessa kärnor, samt för att karakterisera icke-kemiska varianter av ett enda kemiskt element. Det totala antalet nukleoner i en kärna kallas dess massatal () och är ungefär lika med medelmassan av en atom som visas i det periodiska systemet. Nuklider med samma massnummer men olika proton-neutronsammansättning brukar kallas isobarer.
Radioaktivt avfall(från lat. radie"stråle" och āctīvus"effektiv") - spontan förändring i sammansättning (laddning Z, massnummer A) eller inre struktur instabila atomkärnor genom att sända ut elementarpartiklar, gammastrålar och/eller kärnfragment. Processen för radioaktivt sönderfall kallas också radioaktivitet, och motsvarande kärnor (nuklider, isotoper och kemiska grundämnen) är radioaktiva. Ämnen som innehåller radioaktiva kärnor kallas även radioaktiva.
Fördelningen av elektroner över energinivåer förklarar de metalliska såväl som icke-metalliska egenskaperna hos ett element.
Elektronisk formel
Det finns en viss regel enligt vilken fria och parade negativa partiklar placeras på nivåer och undernivåer. Låt oss överväga mer i detalj fördelningen av elektroner över energinivåer.
Den första energinivån innehåller bara två elektroner. De fyller orbitalen när energireserven ökar. Fördelningen av elektroner i en atom av ett kemiskt element motsvarar ett atomnummer. Vid energinivåer med det minsta antalet uttrycks attraktionskraften av valenselektroner till kärnan maximalt.
Ett exempel på att sammanställa en elektronisk formel
Låt oss överväga fördelningen av elektroner över energinivåer med exemplet med en kolatom. Dess atomnummer är 6, därför finns det sex protoner inuti kärnan som har en positiv laddning. Med tanke på att kol är en representant för den andra perioden, kännetecknas det av närvaron av två energinivåer. Den första har två elektroner, den andra har fyra.
Hunds regel förklarar arrangemanget i en cell av endast två elektroner, som har olika snurr. Den andra energinivån innehåller fyra elektroner. Som ett resultat har fördelningen av elektroner i en atom av ett kemiskt element följande form: 1s22s22p2.
Det finns vissa regler enligt vilka elektroner fördelas mellan undernivåer och nivåer.

Pauli princip
Denna princip formulerades av Pauli 1925. Forskaren föreslog möjligheten att placera i en atom endast två elektroner som har samma kvantnummer: n, l, m, s. Observera att fördelningen av elektroner över energinivåer sker när den fria energireserven ökar.

Klechkovskys styre
Fyllningen av energiorbitaler utförs enligt ökningen av kvantantal n + l och kännetecknas av en ökning av energireserven.
Låt oss överväga fördelningen av elektroner i en kalciumatom.
I normalt tillstånd är dess elektroniska formel som följer:
Ca 1s2 2s2 2p6 3s2 3p6 3d0 4s2.
För element av liknande undergrupper som tillhör d- och f-element, finns det ett "fel" hos en elektron från en extern undernivå, som har en lägre energireserv, till den tidigare d- eller f-undernivån. Ett liknande fenomen är typiskt för koppar, silver, platina och guld.
Fördelningen av elektroner i en atom förutsätter att undernivåer är fyllda med oparade elektroner som har samma snurr.
Först efter att alla fria orbitaler är helt fyllda med enstaka elektroner, kompletteras kvantceller med andra negativa partiklar utrustade med motsatta snurr.
Till exempel, i det oexciterade tillståndet av kväve:
Ämnesegenskaperna påverkas av valenselektronernas elektroniska konfiguration. Genom deras kvantitet kan man bestämma den högsta och lägsta valensen och kemiska aktiviteten. Om ett grundämne är i huvudundergruppen av det periodiska systemet kan du använda gruppnumret för att skapa en extern energinivå och bestämma dess oxidationstillstånd. Till exempel innehåller fosfor, som är i den femte gruppen (huvudundergruppen), fem valenselektroner, därför kan den acceptera tre elektroner eller donera fem partiklar till en annan atom.
Alla representanter för sidoundergrupper i det periodiska systemet är undantag från denna regel.

Funktioner av familjer
Beroende på strukturen av den externa energinivån finns det en uppdelning av alla neutrala atomer som ingår i det periodiska systemet i fyra familjer:
- s-element finns i den första och andra gruppen (huvudundergrupper);
- p-familjen är belägen i grupperna III-VIII (A-undergrupper);
- d-element kan hittas i liknande undergrupper från grupperna I-VIII;
- F-familjen består av aktinider och lantanider.
Alla s element i deras normala tillstånd har valenselektroner i s undernivå. p-element kännetecknas av närvaron av fria elektroner i s- och p-subnivåerna.
D-element i ett oexciterat tillstånd har valenselektroner i både den sista s- och den näst sista d-subnivån.
Slutsats
Tillståndet för varje elektron i en atom kan beskrivas med hjälp av en uppsättning fundamentala tal. Beroende på funktionerna i dess struktur kan vi prata om en viss mängd energi. Med hjälp av Hund, Klechkovsky, Pauli-regeln för alla element som ingår i det periodiska systemet kan du skapa konfigurationen av en neutral atom.
Elektronerna som finns i de första nivåerna har den minsta mängden energi i ett oexciterat tillstånd. När en neutral atom värms upp observeras en övergång av elektroner, som alltid åtföljs av en förändring av antalet fria elektroner och leder till en betydande förändring av elementets oxidationstillstånd och en förändring i dess kemiska aktivitet.
Fördelningen kännetecknas av följande regler:
Pauli princip;
Hunds regel;
principen om minsta energi och Klechkovskys styre.
Förbi Pauli princip En atom kan inte ha två eller flera elektroner med samma värde av alla fyra kvanttalen. Baserat på Pauli-principen kan den maximala kapaciteten för varje energinivå och undernivå bestämmas.
|
Undernivå, ℓ |
Undernivåbeteckning |
Magnetiskt kvantnummer, m |
Spin quantum number,s |
|
|
|
||||
|
|
||||
|
3, -2, -1, 0, 1, 2, 3 |
|
Således, maximalt antal elektroner per:
s -undernivå - 2,
sid - undernivå - 6,
d -undernivå - 10,
f -undernivå - 14.
Inom kvantnivån n kan en elektron anta värdena för 2n 2 olika tillstånd, vilket etablerades experimentellt med spektralanalys.
Hunds regel : i varje undernivå strävar elektroner efter att uppta det maximala antalet fria energiceller så att det totala spinnet har störst värde.
Till exempel:
rätt fel fel
s = +1/2+1/2+1/2=1,5 s =-1/2+1/2+1/2=0,5 s = -1/2+1/2-1/2 =-0,5
Principen om minsta energi och Klechkovskys regel: elektroner upptar främst kvantorbitaler med minimal energi. Eftersom energireserven i en atom bestäms av värdet av summan av de huvudsakliga och orbitala kvanttalen (n + ℓ), upptar elektroner först de orbitaler för vilka summan (n + ℓ) är minst.
Till exempel: summan (n + ℓ) för 3d-undernivån är n = 3, l = 2, därför (n + ℓ) = 5; för 4s-undernivån: n = 4, ℓ = 0, därför (n + ℓ) ) = 4. I det här fallet fylls 4s undernivån först och först sedan 3d undernivån.
Om de totala energivärdena är lika, då är den nivå som är närmast kärnan befolkad.
Till exempel: för 3d: n = 3, ℓ = 2 , (n + ℓ) = 5 ;
för 4p: n = 4, ℓ = 1, (n + ℓ) = 5.
Eftersom n = 3 < n = 4, 3d kommer att fyllas med elektroner tidigare än 4 p.
Således, sekvens av fyllningsnivåer och undernivåer med elektroner i atomer:
1 s 2 <2 s 2 <2 sid 6 <3 s 2 <3 sid 6 <4 s 2 <3 d 10 <4 sid 6 <5 s 2 <4 d 10 <5 sid 6 <6 s 2 <5 d 10 ≈ 4 f 14 <6 sid 6 <7s 2 …..
Elektroniska formler
En elektronformel är en grafisk representation av fördelningen av elektroner över nivåer och undernivåer i en atom. Det finns två typer av formler:
När man skriver används bara två kvanttal: n och ℓ. Huvudkvantnumret indikeras med ett nummer före bokstavsbeteckningen för undernivån. Orbitalkvantnumret indikeras med bokstaven s, p, d eller f. Antalet elektroner anges med ett tal som en exponent.
Till exempel: +1 H: 1s1; +4 Var: 1s 2 2s 2 ;
2 He: 1s 2; +10 Ne: 1s 2 2s 2 2p 6 ;
3 Li: 1s 2 2s 1; +14 Si: 1s 2 2s 2 2p 6 3s 2 3p 6 .
Det vill säga sekvensen observeras
1 s 2 <2 s 2 <2 sid 6 <3 s 2 <3 sid 6 <4 s 2 <3 d 10 <4 sid 6 <5 s 2 <4 d 10 <5 sid 6 <6 s 2 <5 d 10 ≈ 4 f 14 <6 sid 6 <7s 2 …..
grafisk elektronisk formel - alla 4 kvanttal används - detta är fördelningen av elektroner över kvantceller. Huvudkvantnumret är avbildat till vänster, orbitalnumret representeras av bokstaven nedan, det magnetiska numret är antalet celler och spinnumret är pilarnas riktning.
Till exempel:
8 O:...2s 2 2p 4 
Den grafiska formeln används för att endast skriva valenselektroner.
Låt oss överväga att sammanställa elektroniska formler för element efter perioder.
Den första perioden innehåller 2 element där den första kvantnivån och s-undernivån är helt befolkade med elektroner (det maximala antalet elektroner per undernivå är 2):
2 He: n=1 1s 2
Element vars s-undernivå fylls sist klassas som s -familj och ring s -element .
För period II-element fylls kvantnivån II, s- och p-undernivåerna (det maximala antalet elektroner på p-undernivån är 8).
3 Li: 1s 2 2s 1; 4 Be: 1s 2 2s 2 ;
5 B: 1s 2 2s 2 2pi; 10 Ne: 1s 2 2s 2 2p 6
Element vars p-undernivå fylls sist klassas som p-familj och ring p-element .
Element från III-perioden börjar bilda III-kvantnivån. I Na och Mg är 3s-subnivån befolkad med elektroner. För element från 13 Al till 18 Ar är 3p-undernivån ifylld; 3D-undernivån förblir ofylld, eftersom den har en högre energinivå än 4s-undernivån och inte fylls i delar av III-perioden.
3d-undernivån börjar fylla i element i IV-perioden och 4d - i element i V-perioden (i enlighet med sekvensen):
19 K: 1s 2 2s 2 2p 6 3s 2 3p 6 4s 1 ; 20 Ca: 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 ;
21 Sc: 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 1 ; 25 Mn: 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 5 ;
33 As: 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 3; 43 Tc: 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 5
Element vars d-undernivå fylls sist klassas som d -familj och ring d -element .
4f fylls i endast efter element 57 i VI-perioden:
57 La: 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 5 5s 2 4d 10 5p 6 6s 2 5d 1 ;
58 Ce: 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 5 5s 2 4d 10 5p 6 6s 2 5d 1 4f 1 ;
Populationen av V-kvantnivån av elektroner fortsätter på samma sätt som IV-perioden. Således observeras den tidigare visade sekvensen av population av nivåer och subnivåer av elektroner:
6s 2 5d 10 4f 14 6p 6
populationen av en ny kvantnivå av elektroner börjar alltid med s-subnivån. För element i en given period är endast s- och p-subnivåerna av den externa kvantnivån befolkade av elektroner;
populationen av d-subnivån är försenad med period I; 3D-undernivån fylls i för element i IV-perioden, 4d-undernivån fylls i för element i V-perioden, etc.;
populationen av f-subnivån av elektroner är försenad med 2 perioder; 4f-undernivån är befolkad i delar av VI-perioden, 5f-undernivån är befolkad i delar av VII-perioden, etc.
- I kontakt med 0
- Google+ 0
- OK 0
- Facebook 0