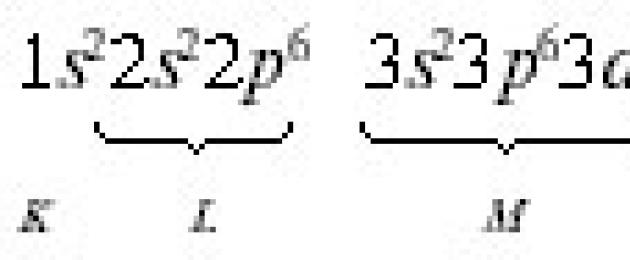Fördelningen av elektroner i en atom utförs i enlighet med 3 bestämmelser i kvantmekaniken: Pauli-principen; principen om minimienergi; Hunds regel.
Enligt Pauli-principen En atom kan inte ha två elektroner med samma värden av alla fyra kvanttalen. Pauli-principen bestämmer det maximala antalet elektroner i en orbital, nivå och undernivå. Eftersom AO kännetecknas av tre kvanttal n, l, ml, kan elektronerna i en given orbital endast skilja sig åt i spinnkvanttalet Fröken. Men Fröken kan bara ha två värden +½ och -½.
Därför kan inte mer än två elektroner med motsatt riktade spinn vara i en omloppsbana. Det maximala antalet elektroner i en energinivå definieras som 2 n 2 , och på undernivå - som 2 (2 l+1). Det maximala antalet elektroner på olika nivåer och undernivåer anges i tabell. 2.1.
Maximalt antal elektroner på kvantnivåer och undernivåer
| Energinivå | Energi undernivå | Möjliga värden för det magnetiska kvanttalet ml | Antal JSCs in | Maximalt antal elektroner per | ||
| undernivå | nivå | undernivå | nivå | |||
| K (n= 1) | s (l= 0) | |||||
| L (n= 2) | s (l= 0) sid (l= 1) | -1, 0, 1 | ||||
| M (n= 3) | s (l= 0) sid (l= 1) d (l= 2) | -1, 0, 1 -2, -1, 0, 1, 2 | ||||
| N (n= 4) | s (l= 0) sid (l= 1) d (l= 2) f (l= 3) | -1, 0, 1 -2, -1, 0, 1, 2 -3, -2, -1, 0, 1, 2, 3 |
Sekvensen att fylla orbitaler med elektroner utförs i enlighet med minimienergiprincip, Varvid elektroner fyller orbitalerna i ordning efter att orbitalernas energinivå ökar. Ordningen av orbitaler i termer av energi bestäms av Klechkovskys styre : en ökning av energin, och följaktligen sker fyllningen av orbitaler i storleksordningen ökande summa (n + l), och med en lika stor summa (n + l) - i stigande ordning av n.
Ordningen för fördelning av elektroner över energinivåer och undernivåer i en atoms skal ringde honom elektronisk konfiguration. När du skriver en elektronisk konfiguration betecknas nivånumret (huvudkvantnumret) med siffrorna 1, 2, 3, 4 ..., undernivån (orbitalt kvantnummer) - med bokstäver s, p, d, f. Antalet elektroner i en undernivå indikeras med ett tal, som skrivs överst på undernivåsymbolen. Till exempel är den elektroniska konfigurationen av en svavelatom 16 S 1 s 2 2s 2 2sid 6 3s 2 3sid 4 och vanadin 23 V 1 s 2 2s 2 2sid 6 3s 2 3sid 6 3d°/i> 3 4 s 2 .
Atomers kemiska egenskaper bestäms främst av strukturen hos de yttre energinivåerna, som kallas valens. Genomförda energinivåer deltar inte i kemisk interaktion. Därför, för korthetens skull, betecknas de ofta med symbolen för den föregående ädelgasen för korthetens skull. Så, för svavel: 3 s 2 3sid 4; för vanadin: 3 d 3 4s 2. Samtidigt framhäver den förkortade notationen tydligt valenselektronerna som bestämmer Kemiska egenskaper element atomer.
Beroende på vilken undernivå i atomen som fylls sist, delas alla kemiska grundämnen in i 4 elektroniska familjer: s-, p-, d-, f- element. Element vars atomer är de sista som fyller s-subnivån på den yttre nivån kallas s-element. På s- element är valens s-elektroner av den yttre energinivån.
På p-element p-undernivån för den yttre nivån fylls sist. De har valenselektroner i p- Och s- undernivåer av det yttre lagret. På d-element, d-undernivån för den före-yttre nivån fylls sist och valens är s- elektroner av den yttre och d- elektroner från de pre-externa energinivåerna. På f-element, f-subnivån för den tredje yttre energinivån fylls sist.
Den elektroniska konfigurationen av en atom kan också avbildas i form av elektronplaceringsscheman i kvantceller, som är en grafisk representation av den atomära orbitalen. Varje kvantcell kan inte innehålla mer än två elektroner med motsatt riktade snurr. Ordningen för placering av elektroner inom en undernivå bestäms av Hunds regel: inom en undernivå är elektroner ordnade så att deras totala spinn är maximal. Med andra ord fylls orbitalerna för en given undernivå först av en elektron med samma snurr, och sedan av den andra elektronen med motsatta snurr.
Totalt snurr R- elektroner av den tredje energinivån av svavelatomen S Fröken= ½ - ½ + ½ + ½ = 1; d- elektroner i vanadinatomen -
S Fröken\u003d ½ + ½ + ½ \u003d 3/2.
Ofta är inte hela den elektroniska formeln grafiskt avbildad, utan bara de undernivåer där valenselektronerna finns, till exempel,
16S…3 s 2 3sid 4; 23V...3 d 3 4s 2 .
I en grafisk representation av den elektroniska konfigurationen av en atom i ett exciterat tillstånd, tillsammans med fyllda sådana, avbildas lediga valensorbitaler. Till exempel, i fosforatomen på den tredje energinivån finns det en s-AO, tre R-ao och fem d-AO. Den elektroniska konfigurationen av fosforatomen i grundtillståndet har formen
15 R... 3 s 2 3sid 3 .
Valensen av fosfor, bestäms av antalet oparade elektroner, är 3. När en atom övergår i ett exciterat tillstånd, försämras elektronerna i tillstånd 3 s och en av elektronerna s-undernivå kan gå till d-undernivå:
R*... 3 s2 3sid 3 3d 1
I detta fall ändras fosforvalensen från tre (PCl 3) i grundtillståndet till fem (PCl 5) i det exciterade tillståndet.
KOMPOSITION OCH ELEKTRONISK
ATOMENS STRUKTUR
METODISKA INSTRUKTIONER OCH KONTROLLUPPGIFTER
TILL STUDENTUTBILDNINGSPROGRAM
SPECIALISERADE KLASSER
GRUNDLÄGGANDE SKOLOR
Fortsättning. För början, se № 4, 6/2005
Riktlinjer
17. Med tanke på de beskrivna regelbundenheterna, överväg tillståndet och fördelningen av elektroner i termer av energinivåer och orbitaler för kaliumatomer ( Z= 19) och skandium ( Z = 21).
Lösning
1) Elementet argon, som föregår kalium i PSCE ( Z= 18) har följande elektronfördelning:
a) efter nivåerna av atomen:
b) av atomens orbitaler:
Elektronisk formel för argonatomen:
![]()
Elektronisk grafisk formel för argonatomen:
I fördelningen av elektroner i K-atomen, i enlighet med Klechkovsky-regeln, föredras orbitaler 4 s(summan av kvanttal n + lär lika med: 4 + 0 = 4) jämfört med orbital 3 d(summan av kvanttal n + lär lika med: 3 + 2 = 5) som orbitalen med minimivärdet n + l. Följaktligen, för en kaliumatom har fördelningen av elektroner i orbitaler (elektrongrafisk formel) formen (se punkt 16 riktlinjer):
Kalium tillhör s-element med följande elektroniska formel (konfiguration) för atomen:
![]()
Fördelningen av elektroner över energinivåer för atom K visas nedan:

2) Kalciumelementet före skandium i PSCE ( Z= 20) har följande elektronfördelning:
a) efter nivåerna av atomen:

b) av atomens orbitaler:
Den elektroniska formeln för kalciumatomen:

Från orbitaler 3 d (n + lär lika med: 3 + 2 = 5) och 4 sid (n + l lika med: 4 + 1 = 5) i fördelningen av elektroner i skandiumatomen över orbitaler, föredraget bör ges till 3 d-orbitaler som har minimivärdet n= 3 för samma summor av kvanttal ( n + l) lika med fem. Därför hör scandium till d-element, och dess atom kännetecknas av följande fördelning av elektroner i banor:
Den elektroniska formeln för skandiumatomen är:

Fördelningen av elektroner över energinivåer för Sc-atomen visas nedan:

18. Komplettera ritningen för att visa en vy av en s-orbitaler och tre R-orbitaler orienterade längs axlarna.

Tabell 5
Elektronfördelning
efter kvantnivåer och undernivåer
| Skal | Energi nivå n |
Energi undernivå l |
Magnetisk siffra m |
siffra orbitaler |
begränsande siffra elektroner |
||||
|---|---|---|---|---|---|---|---|---|---|
| K | 1 | 0(s) | 0 | 1 | 2 | ||||
| L | 2 | 0(s) 1 (p) |
+1, 0, –1 |
|
|
||||
| M | 3 | 0(s) 1 (p) 2(d) |
0
1, 0, –1 |
|
|
||||
| N | 4 | 0(s) 1 (p) 2(d) 3(f) |
0 +1, 0, –1 +2, +1, 0, –1, –2 +3, +2, +1, 0, –1, –2, –3 |
|
|
20. Sekvensen för att fylla atomernas energinivåer, se tabell. 6.
21. Antalet element i perioden i tabellen för D.I. Mendeleev bestäms av formlerna:
a) för udda perioder:
L n = (n + 1) 2 /2,
b) för jämna perioder:
L n = (n + 2) 2 /2,
var L när antalet element i perioden, n– periodnummer.
Bestämma antalet element i varje period av D.I. Mendeleevs PSCE.
Förklara:
a) den resulterande numeriska regelbundenhet utifrån tillståndet för elektroner i atomer och deras fördelning över energinivåer;
b) uppdelning av grupper av element i huvud- och sekundära undergrupper;
c) förutbestämningen av antalet huvud- och sekundära undergrupper i D.I. Mendeleevs PSCE utifrån teorin om atomernas struktur.
Kolla upp i framtiden, deras slutsatser om bilaga 1 (P-21).
22. Den strikta periodiciteten för arrangemanget av element i PSCE av D.I. Mendeleev förklaras helt av den successiva fyllningen av atomernas energinivåer (se punkt 20 ovan). Förstärkande positioner periodisk lag baserat på lagarna för förändring i den elektroniska strukturen av atomerna av element, först förutspådde av N. Bohr, upptäckten av det 72:a elementet bidrog. Grundämnet, som ännu inte upptäckts vid den tiden, söktes av kemister bland mineraler som innehåller sällsynta jordartsmetaller, baserat på den felaktiga premissen att 15 grundämnen skulle tillskrivas lantaniderna.
I analogi med övergångselementen bör antalet lantanider (grundämnen nr 58–71) vara lika med skillnaden mellan det maximala antalet elektroner pr. N Och M energinivåer
(32 - 18 = 14), dvs lika med det maximala antalet elektroner per f-undernivå (se punkt 19 ovan). Element med Z= 72 (hafnium Hf) är en analog av zirkonium Zr och har hittats i zirkoniummalmer.
23. Nästa viktig slutsats från analysen av tabellen. 6 i punkt 20 är slutsatsen om periodiciteten för att fylla atomernas externa energinivåer med elektroner, vilket bestämmer periodiciteten för förändringar i de kemiska egenskaperna hos element och deras föreningar.
Tabell 6
Elektroniska konfigurationer av atomer
första 20 elementen i det periodiska systemet
| Atom rum |
Valör- menande |
Lager | K | L | M | N |
| n | 1 | 2 | 3 | 4 | ||
| l | 0 | 0, 1 | 0, 1, 2 | 0, 1, 2, 3 | ||
| undernivå | 1s | 2s, 2sid | 3s, 3sid, 3d | 4s, 4sid, 4d, 4f | ||
| Antalet elektroner i en given undernivå | ||||||
| 1 2 |
H han |
1 2 |
||||
| 3 4 5 6 7 8 9 10 |
Li Vara B C N O F Ne |
2 2 2 2 2 2 2 2 |
1, 0 2, 0 2, 1 2, 2 2, 3 2, 4 2, 5 2, 6 |
|||
| 11 12 13 14 15 16 17 18 |
Na mg Al Si P S Cl Ar |
2 2 2 2 2 2 2 2 |
2, 6 2, 6 2, 6 2, 6 2, 6 2, 6 2, 6 2, 6 |
1, 0, 0 2, 0, 0 2, 1, 0 2, 2, 0 2, 3, 0 2, 4, 0 2, 5, 0 2, 6, 0 |
||
| 19 20 |
K Ca |
2 2 |
2, 6 2, 6 |
2, 6, 0 2, 6, 0 |
1, 0, 0, 0 2, 0, 0, 0 |
|
Så den andra perioden i tabellen för D.I. Mendeleev består av åtta element med följande undernivåer:
|
I övergången från litium till neon ökar laddningen av atomkärnan gradvis från Z= 3 till Z= 10, vilket betyder att attraktionskrafterna för elektroner till kärnan ökar, och som ett resultat minskar radierna för dessa elements atomer. Därför försvagas förmågan hos en atom att donera elektroner (en typiskt metallisk egenskap), som uttalas i litiumatomen, gradvis när den går från litium till fluor. Den senare är en typisk icke-metall, det vill säga ett element som är mer än andra som kan acceptera elektroner.
Börjar med nästa element efter neon (Na, Z= 11) atomernas elektroniska strukturer upprepas, och därför betecknas de elektroniska konfigurationerna av deras yttre elektronskal på ett liknande sätt ( n– periodnummer):
ns 1 (Li, Na), ns 2 (Be, Mg), ns 2 np 1 (B, Al), ns 2 np 2 (C, Si) etc.
I den fjärde perioden av tabellen för D.I. Mendeleev uppträder övergångselement som tillhör sekundära undergrupper.
24. Element som tillhör samma undergrupp har ett liknande arrangemang av elektroner på de yttre elektroniska nivåerna av atomer. Till exempel har halogenatomerna (huvudundergruppen i grupp VII) alla den elektroniska konfigurationen ns 2 np 5 , och atomerna i elementen i sidoundergruppen i samma grupp kännetecknas av den elektroniska konfigurationen ( n– 1)s 2 (n– 1)sid 6 (n– 1)d 5 ns 2 .
Vad är essensen av likheterna och skillnaderna mellan atomerna av element som tillhör olika undergrupper av samma grupp i tabellen för D.I. Mendeleev? Kontrollera dina slutsatser ytterligare med bilaga 1 (P-24).
25. Det numeriska värdet av valensen av en atom, bestämt av antalet kovalenta kemiska bindningar som bildas av den, återspeglar elementets position i D.I. Mendeleevs PSCE. I många fall är valensen av en atom av ett grundämne i en förening numeriskt lika med gruppnumret i D.I. Mendeleevs PSCE. Det finns dock undantag från denna regel. Till exempel, vid fosforatomen på den yttre (tredje, M) energinivån innehåller tre oparade elektroner (3 R-orbitaler) och fria valensceller d-orbitaler. Därför kännetecknas fosforatomen av den sk excitation elektron associerad med depairing av elektronparet och övergången av en av de resulterande oparade elektronerna till 3 d-orbital. För fosforatomens exciterade tillstånd är bildningen av fem kovalenta bindningar möjlig och för grundtillståndet endast tre.

För kväveatomen är det exciterade tillståndet atypiskt, eftersom i denna atom på den externa energinivån är antalet och tillståndet för elektroner detsamma som i fosforatomen, men det finns inga lediga celler och endast tre elektroner saknas för att slutföra och stabilisera denna nivå.
Varför är då den maximala valensen för kväveatomen i föreningar (d.v.s. förmågan att bilda vanliga elektronpar) fortfarande inte III, utan IV?
26. Upprepa stycken. 16, 17 metodutveckling, är det möjligt att förklara i vilken ordning elektroner fyller energinivåerna i atomerna hos element i den 4:e lång period PSHE D.I. Mendeleev. Den jämna serien av denna period börjar med element från huvudundergrupperna - 39 K och 40 Ca, som är typiska metaller med konstant valens, och redan från element nr 21 ( Z= 21, Sc) sedan kommer elementen i sekundära undergrupper, kallade d- element eller övergångar. Försök att förklara kärnan i dessa namn, ge relevanta exempel. Kontrollera att dina slutsatser är korrekta i framtiden med bilaga 1 (P-26).
27.
Det kemiska tecknet för väte H i D.I. Mendeleevs PSCE placeras också i huvudundergruppen
Grupp I, och in i huvudundergruppen av Grupp VII. Varför är detta tillåtet? Kontrollera i framtiden riktigheten av dina slutsatser i bilaga 1 (P-27).
Periodiskt system av element i Mendeleev.
Periodiskt system av kemiska grundämnen (Mendeleev bord) - klassificering kemiska grundämnen, som fastställer beroendet av olika egenskaper hos element på laddningen av atomkärnan.
Grupper
En grupp, eller familj, är en av kolumnerna i det periodiska systemet. Grupper kännetecknas som regel av mer uttalade periodiska trender än perioder eller block.
I enlighet med internationella systemet Namngrupper tilldelas nummer från 1 till 18 i riktning från vänster till höger - från alkalimetaller till ädelgaser.
Perioder
Period - en rad i det periodiska systemet. Inom en period visar elementen vissa mönster i alla tre av ovanstående aspekter (atomradie, joniseringsenergi och elektronegativitet), såväl som i elektronaffinitetsenergin.
Block
Med tanke på vikten av det yttre elektronskalet hos en atom beskrivs olika regioner i det periodiska systemet ibland som block, namngivna efter vilket skal den sista elektronen är i. S-blocket inkluderar de två första grupperna, det vill säga alkali- och jordalkalimetallerna, samt väte och helium; P-blocket består av de sex sista grupperna (13 till 18 enligt IUPAC-namnstandarden, eller IIIA till VIIIA enligt det amerikanska systemet) och inkluderar bland annat alla metalloider. D-block - dessa är grupper från 3 till 12 (IUPAC), de är också från IIIB till IIB i amerikansk stil, som inkluderar alla övergångsmetaller. F-blocket, som vanligtvis tas ut ur bordet, består av lantanider och aktinider.
D. I. Mendeleevs periodiska system har blivit en viktig milstolpe i utvecklingen av atom- och molekylärvetenskap. Tack vare henne, modernt koncept om ett kemiskt grundämne förfinades idéer om enkla ämnen och föreningar.
Atomkärnans sammansättning och egenskaper.
Atomkärna- den centrala delen av atomen, i vilken dess huvudmassa är koncentrerad (mer än 99,9%). Kärnan är positivt laddad, kärnans laddning bestämmer vilket kemiskt element som atomen är tilldelad.
Atomkärnan består av nukleoner - positivt laddade protoner och neutrala neutroner, som är sammankopplade med hjälp av en stark växelverkan.
Atomkärnan, betraktad som en klass av partiklar med ett visst antal protoner och neutroner, kallas vanligtvis nuklid.
Antalet protoner i kärnan kallas dess laddningsnummer - detta nummer är lika med ordningsnumret för det element som atomen tillhör, i tabellen (Periodic system of elements) av Mendeleev. Antalet protoner i kärnan bestämmer strukturen på elektronskalet hos en neutral atom och därmed de kemiska egenskaperna hos motsvarande grundämne. Antalet neutroner i en kärna kallas dess isotopnummer. Kärnor med samma antal protoner och olika antal neutroner kallas isotoper. Kärnor med samma antal neutroner men olika antal protoner kallas isotoner.
Det totala antalet nukleoner i en kärna kallas dess massatal () och är ungefär lika med medelmassan av en atom, som anges i det periodiska systemet. Nuklider med samma massnummer men olika proton-neutronsammansättning kallas isobarer.
Vikt
På grund av skillnaden i antalet neutroner har ett elements isotoper olika massor, vilket är en viktig egenskap hos kärnan. Inom kärnfysik mäts massan av kärnor vanligtvis i atommassaenheter ( men. äta.), för en a. e. m. ta 1/12 av massan av nukliden 12 C [sn 2] . Det bör noteras att standardmassan som vanligtvis ges för en nuklid är massan av en neutral atom. För att bestämma massan av kärnan är det nödvändigt att subtrahera summan av massorna av alla elektroner från atomens massa (ett mer exakt värde kommer att erhållas om vi också tar hänsyn till elektronernas bindningsenergi med kärnan) .
Dessutom används ofta massans energiekvivalent inom kärnfysik. Enligt Einstein-relationen motsvarar varje massvärde den totala energin:
Var är ljusets hastighet i vakuum.
Förhållandet mellan a. e.m. och dess energiekvivalent i joule:
och eftersom 1 elektronvolt \u003d 1,602176 10 −19 J, då energiekvivalenten till a. e. m. till MeV är lika med
Radie
En analys av sönderfallet av tunga kärnor förfinade Rutherfords uppskattning [SN 3] och relaterade kärnans radie till masstalet genom ett enkelt förhållande:
var är en konstant.
Eftersom kärnradien inte är rent geometrisk egenskap och är förknippad i första hand med kärnkrafternas verkningsradie, då beror värdet på processen, under analysen av vilken värdet erhölls, medelvärdet av m, alltså kärnans radie i meter
Avgift
Antalet protoner i en kärna bestämmer direkt dess elektrisk laddning Isotoper har samma antal protoner men olika antal neutroner. .
Laddningarna av atomkärnor bestämdes först av Henry Moseley 1913. Forskaren tolkade hans experimentella observationer genom att röntgenvåglängden var beroende av en viss konstant, som ändrades med en från element till element och lika med en för väte:
![]() , var
, var
Och - permanent.
Bindande energi av kärnor.
Kärnans bindningsenergi är lika med den minsta energi som måste förbrukas fullständig splittring kärnor till enskilda partiklar. Det följer av lagen om energibevarande att bindningsenergin är lika med den energi som frigörs under bildandet av en kärna från enskilda partiklar.
Bindningsenergin för vilken kärna som helst kan bestämmas genom att noggrant mäta dess massa. För närvarande har fysiker lärt sig att mäta massorna av partiklar - elektroner, protoner, neutroner, kärnor etc. - med mycket hög noggrannhet. Dessa mätningar visar det massan av någon kärna M i är alltid mindre än summan av massorna av dess ingående protoner och neutroner:
Denna energi frigörs under bildandet av kärnan i form av strålning av y-kvanta.
Kärnkrafter.
kärnkrafter är kortavstånd krafter. De uppträder endast på mycket små avstånd mellan nukleoner i kärnan i storleksordningen 10–15 m. Längden (1,5–2,2) 10–15 m kallas kärnkraftsområdet.
Kärnkrafter upptäcker avgiftsoberoende : attraktionen mellan två nukleoner är densamma oavsett nukleonernas laddningstillstånd - proton eller neutron. Kärnkrafternas laddningsoberoende framgår av en jämförelse av bindningsenergierna spegelkärnor . Vad kallas kärnorna?,där det totala antalet nukleoner är detsamma,men antalet protoner i den ena är lika med antalet neutroner i den andra.
Kärnkrafter har mättnadsegenskap , som visar sig i, att en nukleon i en kärna endast interagerar med ett begränsat antal angränsande nukleoner närmast den. Det är därför det observeras linjärt beroende bindande energier hos kärnor på deras massatal A. Nästan fullständig mättnad av kärnkrafter uppnås i α-partikeln, vilket är en mycket stabil formation.
Kärnkrafter är beroende av snurrriktningar interagerande nukleoner. Detta bekräftas av neutronspridningens olika karaktär av orto- och para-vätemolekyler. I ortovätemolekylen är spinnen av båda protonerna parallella med varandra, medan de i paravätemolekylen är antiparallella. Experiment har visat att spridningen av neutroner av paraväte är 30 gånger större än spridningen av ortoväte. Kärnkrafter är inte centrala.
Så låt oss lista kärnkrafternas allmänna egenskaper :
kort räckvidd av kärnkrafter ( R~ 1 fm);
stor kärnkraftspotential U~ 50 MeV;
· kärnkrafternas beroende av spinn av interagerande partiklar;
· tensorkaraktär av interaktion mellan nukleoner;
· kärnkrafter beror på den ömsesidiga orienteringen av nukleonens spinn och omloppsmoment (spin-omloppskrafter);
nukleär interaktion har egenskapen mättnad;
kärnkrafternas laddningsoberoende;
utbyte karaktär av kärnkraftsinteraktion;
attraktion mellan nukleoner på stora avstånd ( r> 1 fm), ersätts av repulsion vid liten ( r < 0,5 Фм).
6.6. Funktioner i den elektroniska strukturen av atomer av krom, koppar och några andra element
Om du noggrant tittade på bilaga 4, har du förmodligen märkt att för atomer av vissa grundämnen bryts sekvensen av att fylla orbitaler med elektroner. Ibland kallas dessa kränkningar "undantag", men det är inte så - det finns inga undantag från naturens lagar!
Det första elementet med en sådan överträdelse är krom. Låt oss överväga mer i detalj dess elektroniska struktur (Fig. 6.16 men). Kromatomen har 4 s-undernivå är inte två, som man kan förvänta sig, utan bara en elektron. Men för 3 d-undernivå fem elektroner, men denna undernivå fylls efter 4 s-undernivå (se fig. 6.4). För att förstå varför detta händer, låt oss titta på vad elektronmoln är 3 d undernivå av denna atom.
Var och en av de fem 3 d-moln i detta fall bildas av en elektron. Som du redan vet från § 4 i detta kapitel är det vanliga elektronmolnet för dessa fem elektroner sfäriskt, eller, som man säger, sfäriskt symmetriskt. Genom arten av elektrondensitetsfördelningen i olika riktningar liknar den 1 s-EO. Energin för den undernivå vars elektroner bildar ett sådant moln visar sig vara lägre än i fallet med ett mindre symmetriskt moln. I detta fall orbitalers energi 3 d-subnivå är lika med energi 4 s-orbitaler. När symmetrin bryts, till exempel, när den sjätte elektronen dyker upp, är orbitalens energi 3 d-subnivå blir återigen mer än energi 4 s-orbitaler. Därför har manganatomen återigen en andra elektron för 4 s-AO.
Sfärisk symmetri har ett gemensamt moln av vilken undernivå som helst fylld med elektroner både till hälften och helt. Minskningen av energi i dessa fall är av generell karaktär och beror inte på om någon undernivå är halv eller helt fylld med elektroner. Och i så fall måste vi leta efter nästa kränkning i atomen, i elektronskalet av vilket den nionde "kommer" sist d-elektron. Kopparatomen har faktiskt 3 d-undernivå 10 elektroner och 4 s- det finns bara en undernivå (Fig. 6.16 b).
Minskningen av energin hos orbitalerna i en helt eller halvfylld undernivå är orsaken till ett antal viktiga kemiska fenomen, av vilka du kommer att bli bekant med några.
6.7. Yttre och valenselektroner, orbitaler och subnivåer
I kemi studeras som regel inte egenskaperna hos isolerade atomer, eftersom nästan alla atomer, som är en del av olika ämnen, bildar kemiska bindningar. Kemiska bindningar bildas under interaktionen mellan atomernas elektronskal. För alla atomer (förutom väte) deltar inte alla elektroner i bildandet av kemiska bindningar: för bor tre av fem elektroner, för kol fyra av sex, och till exempel för barium två av femtio- sex. Dessa "aktiva" elektroner kallas valenselektroner.
Ibland förväxlas valenselektroner med extern elektroner, men de är inte samma sak.
De yttre elektronernas elektronmoln har den maximala radien (och det maximala värdet av det huvudsakliga kvanttalet).

Det är de yttre elektronerna som i första hand deltar i bildandet av bindningar, om så bara för att när atomerna närmar sig varandra kommer elektronmolnen som bildas av dessa elektroner i kontakt först och främst. Men tillsammans med dem kan en del av elektronerna också delta i bildandet av en bindning. pre-extern(näst sista) lagret, men bara om de har en energi som inte skiljer sig mycket från energin hos de yttre elektronerna. Både dessa och andra elektroner i atomen är valens. (I lantanider och aktinider är även vissa "pre-externa" elektroner valens)
Valenselektronernas energi är mycket större än energin hos andra elektroner i atomen, och valenselektroner skiljer sig mycket mindre i energi från varandra.
Yttre elektroner är alltid valens endast om atomen överhuvudtaget kan bilda kemiska bindningar. Så båda elektronerna i heliumatomen är externa, men de kan inte kallas valens, eftersom heliumatomen inte bildar några kemiska bindningar alls.
Valenselektroner upptar valens orbitaler, som i sin tur bildar valens undernivåer.

Som ett exempel, betrakta en järnatom vars elektroniska konfiguration visas i fig. 6.17. Av järnatomens elektroner är det maximala huvudsakliga kvantantal ( n= 4) har bara två 4 s-elektron. Därför är de de yttre elektronerna i denna atom. Järnatomens yttre orbitaler är alla orbitaler med n= 4, och de yttre undernivåerna är alla undernivåerna som bildas av dessa orbitaler, det vill säga 4 s-,
4sid-, 4d- och 4 f-EPU.
Yttre elektroner är alltid valens, därför 4 s-elektroner i en järnatom är valenselektroner. Och i så fall 3 d-elektroner med något högre energi kommer också att vara valens. På den yttre nivån av järnatomen, förutom de fyllda 4 s-AO det finns fortfarande 4 lediga sid-, 4d- och 4 f-AO. Alla är externa, men endast 4 är valens R-AO, eftersom energin i de återstående orbitalerna är mycket högre, och förekomsten av elektroner i dessa orbitaler är inte fördelaktigt för järnatomen.
Alltså järnatomen
extern elektronisk nivå - den fjärde,
yttre undernivåer - 4 s-, 4sid-, 4d- och 4 f-EPU,
yttre orbitaler - 4 s-, 4sid-, 4d- och 4 f-AO,
yttre elektroner - två 4 s-elektron (4 s 2),
det yttre elektronlagret är det fjärde,
externt elektronmoln - 4 s-EO
valens undernivåer - 4 s-, 4sid- och 3 d-EPU,
valens orbitaler - 4 s-, 4sid- och 3 d-AO,
valenselektroner - två 4 s-elektron (4 s 2) och sex 3 d-elektroner (3 d 6).
Valenssubnivåer kan vara delvis eller helt fyllda med elektroner, eller så kan de överhuvudtaget förbli fria. Med en ökning av kärnans laddning minskar energivärdena för alla undernivåer, men på grund av interaktionen av elektroner med varandra minskar energin för olika undernivåer med olika "hastighet". Energin av fullt fylld d- Och f-subnivåer minskar så mycket att de upphör att vara valens.
Som ett exempel, betrakta atomerna av titan och arsenik (Fig. 6.18).

När det gäller titanatom 3 d-EPU är endast delvis fylld med elektroner, och dess energi är större än energin av 4 s-EPU och 3 d-elektroner är valens. Vid arsenikatomen 3 d-EPU är helt fylld med elektroner, och dess energi är mycket mindre än energi 4 s-EPU, och därför 3 d-elektroner är inte valens.
I dessa exempel analyserade vi valens elektronisk konfiguration titan- och arsenikatomer.
En atoms valens elektroniska konfiguration avbildas som valens elektronisk formel, eller i formen energidiagram över valensundernivåer.
VALENSELEKTRONER, EXTERNA ELEKTRONER, VALENS EPU, VALENS AO, VALENSELEKTRONS KONFIGURATION AV ATOMEN, VALENSELEKTRONFORMEL, VALENS UNDERLIVSDIAGRAM.
1. På energidiagrammen du har sammanställt och i de fullständiga elektroniska formlerna för atomerna Na, Mg, Al, Si, P, S, Cl, Ar, ange de yttre elektronerna och valenselektronerna. Skriv valens elektroniska formler för dessa atomer. På energidiagrammen markerar du de delar som motsvarar energidiagrammen för valensundernivåerna.
2. Vad är gemensamt mellan de elektroniska konfigurationerna av atomer a) Li och Na, B och Al, O och S, Ne och Ar; b) Zn och Mg, Sc och Al, Cr och S, Ti och Si; c) H och He, Li och O, K och Kr, Sc och Ga. Vilka är deras skillnader
3. Hur många valensundernivåer finns i elektronskalet för en atom av vart och ett av elementen: a) väte, helium och litium, b) kväve, natrium och svavel, c) kalium, kobolt och germanium
4. Hur många valensorbitaler är helt fyllda vid atomen av a) bor, b) fluor, c) natrium?
5. Hur många orbitaler med en oparad elektron har en atom a) bor, b) fluor, c) järn
6. Hur många fria yttre orbitaler har en manganatom? Hur många fria valenser?
7. För nästa lektion, förbered en pappersremsa 20 mm bred, dela den i celler (20 × 20 mm) och applicera en naturlig serie av element på denna remsa (från väte till meitnerium).
8. I varje cell, placera symbolen för elementet, dess serienummer och valens elektroniska formel, som visas i fig. 6.19 (använd bilaga 4).

6.8. Systematisering av atomer enligt strukturen av deras elektronskal
Systematiseringen av kemiska grundämnen är baserad på den naturliga serien av grundämnen
Och principen om likhet mellan elektronskal deras atomer.
Du är redan bekant med det naturliga utbudet av kemiska element. Låt oss nu bekanta oss med principen om likhet mellan elektronskal.
Med tanke på de elektroniska valensformlerna för atomer i NRE är det lätt att upptäcka att för vissa atomer skiljer de sig endast i värdena för huvudkvantnumret. Till exempel, 1 s 1 för väte, 2 s 1 för litium, 3 s 1 för natrium, etc. Eller 2 s 2 2sid 5 för fluor, 3 s 2 3sid 5 för klor, 4 s 2 4sid 5 för brom, etc. Detta betyder att de yttre områdena av molnen av valenselektroner hos sådana atomer är mycket lika i form och skiljer sig endast i storlek (och, naturligtvis, i elektrontäthet). Och om så är fallet, kan elektronmolnen för sådana atomer och deras motsvarande valenskonfigurationer kallas liknande. För atomer av olika grundämnen med liknande elektroniska konfigurationer kan vi skriva vanliga valens elektroniska formler: ns 1 i det första fallet och ns 2 np 5 i tvåan. När man rör sig längs den naturliga serien av element kan man hitta andra grupper av atomer med liknande valenskonfigurationer.
På det här sättet, i den naturliga serien av element förekommer regelbundet atomer med liknande valenselektroniska konfigurationer.
Detta är principen om likhet mellan elektronskal.
Låt oss försöka avslöja formen för denna regelbundenhet. För att göra detta kommer vi att använda den naturliga serien av element du gjort.

NRE börjar med väte, vars valens elektroniska formel är 1 s ett . På jakt efter liknande valenskonfigurationer skär vi den naturliga serien av element framför element med en vanlig valens elektronisk formel ns 1 (det vill säga före litium, före natrium, etc.). Vi har fått så kallade "perioder" av element. Låt oss lägga till de resulterande "perioderna" så att de blir tabellrader (se figur 6.20). Som ett resultat kommer endast atomerna i de två första kolumnerna i tabellen att ha sådana elektroniska konfigurationer.
Låt oss försöka uppnå likheter mellan valens elektroniska konfigurationer i andra kolumner i tabellen. För att göra detta skär vi ut element med nummer 58 - 71 och 90 -103 från den 6:e och 7:e perioden (de har 4 f- och 5 f-sublevels) och placera dem under bordet. Symbolerna för de återstående elementen kommer att flyttas horisontellt som visas i figuren. Därefter kommer atomerna i elementen i samma kolumn i tabellen att ha liknande valenskonfigurationer, som kan uttryckas i allmänna valenselektroniska formler: ns 1 , ns 2 , ns 2 (n–1)d 1 , ns 2 (n–1)d 2 och så vidare tills ns 2 np 6. Alla avvikelser från de allmänna valensformlerna förklaras av samma orsaker som i fallet med krom och koppar (se avsnitt 6.6).
Som du kan se, genom att använda NRE och tillämpa principen om likhet mellan elektronskal, lyckades vi systematisera de kemiska elementen. Ett sådant system av kemiska element kallas naturlig, eftersom den enbart bygger på naturens lagar. Tabellen vi fick (fig. 6.21) är ett av sätten att grafiskt avbilda ett naturligt system av element och kallas lång periodtabell över kemiska grundämnen.

PRINCIPEN OM LIKHET FÖR ELEKTRONISKA SKAL, NATURLIGT SYSTEM AV KEMISKA ELEMENT ("PERIODISKA" SYSTEM), TABEL ÖVER KEMISKA ELEMENT.
6.9. Lång periodtabell över kemiska grundämnen
Låt oss bekanta oss mer detaljerat med strukturen av långperiodtabellen för kemiska element.
Raderna i denna tabell, som du redan vet, kallas "perioder" av elementen. Perioder numreras med arabiska siffror från 1 till 7. Det finns bara två element i den första perioden. Den andra och tredje perioden, som innehåller åtta element vardera, kallas kort perioder. Den fjärde och femte perioden, som innehåller 18 element vardera, kallas lång perioder. Den sjätte och sjunde perioden, som innehåller 32 element vardera, kallas extra lång perioder.
Kolumnerna i denna tabell kallas grupper element. Gruppnummer anges med romerska siffror med latinska bokstäver A eller B.
Elementen i vissa grupper har sina egna gemensamma (grupp)namn: element i IA-gruppen (Li, Na, K, Rb, Cs, Fr) - alkaliska grundämnen(eller alkalimetallelement); grupp IIA-element (Ca, Sr, Ba och Ra) - alkaliska jordartsmetaller(eller alkaliska jordartsmetaller)(namnet "alkalimetaller" och alkaliska jordartsmetaller" hänvisar till enkla ämnen som bildas av motsvarande grundämnen och bör inte användas som namn på grupper av grundämnen); grundämnen i grupp VIA (O, S, Se, Te, Po) - kalkogener, element i grupp VIIA (F, Cl, Br, I, At) – halogener, element i grupp VIIIA (He, Ne, Ar, Kr, Xe, Rn) – ädelgaselement.(Det traditionella namnet "ädelgaser" gäller även för enkla ämnen)
De element som vanligtvis placeras i den nedre delen av tabellen med serienummer 58 - 71 (Ce - Lu) kallas lantanider("efter lantan") och element med serienummer 90 - 103 (Th - Lr) - aktinider("efter aktinium"). Det finns en variant av långperiodstabellen, där lantaniderna och aktiniderna inte skärs ut ur NRE, utan stannar kvar på sina ställen under extra långa perioder. Denna tabell kallas ibland extra lång period.
Den långa periodtabellen är uppdelad i fyra blockera(eller avsnitt).
s-block innehåller element av IA- och IIA-grupper med vanliga elektroniska valensformler ns 1 och ns 2
(s-element).
p-block innehåller element från grupp IIIA till VIIIA med vanliga valens elektroniska formler från ns 2 np 1 till ns 2 np 6 (p-element).
d-block innehåller element från IIIB till IIB grupp med vanliga valens elektroniska formler från ns 2 (n–1)d 1 till ns 2 (n–1)d 10 (d-element).
f-block inkluderar lantanider och aktinider ( f-element).

Element s- Och sid-block bildar A-grupper och element d-block - B-grupp av ett system av kemiska element. Allt f-element ingår formellt i grupp IIIB.
Grundämnena i den första perioden - väte och helium - är s-element och kan placeras i IA- och IIA-grupper. Men helium placeras oftare i grupp VIIIA som det element med vilket perioden slutar, vilket är helt förenligt med dess egenskaper (helium, liksom alla andra enkla ämnen som bildas av element i denna grupp, är en ädelgas). Väte placeras ofta i grupp VIIA, eftersom dess egenskaper är mycket närmare halogener än alkaliska element.
Var och en av perioderna i systemet börjar med ett element som har en valenskonfiguration av atomer ns 1 , eftersom det är från dessa atomer som bildningen av nästa elektronskikt börjar och slutar med ett element med atomernas valenskonfiguration ns 2 np 6 (förutom den första perioden). Detta gör det enkelt att identifiera grupper av undernivåer i energidiagrammet som är fyllda med elektroner vid atomerna i var och en av perioderna (Fig. 6.22). Gör det här arbetet med alla undernivåer som visas i kopian du gjorde av figur 6.4. Undernivåerna som är markerade i figur 6.22 (förutom för helt ifyllda d- Och f-subnivåer) är valens för atomer av alla element under en given period.
Utseende i perioder s-, sid-, d- eller f-element är helt förenliga med fyllningssekvensen s-, sid-, d- eller f- undernivåer av elektroner. Denna egenskap hos elementsystemet gör det möjligt att, med kännedom om perioden och gruppen, som inkluderar ett givet element, omedelbart skriva ner dess valens elektroniska formel.
LÅNGPERIODSTABEL ÖVER KEMISKA ELEMENT, BLOCK, PERIODER, GRUPPER, ALKALISKA ELEMENT, ALKALISKA JORDELEMENT, KALKOGENER, HALOGENER, ÄDELGASELEMENT, LANTANOIDER, AKTINOIDER.
Skriv ner de allmänna valenselektroniska formlerna för elementens atomer a) IVA- och IVB-grupper, b) IIIA- och VIIB-grupper?
2. Vad är gemensamt mellan de elektroniska konfigurationerna av atomerna i element A- och B-grupper? Hur skiljer de sig åt?
3. Hur många grupper av element ingår i a) s-block, b) R-block, c) d-blockera?
4. Fortsätt figur 30 i riktning mot att öka energin för undernivåer och välj grupper av undernivåer som är fyllda med elektroner i den 4:e, 5:e och 6:e perioden.
5. Lista valensundernivåerna för atomerna a) kalcium, b) fosfor, c) titan, d) klor, e) natrium. 6. Formulera hur s-, p- och d-element skiljer sig från varandra.
7. Förklara varför en atom tillhör något grundämne bestäms av antalet protoner i kärnan och inte av denna atoms massa.
8. För atomer av litium, aluminium, strontium, selen, järn och bly, gör valens, kompletta och förkortade elektroniska formler och rita energidiagram över valensundernivåer. 9. De atomer av vilka element motsvarar följande valens elektroniska formler: 3 s 1 , 4s 1 3d 1 , 2s 2 2 sid 6 , 5s 2 5sid 2 , 5s 2 4d 2 ?
6.10. Typer av elektroniska formler för atomen. Algoritmen för deras sammanställning
För olika ändamål behöver vi veta antingen den fullständiga eller valenskonfigurationen för en atom. Var och en av dessa elektroniska konfigurationer kan representeras både av en formel och av ett energidiagram. d.v.s. fullständig elektronisk konfiguration av en atom uttryckt den fullständiga elektroniska formeln för atomen, eller fullt energidiagram för en atom. I sin tur, valenselektronkonfiguration för en atom uttryckt valens(eller, som det ofta kallas, " kort") atomens elektroniska formel, eller diagram över valens undernivåer av en atom(Fig. 6.23).

Tidigare gjorde vi elektroniska formler för atomer med hjälp av elementens ordningsnummer. Samtidigt bestämde vi sekvensen för att fylla undernivåer med elektroner enligt energidiagrammet: 1 s, 2s,
2sid, 3s, 3sid, 4s, 3d, 4sid, 5s, 4d, 5sid,
6s, 4f, 5d, 6sid, 7s etc. Och bara genom att skriva ner den fullständiga elektroniska formeln kunde vi också skriva ner valensformeln.
Det är bekvämare att skriva den elektroniska valensformeln för atomen, som oftast används, baserat på elementets position i systemet av kemiska element, enligt periodgruppkoordinaterna.
Låt oss överväga i detalj hur detta görs för element s-, sid- Och d-block.
För element s-blockvalens elektronisk formel för en atom består av tre symboler. Generellt kan det skrivas så här:
I första hand (i stället för en stor cell) är periodtalet (lika med huvudkvanttalet för dessa s-elektroner), och på den tredje (i överskriften) - gruppens nummer (lika med antalet valenselektroner). Om vi tar som exempel en magnesiumatom (3:e perioden, grupp IIA), får vi:
För element sid-blockvalens elektronisk formel för en atom består av sex symboler:
![]()
Här, i stället för stora celler, sätts även periodnumret (lika med huvudkvanttalet för dessa s- Och sid-elektroner), och grupptalet (lika med antalet valenselektroner) visar sig vara lika med summan av de upphöjda. För syreatomen (2:a perioden, VIA-grupp) får vi:
2s 2 2sid 4 .
Valens elektronisk formel för de flesta element d block kan skrivas så här:
Som i tidigare fall, här istället för den första cellen, sätts periodnumret (lika med huvudkvantnumret för dessa s-elektroner). Antalet i den andra cellen visar sig vara ett mindre, eftersom huvudkvantnumret av dessa d-elektroner. Gruppnumret här är också lika med summan av indexen. Ett exempel är den elektroniska valensformeln för titan (4:e perioden, IVB-grupp): 4 s 2 3d 2 .
Gruppnumret är lika med summan av indexen och för elementen i VIB-gruppen, men de, som ni minns, på valensen s-subnivå har bara en elektron, och den allmänna valens elektroniska formeln ns 1 (n–1)d fem. Därför är den elektroniska valensformeln, till exempel för molybden (5:e perioden) 5 s 1 4d 5 .
Det är också lätt att göra en valens elektronisk formel för alla element i IB-gruppen, till exempel guld (6:e perioden)>–>6 s 1 5d 10 , men i det här fallet måste du komma ihåg det d- elektronerna i atomerna i elementen i denna grupp förblir fortfarande valens, och några av dem kan delta i bildandet av kemiska bindningar.
Den allmänna valens elektroniska formeln för atomer i grupp IIB-element är - ns 2 (n – 1)d 10 . Därför är den elektroniska valensformeln, till exempel, för en zinkatom 4 s 2 3d 10 .
Generella regler de elektroniska valensformlerna för elementen i förstatriaden (Fe, Co och Ni) lyder också. Järn, ett element i grupp VIIIB, har en valens elektronisk formel på 4 s 2 3d 6. Koboltatomen har en d-elektron mer (4 s 2 3d 7), medan nickelatomen har två (4 s 2 3d 8).
Genom att endast använda dessa regler för att skriva valens elektroniska formler är det omöjligt att komponera de elektroniska formlerna för atomer i vissa d-element (Nb, Ru, Rh, Pd, Ir, Pt), eftersom i dem, på grund av tendensen till mycket symmetriska elektronskal, har fyllningen av valensundernivåer med elektroner några ytterligare funktioner.
Genom att känna till den elektroniska valensformeln kan man också skriva ner den fullständiga elektroniska formeln för atomen (se nedan).
Ofta, istället för krångliga fullständiga elektroniska formler, skriver de ner förkortade elektroniska formler atomer. För att sammanställa dem i den elektroniska formeln väljs alla elektroner i atomen utom valensen, deras symboler placeras inom hakparenteser och den del av den elektroniska formeln som motsvarar den elektroniska formeln för atomen i det sista elementet i föregående period (grundämnet som bildar ädelgasen) ersätts med symbolen för denna atom.
Exempel på elektroniska formler av olika typer visas i Tabell 14.
Tabell 14 Exempel på elektroniska formler för atomer
Elektroniska formler |
|||
förkortad |
Valens |
||
1s 2 2s 2 2sid 3 |
2s 2 2sid 3 |
2s 2 2sid 3 |
|
1s 2 2s 2 2sid 6 3s 2 3sid 5 |
3s 2 3sid 5 |
3s 2 3sid 5 |
|
1s 2 2s 2 2sid 6 3s 2 3sid 6 4s 2 3d 5 |
4s 2 3d 5 |
4s 2 3d 5 |
|
1s 2 2s 2 2sid 6 3s 2 3sid 6 3d 10 4s 2 4sid 3 |
4s 2 4sid 3 |
4s 2 4sid 3 |
|
1s 2 2s 2 2sid 6 3s 2 3sid 6 3d 10 4s 2 4sid 6 |
4s 2 4sid 6 |
4s 2 4sid 6 |
|
Algoritm för att sammanställa elektroniska formler för atomer (på exemplet med en jodatom)
№ |
Drift |
Resultat |
|
Bestäm koordinaterna för atomen i elementtabellen. |
Period 5, grupp VIIA |
||
Skriv den elektroniska valensformeln. |
5s 2 5sid 5 |
||
Lägg till symbolerna för de inre elektronerna i den ordning som de fyller undernivåerna. |
1s 2 2s 2 2sid 6 3s 2 3sid 6 4s 2 3d 10 4sid 6 5s 2 4d 10 5sid 5 |
||
Med hänsyn till minskningen av energin i helt fylld d- Och f- undernivåer, skriv ner den fullständiga elektroniska formeln. |
|
||
Märk valenselektronerna. |
1s 2 2s 2 2sid 6 3s 2 3sid 6 3d 10 4s 2 4sid 6 4d 10 5s 2 5sid 5 |
||
Välj den elektroniska konfigurationen för föregående ädelgasatom. |
|||
Skriv ner den förkortade elektroniska formeln, kombinera alla inom hakparenteser icke-valent elektroner. |
5s 2 5sid 5 |
Anteckningar
1. För element i den 2:a och 3:e perioden leder den tredje operationen (utan den fjärde) omedelbart till en komplett elektronisk formel.
2. (n – 1)d 10 - Elektroner förblir valens vid atomerna i elementen i IB-gruppen.
KOMPLETT ELEKTRONISK FORMEL, VALENS ELEKTRONISK FORMEL, förkortad ELEKTRONISK FORMEL, ALGORITM FÖR SAMMANSTÄLLNING AV ELEKTRONISK FORMEL FÖR ATOMER.
1. Sammanställ den elektroniska valensformeln för elementets atom a) den andra perioden i den tredje A-gruppen, b) den tredje perioden i den andra A-gruppen, c) den fjärde perioden i den fjärde A-gruppen.
2. Gör förkortade elektroniska formler av magnesium-, fosfor-, kalium-, järn-, brom- och argonatomer.
6.11. Kort periodtabell över kemiska grundämnen
Under de mer än 100 år som har gått sedan upptäckten av det naturliga systemet av element har flera hundra av de mest olikartade tabellerna föreslagits som grafiskt återspeglar detta system. Av dessa används, förutom långperiodtabellen, den så kallade kortperiodtabellen över element av D. I. Mendeleev mest. En kortperiodtabell erhålls från en långperiod, om den 4:e, 5:e, 6:e och 7:e perioden skärs före elementen i IB-gruppen, flyttas isär och de resulterande raderna läggs till på samma sätt som vi lade till perioder innan. Resultatet visas i figur 6.24.

Även lantaniderna och aktiniderna placeras här under huvudbordet.
I grupper denna tabell innehåller element vars atomer har samma antal valenselektroner oavsett vilka orbitaler dessa elektroner befinner sig i. Så, grundämnena klor (ett typiskt grundämne som bildar en icke-metall; 3 s 2 3sid 5) och mangan (metallbildande element; 4 s 2 3d 5), som inte har likheten med elektronskal, faller här i samma sjunde grupp. Behovet av att skilja mellan sådana element gör det nödvändigt att peka ut i grupper undergrupper: huvud- analoger till A-grupper i långperiodtabellen och bieffekterär analoger till B-grupper. I figur 34 är symbolerna för elementen i huvudundergrupperna förskjutna åt vänster, och symbolerna för elementen i de sekundära undergrupperna förskjuts åt höger.
Det är sant att ett sådant arrangemang av element i tabellen också har sina fördelar, eftersom det är antalet valenselektroner som i första hand bestämmer valensförmågan hos en atom.
Långperiodtabellen återspeglar lagarna för atomernas elektroniska struktur, likheten och mönstren för förändringar i egenskaperna hos enkla ämnen och föreningar genom grupper av grundämnen, den regelbundna förändringen i ett antal fysikaliska kvantiteter som kännetecknar atomer, enkla ämnen och föreningar genom hela systemet av element, och mycket mer. Den korta periodtabellen är mindre bekväm i detta avseende.
KORTPERIODSTABELL, HUVUDUNDERGRUPPER, SEKUNDÄRA UNDERGRUPPER.
1. Konvertera långperiodtabellen du byggde från den naturliga serien av element till en kortperiodtabell. Utför den omvända omvandlingen.
2. Är det möjligt att göra en allmän valens elektronisk formel för atomer av element i en grupp i en kortperiodtabell? Varför?
6.12. Atomstorlekar. Orbitala radier
.Atomen har inga tydliga gränser. Vad anses vara storleken på en isolerad atom? Kärnan i en atom är omgiven av ett elektronskal, och skalet består av elektronmoln. Storleken på EO kännetecknas av en radie r oo. Alla moln i det yttre lagret har ungefär samma radie. Därför kan storleken på en atom karakteriseras av denna radie. Det kallas en atoms omloppsradie(r 0).
Värdena på atomernas omloppsradier ges i bilaga 5.
Radien för EO beror på kärnans laddning och på vilken omloppsbana elektronen som bildar detta moln finns. Följaktligen beror också en atoms omloppsradie på samma egenskaper.
Tänk på elektronskalen hos väte- och heliumatomer. Både i väteatomen och i heliumatomen finns elektroner på 1 s-AO, och deras moln skulle ha samma storlek om laddningarna av kärnorna i dessa atomer var desamma. Men laddningen av kärnan i en heliumatom är dubbelt så stor som laddningen av kärnan i en väteatom. Enligt Coulombs lag är attraktionskraften som verkar på var och en av elektronerna i en heliumatom dubbelt så stor som attraktionskraften hos en elektron till kärnan i en väteatom. Därför måste radien för en heliumatom vara mycket mindre än radien för en väteatom. Detta är sant: r 0 (han) / r 0 (H) \u003d 0,291 E / 0,529 E 0,55.
Litiumatomen har en yttre elektron vid 2 s-AO, det vill säga, bildar ett moln av det andra lagret. Naturligtvis bör dess radie vara större. Verkligen: r 0 (Li) = 1,586 E.
Atomerna i de återstående elementen i den andra perioden har externa elektroner (och 2 s, och 2 sid) placeras i samma andra elektronlager, och laddningen av kärnan i dessa atomer ökar med ökande serienummer. Elektroner attraheras starkare till kärnan, och naturligtvis minskar atomernas radier. Vi skulle kunna upprepa dessa argument för atomerna i elementen från andra perioder, men med ett förtydligande: omloppsradien minskar monotont endast när var och en av undernivåerna är fyllda.
Men om vi ignorerar detaljerna, är den allmänna karaktären av förändringen i storleken på atomer i ett system av element som följer: med en ökning av serienumret under en period minskar atomernas omloppsradier och i en grupp de ökar. Den största atomen är en cesiumatom och den minsta är en heliumatom, men av atomerna i de grundämnen som bildar kemiska föreningar (helium och neon bildar dem inte) är den minsta en fluoratom.
De flesta av elementens atomer, som står i den naturliga serien efter lantaniderna, har omloppsradier något mindre än man skulle förvänta sig, baserat på allmänna lagar. Detta beror på det faktum att 14 lantanider är belägna mellan lantan och hafnium i systemet av element, och följaktligen är hafniumatomens kärnladdning 14 e mer än lantan. Därför attraheras de yttre elektronerna av dessa atomer till kärnan starkare än de skulle attraheras i frånvaro av lantanider (denna effekt kallas ofta "lantanidkontraktion").
Observera att när man går från atomer av element i grupp VIIIA till atomer av element i grupp IA, ökar omloppsradien abrupt. Följaktligen visade sig vårt val av de första elementen i varje period (se § 7) vara korrekt.
ATOMENS ORBITRADIUS, DESS FÖRÄNDRING I SYSTEMET AV ELEMENT.
1. Enligt de uppgifter som ges i bilaga 5, rita på diagrampapper beroendet av atomens omloppsradie på grundämnets serienummer för grundämnen med Z från 1 till 40. Längden på den horisontella axeln är 200 mm, längden på den vertikala axeln är 100 mm.
2. Hur kan du karakterisera utseendet på den resulterande brutna linjen?
6.13. En atoms joniseringsenergi
Om du ger en elektron i en atom ytterligare energi (du lär dig hur man gör detta från en fysikkurs), så kan elektronen gå till en annan AO, det vill säga att atomen hamnar i upphetsat tillstånd. Detta tillstånd är instabilt, och elektronen kommer nästan omedelbart att återgå till sitt ursprungliga tillstånd, och överskottsenergi kommer att frigöras. Men om energin som ges till elektronen är tillräckligt stor kan elektronen helt bryta sig loss från atomen, medan atomen joniserad, det vill säga den förvandlas till en positivt laddad jon ( katjon). Den energi som behövs för att göra detta kallas en atoms joniseringsenergi(E Och).
Det är ganska svårt att riva av en elektron från en enda atom och mäta den energi som krävs för detta, därför är det praktiskt taget bestämt och används molär joniseringsenergi(E och m).
Molär joniseringsenergi visar vad som är den minsta energi som krävs för att lossa 1 mol elektroner från 1 mol atomer (en elektron från varje atom). Detta värde mäts vanligtvis i kilojoule per mol. Värdena på den molära joniseringsenergin för den första elektronen för de flesta grundämnen ges i bilaga 6.
Hur beror joniseringsenergin hos en atom på elementets position i elementsystemet, det vill säga hur förändras den i gruppen och perioden?
I fysiska termer är joniseringsenergin lika med det arbete som måste spenderas för att övervinna attraktionskraften från en elektron till en atom när en elektron flyttas från en atom till ett oändligt avstånd från den.
var qär laddningen av en elektron, Fär laddningen av katjonen som finns kvar efter avlägsnandet av en elektron, och r o är atomens omloppsradie.
OCH q, Och Fär konstanta värden, och man kan dra slutsatsen att arbetet med att lossa en elektron MEN, och med den joniseringsenergin E och är omvänt proportionella mot atomens omloppsradie.
Efter att ha analyserat värdena för omloppsradien för atomer av olika element och motsvarande värden för joniseringsenergin som anges i bilagorna 5 och 6, kan du se att förhållandet mellan dessa värden är nära proportionellt, men något annorlunda än den. Anledningen till att vår slutsats inte stämmer väl överens med experimentdata är att vi använt en mycket grov modell som inte tar hänsyn till många signifikanta faktorer. Men även denna grova modell tillät oss att dra den korrekta slutsatsen att med en ökning av omloppsradien minskar joniseringsenergin hos en atom och omvänt, med en minskning av radien ökar den.
Eftersom atomernas omloppsradie minskar under en period med en ökning av serienumret, ökar joniseringsenergin. I en grupp, när atomnumret ökar, ökar atomernas omloppsradie som regel, och joniseringsenergin minskar. Den högsta molära joniseringsenergin finns i de minsta atomerna, heliumatomer (2372 kJ/mol), och av de atomer som kan bilda kemiska bindningar, i fluoratomer (1681 kJ/mol). Den minsta är för de största atomerna, cesiumatomer (376 kJ/mol). I ett system av element kan riktningen för ökande joniseringsenergi visas schematiskt enligt följande: 
Inom kemin är det viktigt att joniseringsenergin kännetecknar en atoms benägenhet att donera "sina" elektroner: ju större joniseringsenergin är, desto mindre benägen är atomen att donera elektroner, och vice versa.
Exciterat tillstånd, jonisering, katjon, joniseringsenergi, molär joniseringsenergi, förändring i joniseringsenergi i ett system av element.
1. Använd data som ges i bilaga 6 och bestäm hur mycket energi du behöver spendera för att slita bort en elektron från alla natriumatomer med en total massa på 1 g.
2. Använd data som ges i bilaga 6 och bestäm hur många gånger mer energi som behövs för att lossa en elektron från alla natriumatomer med en massa på 3 g än från alla kaliumatomer med samma massa. Varför skiljer sig detta förhållande från förhållandet mellan de molära joniseringsenergierna för samma atomer?
3. Enligt uppgifterna i bilaga 6, plotta beroendet av den molära joniseringsenergin på serienumret för grundämnen med Z från 1 till 40. Dimensionerna på grafen är desamma som i uppgiften för föregående stycke. Se om denna graf matchar valet av "perioder" i elementsystemet.
6.14. Elektronaffinitetsenergi
.Den näst viktigaste energiegenskapen för en atom är elektronaffinitetsenergi(E från).
I praktiken, som i fallet med joniseringsenergi, används vanligtvis motsvarande molära kvantitet - molär elektronaffinitetsenergi().
Den molära energin för elektronaffinitet visar vilken energi som frigörs när en mol elektroner läggs till en mol neutrala atomer (en elektron till varje atom). Liksom den molära joniseringsenergin mäts även denna mängd i kilojoule per mol.
Vid första anblicken kan det tyckas att energi inte bör frigöras i detta fall, eftersom en atom är en neutral partikel, och det finns inga elektrostatiska attraktionskrafter mellan en neutral atom och en negativt laddad elektron. Tvärtom, när man närmar sig atomen borde elektronen, verkar det som, stötas bort av samma negativt laddade elektroner som bildar elektronskalet. Detta är faktiskt inte sant. Kom ihåg om du någonsin har hanterat atomärt klor. Självklart inte. Det finns trots allt bara vid mycket höga temperaturer. Ännu mer stabilt molekylärt klor finns praktiskt taget inte i naturen - om nödvändigt måste det erhållas med kemiska reaktioner. Och du måste ta itu med natriumklorid (vanligt salt) hela tiden. När allt kommer omkring konsumeras bordssalt av en person med mat varje dag. Och det är ganska vanligt i naturen. Men trots allt innehåller bordssalt kloridjoner, det vill säga kloratomer som har fäst en "extra" elektron var. En av anledningarna till denna förekomst av kloridjoner är att kloratomer har en tendens att fästa elektroner, det vill säga när kloridjoner bildas av kloratomer och elektroner frigörs energi.
En av anledningarna till frigörandet av energi är redan känd för dig - det är förknippat med en ökning av symmetrin hos kloratomens elektronskal under övergången till en enladdad anjon. Samtidigt, som du minns, energi 3 sid- undernivån minskar. Det finns andra mer komplexa skäl.
På grund av det faktum att flera faktorer påverkar värdet av elektronaffinitetsenergin, är arten av förändringen i detta värde i ett system av element mycket mer komplex än arten av förändringen i joniseringsenergin. Du kan verifiera detta genom att analysera tabellen i bilaga 7. Men eftersom värdet på denna kvantitet bestäms, först och främst, av samma elektrostatiska interaktion som värdena för joniseringsenergin, då dess förändring i systemet av element (enligt minst i A-grupper) i allmänna termer liknar en förändring i joniseringsenergin, det vill säga energin för elektronaffinitet i gruppen minskar, och under perioden ökar den. Det är maximalt vid atomerna fluor (328 kJ/mol) och klor (349 kJ/mol). Naturen av förändringen i elektronaffinitetsenergin i systemet av element liknar naturen av förändringen i joniseringsenergin, det vill säga riktningen för ökningen av elektronaffinitetsenergin kan schematiskt visas enligt följande:
2. Plotta på samma skala längs den horisontella axeln som i de föregående uppgifterna beroendet av elektronaffinitetens molära energi på serienumret för atomer av element med Z från 1 till 40 med app 7.
3. Vad är den fysiska innebörden av negativa elektronaffinitetsenergier?
4. Varför, av alla atomer i elementen i den andra perioden, är det bara beryllium, kväve och neon som har negativa värden på den molära energin för elektronaffinitet?
6.15. Atomers tendens att donera och få elektroner
Du vet redan att en atoms benägenhet att donera sina egna och ta emot främmande elektroner beror på dess energiegenskaper (joniseringsenergi och elektronaffinitetsenergi). Vilka atomer är mer benägna att donera sina elektroner, och vilka är mer benägna att ta emot främlingar?
För att besvara denna fråga, låt oss i Tabell 15 sammanfatta allt vi vet om förändringen av dessa lutningar i elementsystemet.
Tabell 15
Om identiska partiklar har samma kvantantal, är deras vågfunktion symmetrisk med avseende på partikelpermutation. Det följer att två identiska fermioner som ingår i ett system inte kan vara i samma tillstånd, eftersom för fermioner måste vågfunktionen vara antisymmetrisk. V. Pauli sammanfattade experimentella data princip undantag , Varvid fermionsystem finns i naturen endast i stater,beskrivs av antisymmetriska vågfunktioner(kvantmekanisk formulering av Pauli-principen).
Av denna bestämmelse följer en enklare formulering av Pauli-principen, som infördes av honom i kvantteorin(1925) även före konstruktionen av kvantmekaniken: i ett system av identiska fermioner två av dem kan inte samtidigt vara i samma tillstånd . Observera att antalet identiska bosoner i samma tillstånd inte är begränsat.
Kom ihåg att tillståndet för en elektron i en atom bestäms unikt av mängden fyra kvanttal :
huvud n ;
orbital l ![]() , vanligtvis betecknar dessa tillstånd 1 s, 2d, 3f;
, vanligtvis betecknar dessa tillstånd 1 s, 2d, 3f;
magnetisk ();
· magnetiskt spinn ().
Fördelningen av elektroner i en atom sker enligt Pauli-principen, som kan formuleras för en atom i enklaste form: i samma atom kan det inte finnas mer än en elektron med samma uppsättning av fyra kvanttal: n, l, , :
Z (n, l, , ) = 0 eller 1,
var Z (n, l, , ) är antalet elektroner i ett kvanttillstånd, beskrivet av en uppsättning av fyra kvanttal: n, l, , . Således säger Pauli-principen, att två elektroner ,bundna i samma atom skiljer sig i värde ,minst ,ett kvantnummer .
Det maximala antalet elektroner i tillstånd som beskrivs av en uppsättning av tre kvanttal n, l Och m, och skiljer sig endast i orienteringen av elektronsnurren är lika med:
| , | (8.2.1) |
eftersom spin-kvanttalet bara kan ta två värden 1/2 och –1/2.
Det maximala antalet elektroner i tillstånd som bestäms av två kvanttal n Och l:
| (8.2.2) |
I det här fallet kan vektorn för elektronens omloppsrörelsemängd ta i rymden (2 l+ 1) olika orienteringar (Fig. 8.1).

Det maximala antalet elektroner i tillstånd som bestäms av värdet på det huvudsakliga kvanttalet n, är lika med:
| (8.2.3) |
Uppsättningen elektroner i en multielektronatom,med samma huvudsakliga kvantnummer n,kallad elektronskal eller lager .
I vart och ett av skalen är elektronerna fördelade längs subskal motsvarande detta l.
rymdområdet,där det är stor sannolikhet att hitta en elektron, ringde underskal eller orbital . Vyn av huvudtyperna av orbitaler visas i fig. 8.1.
Eftersom det orbitala kvanttalet tar värden från 0 till , är antalet underskal lika med ordningsnumret n skal. Antalet elektroner i ett underskal bestäms av de magnetiska och magnetiska spinnkvanttalen: det maximala antalet elektroner i ett underskal med en given lär lika med 2(2 l+ 1). Beteckningarna på skal, liksom fördelningen av elektroner över skal och subskal, ges i tabell. ett.
bord 1
| Huvudkvantnummer n |
|||||||||||||||
| skalsymbol |
|||||||||||||||
| Maximalt antal elektroner i skalet |
|||||||||||||||
| Orbitalt kvantnummer l |
|||||||||||||||
| Subshell karaktär |
|||||||||||||||
| Maximalt antal elektroner i underskal |
|||||||||||||||
- I kontakt med 0
- Google Plus 0
- OK 0
- Facebook 0