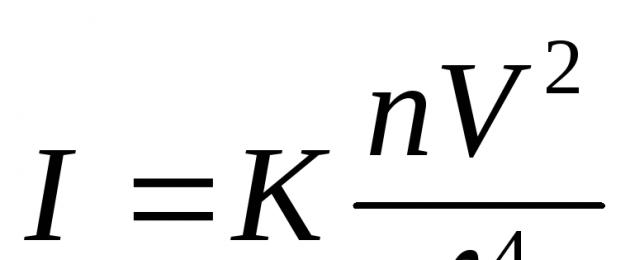Negli ambienti torbidi, la luce viola e blu è maggiormente diffusa, mentre la luce arancione e rossa è quella meno diffusa.
L'effetto Tyndall è stato scoperto come risultato dello studio di uno scienziato sull'interazione dei raggi luminosi con vari mezzi. Scoprì che quando i raggi luminosi attraversano un mezzo contenente una sospensione di minuscole particelle solide - ad esempio aria polverosa o fumosa, soluzioni colloidali, vetro torbido - l'effetto di diffusione diminuisce man mano che il colore spettrale del raggio cambia da viola-blu a giallo. -parte rossa dello spettro. Se, tuttavia, la luce bianca, come quella solare, che contiene l'intero spettro dei colori, viene fatta passare attraverso un mezzo torbido, la luce nella parte blu dello spettro verrà parzialmente dispersa, mentre l'intensità della parte verde-giallo-rossa parte della luce rimarrà quasi la stessa. Pertanto, se osserviamo la luce diffusa dopo che è passata attraverso un mezzo nuvoloso lontano dalla sorgente luminosa, apparirà più blu della luce originale. Se guardiamo una sorgente luminosa lungo la linea di diffusione, cioè attraverso un mezzo torbido, la sorgente ci sembrerà più rossa di quanto non sia in realtà. Ecco perché, ad esempio, la foschia causata dagli incendi boschivi ci appare bluastro-viola.
L'effetto Tyndall si verifica quando si diffonde su particelle sospese le cui dimensioni superano decine di volte le dimensioni degli atomi. Quando le particelle della sospensione vengono ingrandite fino a raggiungere dimensioni dell'ordine di 1/20 della lunghezza d'onda della luce (da circa 25 nm e oltre), la diffusione diventa policromo, cioè, la luce inizia a disperdersi uniformemente sull'intera gamma di colori visibili, dal viola al rosso. Di conseguenza, l'effetto Tyndall scompare. Questo è il motivo per cui la nebbia densa o i cumuli ci appaiono bianchi: sono costituiti da una densa sospensione di polvere d'acqua con diametri delle particelle che vanno dai micron ai millimetri, che è ben al di sopra della soglia di diffusione Tyndall.
Si potrebbe pensare che il cielo ci appaia azzurro a causa dell’effetto Tyndall, ma non è così. In assenza di nuvole o fumo, il cielo diventa blu a causa della diffusione della “luce del giorno” da parte delle molecole d’aria. Questo tipo di dispersione si chiama Diffusione di Rayleigh(in onore di Sir Rayleigh; cm. criterio di Rayleigh). Nello scattering Rayleigh la luce blu e ciano viene diffusa ancora più che nell'effetto Tyndall: ad esempio, la luce blu con una lunghezza d'onda di 400 nm viene diffusa nell'aria pulita nove volte più intensamente della luce rossa con una lunghezza d'onda di 700 nm. Ecco perché il cielo ci appare azzurro - luce solare si disperde sull'intero intervallo spettrale, ma nella parte blu dello spettro è quasi un ordine di grandezza più forte che in quella rossa. I raggi ultravioletti che causano l'abbronzatura vengono dispersi in modo ancora più forte. Ecco perché l'abbronzatura è distribuita in modo abbastanza uniforme su tutto il corpo, coprendo anche le zone della pelle non esposte alla luce solare diretta.
John Tyndall, 1820-93
Fisico e ingegnere irlandese. Nato a Leighlin Bridge, nella contea di Carlow. Al termine Scuola superiore ha lavorato come topografo-geometra in organizzazioni militari e nell'edilizia ferrovie. Allo stesso tempo si laureò all'Istituto Meccanico di Preston. Licenziato dal servizio geodetico militare per aver protestato contro le cattive condizioni di lavoro. Ha insegnato al Queenwood College (Hampshire), pur continuando la sua autoeducazione. Nel 1848-51. ha frequentato lezioni presso le Università di Marburg e Berlino. Ritornato in Inghilterra, divenne insegnante e poi professore alla Royal Institution di Londra. I lavori principali dello scienziato sono dedicati al magnetismo, all'acustica, all'assorbimento della radiazione termica da parte di gas e vapori, alla diffusione della luce in mezzi torbidi . Ha studiato la struttura e il movimento dei ghiacciai nelle Alpi.
Tyndall era estremamente appassionato dell'idea di divulgare la scienza. Teneva regolarmente conferenze pubbliche, spesso sotto forma di conferenze gratuite per tutti: per gli operai nei cortili delle fabbriche durante le pause pranzo, conferenze di Natale per i bambini alla Royal Institution. La fama di divulgatore di Tyndall raggiunse anche l'altra sponda dell'Atlantico: l'intera tiratura dell'edizione americana del suo libro Fragments of Science Scienza, 1871) fu esaurito in un giorno. Morì di una morte assurda nel 1893: mentre preparava la cena, la moglie dello scienziato (che gli sopravvisse 47 anni) utilizzò per errore uno dei reagenti chimici conservati in cucina al posto del sale da cucina.
Diffusione della luce. Da un punto di vista classico, la diffusione della luce è questo
Le onde elettromagnetiche che attraversano la materia provocano vibrazioni degli elettroni negli atomi. Spiegazione: se la dimensione delle particelle è piccola, allora si formano gli elettroni
le vibrazioni forzate negli atomi sono equivalenti a un dipolo oscillante. Questo dipolo oscilla con la frequenza dell'onda luminosa che lo colpisce. Pertanto, la parte dello spettro a onde corte viene diffusa in modo molto più intenso rispetto alla parte a onde lunghe. La luce blu viene diffusa quasi 5 volte più intensamente di quella rossa. Pertanto, la luce diffusa è blu e la luce trasmessa è rossastra. Ad altitudini molto elevate (centinaia di chilometri) la concentrazione delle molecole atmosferiche è molto piccola, la dispersione praticamente scompare, il cielo dovrebbe apparire nero e le stelle sono visibili in presenza del Sole. A voli spaziali tutte queste previsioni sono state completamente confermate.
La legge di Rayleigh-Jeans è la legge della radiazione per la densità di radiazione di equilibrio di un corpo assolutamente nero e per l'emissività di un corpo assolutamente nero.
Effetto Tyndall, effetto Tyndall - effetto ottico, diffusione della luce quando un raggio luminoso passa attraverso un mezzo otticamente disomogeneo. Solitamente osservato come un cono luminoso ( Cono Tyndall), visibile su uno sfondo scuro.
Caratteristico delle soluzioni di sistemi colloidali (ad esempio sol, metalli, lattici diluiti, fumo di tabacco), in cui le particelle e il loro ambiente differiscono nell'indice di rifrazione.
La nefelometria è un metodo per studiare e analizzare una sostanza basato sull'intensità del flusso luminoso diffuso dalle particelle sospese di questa sostanza.
L'essenza del metodo
L'intensità del flusso luminoso diffuso dipende da molti fattori, in particolare dalla concentrazione delle particelle nel campione analizzato. Ottimo rapporto qualità/prezzo nella nefelometria ha un volume di particelle che diffondono la luce. Un requisito importante per le reazioni utilizzate nella nefelometria è che il prodotto della reazione deve essere praticamente insolubile ed essere una sospensione (sospensione). Per mantenere le particelle solide in sospensione, vengono utilizzati vari stabilizzanti (ad esempio la gelatina) per prevenire la coagulazione delle particelle.
50. Radiazione termica dei corpi. Leggi della radiazione del corpo nero (Stephan–Boltzmann, Wien).
Esiste un processo infinito di scambio energetico tra tutti i corpi della natura. I corpi emettono e assorbono continuamente energia. Se l'eccitazione degli atomi avviene a seguito della loro collisione con altri atomi dello stesso corpo nel processo movimento termico, allora la radiazione elettromagnetica risultante è chiamata termica.
La radiazione termica si verifica a qualsiasi temperatura. In questo caso, indipendentemente dalla temperatura, il corpo emette tutte le lunghezze d'onda senza eccezioni, cioè lo spettro della radiazione termica è continuo e si estende da zero all'infinito. Tuttavia, quanto più alta è la temperatura, tanto più la radiazione a onde corte è quella principale nello spettro delle radiazioni. Il processo di emissione delle onde elettromagnetiche da parte del corpo avviene contemporaneamente e indipendentemente dal loro assorbimento.
Un corpo che assorbe completamente energia su tutta la gamma di lunghezze d'onda, cioè per cui α = 1 è detto assolutamente nero (nero)
LEGGE STEPHAN-BOLZMANN. Legge di spostamento di Wien
Stefan e Boltzmann hanno ottenuto un'espressione integrale per la luminosità energetica di un corpo nero, che non tiene conto della distribuzione dell'energia sulle lunghezze d'onda:
R = σT 4, σ è la costante di Stefan-Boltzmann (σ = 5,6696·10 -8 W/(m 2 ·K 4)).
Per i corpi grigi la legge di Kirchhoff ci permette di scrivere r λ = α λ ε λ , quindi per la luminosità energetica dei corpi grigi abbiamo: .
Analizzando le curve, Wien trovò che la lunghezza d'onda alla quale cade la massima densità spettrale della luminosità energetica è determinata dalla relazione: .
Questa è la legge di Wien, dove b = 0,28978·10 -2 m·K è la costante di Wien.
Determiniamo il valore della lunghezza d'onda per la quale ha ε λ valore massimo ad una data temperatura, in base al rapporto. Secondo le regole per la ricerca degli estremi, questo verrà fornito. I calcoli mostrano che ciò avverrà se λ = b/T.
Dalla relazione è chiaro che all'aumentare della temperatura, la lunghezza d'onda alla quale si verifica la massima emissività di un corpo assolutamente nero si sposta nella regione delle onde corte. Per questo motivo la relazione è nota nella letteratura scientifica anche come legge dello spostamento di Wien. Questa legge vale anche per i corpi grigi.
Le leggi di Stefan-Boltzmann e di Wien permettono di determinare la loro temperatura in base alla misurazione dell'energia emessa da un corpo. Questa branca della fisica è chiamata pirometria ottica.
A seconda della lunghezza d'onda della luce visibile e delle dimensioni relative delle particelle della fase dispersa, la diffusione della luce assume un carattere diverso.
Se la dimensione delle particelle è inferiore alla semilunghezza d'onda della luce incidente, si osserva la diffusione della diffrazione della luce; la luce sembra aggirare (piegarsi) le particelle incontrate lungo il percorso.
In questo caso, la diffusione parziale avviene sotto forma di onde divergenti in tutte le direzioni (Fig. 8). Come risultato della diffusione della luce, ogni particella è una sorgente di nuove onde meno intense, cioè è come se si verificasse l'autoluminescenza di ciascuna particella. Il fenomeno della diffusione della luce da parte di minuscole particelle è chiamato opalescenza.
È caratteristico principalmente dei sol (liquidi e solidi) e si osserva solo in luce riflessa, cioè lateralmente o su uno sfondo scuro. Questo fenomeno si esprime nella comparsa di una certa torbidità del sol e in un cambiamento (“trabocco”) del suo colore rispetto al colore della luce trasmessa. Il colore nella luce riflessa, di regola, viene spostato verso una frequenza più alta della parte visibile dello spettro. Pertanto, i sol bianchi (sol di cloruro d'argento, colofonia, ecc.) diventano opalescenti con un colore bluastro.
Effetto Faraday-Tyndall (Figura 9). Colorazione. Dipendenza dall'intensità della luce diffusa (  IO Colorazione.) con gli effetti sopra indicati è espresso dalla formula di Rayleigh: Dove:– e l'intensità della luce diffusa nella direzione ┴ del fascio incidente; A– const compreso l'indice di rifrazione del mezzo e della fase, N,
– numero di particelle presenti
IO Colorazione.) con gli effetti sopra indicati è espresso dalla formula di Rayleigh: Dove:– e l'intensità della luce diffusa nella direzione ┴ del fascio incidente; A– const compreso l'indice di rifrazione del mezzo e della fase, N,
– numero di particelle presenti
unità di volume– lunghezza d'onda della luce incidente,
V Colorazione.– volume di ciascuna particella.
6. Dalla formula è chiaro che la diffusione delle onde più corte avviene più intensamente, quindi i sol incolori appaiono rossi nella luce trasmessa e blu nella luce diffusa. 0 , Le soluzioni colloidali sono relativamente meno stabili rispetto alle soluzioni molecolari. Sotto l'influenza di vari fattori ( unità di volume T H, elettricità, CON
, impatto meccanico, presenza di impurità) e talvolta semplicemente senza una ragione apparente, nei sistemi colloidali si verificano processi irreversibili che portano a cambiamenti nelle particelle della fase dispersa e alla loro precipitazione. Vengono chiamati tali processi che portano al rafforzamento spontaneo delle particelle invecchiamento. Sebbene per i sistemi colloidali si possa parlare solo della relativa stabilità di N.P. Peskov ha introdotto nella scienza il concetto di cinetico E
aggregativo- la capacità delle particelle disperse di mantenersi in sospensione sotto l'influenza del moto browniano. Oltre al moto browniano, i fattori di stabilità cinetica sono la dispersione, la viscosità del mezzo disperso, la differenza di densità del mezzo disperso e della fase, ecc. Di tutti i fattori, il più importante è la dispersione, poiché è così maggiore influenza sulla velocità di sedimentazione delle particelle. Vengono chiamati sistemi in cui il tasso di deposizione è molto basso
cineticamente stabile. Stabilità aggregativa
– la capacità delle particelle in fase disperse di resistere alla loro adesione e quindi di mantenere un certo grado di dispersione. La perdita di stabilità aggregativa porta le particelle ad aderire insieme per formare aggregati più grandi.
La stabilità dell'aggregato è spiegata dalla presenza di particelle colloidali con cariche simili, che interferiscono con la loro connessione, nonché dalla presenza di gusci di solvatazione di molecole di solvente attorno al nucleo. È stata stabilita una relazione diretta tra lo spessore dei gusci di solvatazione e la stabilità aggregativa. Una caratteristica delle soluzioni colloidali sono i processi di cambiamento spontaneo della dimensione delle particelle: la dimensione può diminuire a causa della dissoluzione incompleta delle particelle della fase dispersa diminuzione della superficie specifica della fase dispersa diminuzione dell'energia libera - processo desoluzione
7. ; o ingrandire: il processo di ricristallizzazione. I sistemi colloidali hanno un'ampia superficie di interfaccia e quindi un eccesso di energia libera. Pertanto questi sistemi non sono stabili, tendono a diminuire l’energia libera, e ciò avviene nella maggior parte dei casi a causa di una diminuzione della superficie totale delle particelle colloidali, cioè rafforzandoli. Questo processo di rafforzamento delle particelle colloidali si chiama coagulazione.
Viene chiamato il processo di deposizione di particelle ingrossate della fase solida sedimentazione. Il processo di coagulazione si compone di due fasi: coagulazione latente– il processo di coagulazione non viene rilevato visivamente e
evidente coagulazione – facilmente rilevabili visivamente.. È stato accertato che l'effetto coagulante è esercitato da uno ione la cui carica è di segno opposto alla carica della superficie della particella colloidale. Pertanto, per i sol carichi (+), gli effetti coagulanti sono esercitati dagli anioni, mentre per i sol carichi (-), agiscono i cationi. Inoltre, gli ioni coagulanti con carica più elevata di solito provocano la coagulazione a concentrazioni significativamente inferiori rispetto agli ioni con carica più bassa (regola di Schulze-Gaddi).
Le soglie di coagulazione dello stesso segno differiscono l'una dall'altra anche in termini di capacità coagulativa; serie liotropica:
Cationi: Cs + >Rb + >NH 4 + >K + >Na + >Li + ; anioni: I - >NO 3 - >Fr - >Cl -
Una miscela di elettroliti può anche provocare un effetto coagulante. In questo caso sono possibili tre casi:
1) L'effetto della coagulazione è cumulativo;
2) Azione coagulativa che individuale - antagonismo;
3) Mutuo potenziamento dell'azione coagulativa – sinergismo.
La coagulazione può essere causata mescolando un sol idrofobo in un certo rapporto con altri granuli di sol idrofobo che hanno cariche opposte, questo fenomeno è chiamato coagulazione reciproca. La coagulazione reciproca è possibile grazie all'assenza di repulsione tra micelle con carica opposta.
8. Come è noto, i colloidi idrofobi sono instabili nello stato isoelettrico, cioè le particelle elettrone-centrali coagulano alla massima velocità.
Nella fig. La Figura 10 mostra un diagramma della rimozione della carica da una particella colloidale quando viene aggiunto un elettrolita con anioni a doppia carica.

Come si vede, il granulo diventa elettricamente neutro se i controioni dello strato diffuso, carichi negativamente, si spostano nello strato adsorbente. Maggiore è la concentrazione dell'elettrolita aggiunto, più lo strato diffuso viene compresso, più basso diventa il potenziale e quindi più veloce inizia il processo di coagulazione. Ad una certa concentrazione dell'elettrolita, quasi tutti i controioni entreranno nello strato di adsorbimento, la carica dei granuli scenderà a zero e la coagulazione procederà alla massima velocità, poiché l'assenza di uno strato diffuso causerà una significativa diminuzione della pressione di incuneamento.
L'effetto coagulante degli elettroliti non si limita alla compressione dello strato diffuso, allo stesso tempo avviene l'adsorbimento selettivo sulla particella colloidale di quegli ioni elettrolitici che hanno una carica opposta al granulo; Inoltre, quanto maggiore è la carica dello ione, tanto più intensamente verrà adsorbito. L'accumulo di ioni nello strato adsorbito è accompagnato da una diminuzione non solo del potenziale , ma anche dello strato diffuso.
Da tutto quanto sopra non si dovrebbe concludere che la ragione principale della coagulazione sia il raggiungimento di un potenziale critico costante in tutti i casi.
9. La ricerca ha dimostrato che l'effetto coagulante degli elettroliti non risiede tanto nella riduzione diretta delle forze repulsive tra le particelle colloidali attraverso una diminuzione del potenziale , ma piuttosto nel fatto che un cambiamento nella struttura del doppio strato elettrico e la compressione degli elettroliti la sua parte diffusa comporta una diminuzione dell'effetto di disgiunzione dei gusci idrati (solvati) di ioni diffusi che separano le particelle colloidali. In alcuni casi, quando ai sol vengono aggiunti elettroliti con ioni a carica multipla, la cui carica è di segno opposto alla carica delle particelle colloidali, non avviene la coagulazione, ma la stabilizzazione del sol e un cambiamento nel segno del potenziale x. essere osservato.Questo fenomeno è chiamato in chimica colloidale ricaricare
sol.
Pertanto, quando piccole quantità di cloruro di ferro FeCl 3 vengono aggiunte a un sol di platino, si osserva una diminuzione della carica negativa delle particelle colloidali di platino e la loro coagulazione. Un ulteriore aumento della concentrazione di FeCl 3 porta alla ricarica delle particelle di platino colloidale; ricevono una carica positiva.
10. Durante il processo di ricarica, il sol di platino subisce le seguenti modifiche: sol caricato negativamente - nessuna coagulazione; la carica è zero – coagulazione; sol carico positivamente - nessuna coagulazione; la carica è zero - coagulazione, ecc. Questa alternanza di stati di neutralità elettrica e carica delle particelle è chiamata alternanza delle zone di coagulazione.
Numerosi studi hanno dimostrato che il metodo più affidabile per osservare il processo di coagulazione nel tempo è il metodo di conteggio del numero di particelle in un certo periodo di tempo in un ultramicroscopio.
Secondo la teoria della coagulazione dei sol, l'inizio della coagulazione è considerato il contatto di due particelle colloidali e la loro adesione in un aggregato. Queste particelle raddoppiate, compiendo il moto browniano e incontrandosi con altre particelle identiche o singole, sono in grado di formare particelle triple, quadruple, ecc., fino all'inizio della sedimentazione.
La differenza rispetto alle reazioni chimiche dal punto di vista cinetico è che nel caso di una reazione chimica convenzionale, le molecole reagite non partecipano ulteriormente alla reazione e le particelle colloidali, unendosi tra loro durante la collisione, continuano a partecipare al processo di coagulazione , formando complessi sempre più complessi.
All'inizio della coagulazione la formazione di particelle doppie, triplicate, ecc. procede inosservata e più lentamente, poi all'aumentare della concentrazione dell'elettrolita coagulante la velocità di coagulazione aumenta notevolmente.
Pertanto, viene fatta una distinzione tra coagulazione lenta e veloce. Questi concetti non devono essere confusi con i concetti di coagulazione latente ed evidente.
11. I tipici sol idrofobici coagulano facilmente quando vengono aggiunte piccole quantità di elettroliti. Le soluzioni di composti ad alto peso molecolare, al contrario, sono altamente resistenti all'effetto coagulante degli elettroliti. Numerosi studi hanno scoperto che le soluzioni IUD, se aggiunte ai sol idrofobici, conferiscono loro una maggiore resistenza agli elettroliti. Pertanto, se una piccola quantità di gelatina viene aggiunta a un sol d'oro, l'idrosol d'oro diventa più stabile. Con l'aggiunta di elettroliti, anche in quantità notevolmente superiori alla soglia di coagulazione, nonché durante la permanenza prolungata, questo sol non subisce praticamente alcun cambiamento. Se questo sol viene evaporato, quando la preparazione secca viene miscelata con acqua, si forma nuovamente una soluzione colloidale. Pertanto, un tipico sol d'oro idrofobo, quando gli veniva aggiunta la gelatina, sembrava acquisire le proprietà di un sol idrofilo e diventare reversibile. Questo fenomeno si chiama azione protettiva
o semplicemente
protezione,
Il meccanismo dell’azione protettiva è spiegato abbastanza bene dalla teoria di Zsigmondy, che si basa sull’idea dell’interazione di adsorbimento tra le particelle dei sol protetti e protettivi. Una particella più grande di un sol idrofobo adsorbe macromolecole BMC più piccole con i loro gusci di solvatazione sulla sua superficie e, di conseguenza, acquisisce proprietà liofile. In questo caso, le micelle colloidali di un sol idrofobo irreversibile sono protette dal contatto diretto tra loro, e quindi dall'aggregazione, sia nel caso di azione di un elettrolita-coagulatore su tale sol, sia nel caso di concentrazione del sol .
Nella fig. 13a, b, mostra uno schema di tale azione protettiva. In alcuni casi, l'aggiunta di quantità molto piccole di alto polimero a un sol idrofobo porta al risultato esattamente opposto: la stabilità del sol diminuisce drasticamente. Questo fenomeno è chiamato sensibilizzazione o astabilizzazione
12. soluzione colloidale. Secondo la teoria di P. N. Peskova e L. D. Landau, la stabilizzazione avviene quando un alto polimero protettivo viene aggiunto a un sol idrofobo in piccole quantità che sono al di sotto della soglia limite del suo effetto protettivo, cioè al di sotto del numero di protezione. In altre parole, l'astabilizzazione si verifica quando non ci sono abbastanza particelle ad alto contenuto di polimeri per coprire e proteggere l'intera superficie delle particelle colloidali di un sol idrofobo, ma ce ne sono abbastanza per sottrarre a quest'ultimo gli ioni stabilizzanti mediante adsorbimento. Nella fig. 10c, c mostra un diagramma di una particella colloidale astabilizzata. La stabilizzazione si ottiene più facilmente se entrambi i tipi di particelle sono caricati diversamente.
Spesso il prodotto della coagulazione dei sol idrofobici - un sedimento, o coagel - può essere riportato in sospensione trattandolo con un certo elettrolita. Pertanto, un sol di idrossido di ferro coagulato può essere riportato al suo stato originale se il precipitato di Fe(OH)3 viene trattato con una soluzione acquosa di cloruro di ferro. Viene chiamato il processo di transizione del sedimento in uno stato sospeso sotto l'influenza di fattori esterni peptizzazione. Vengono chiamate sostanze che promuovono la transizione da coagel a sol
Il processo di peptizzazione stesso è determinato principalmente da fenomeni di adsorbimento, a seguito dei quali si verifica non solo un aumento del potenziale x delle particelle disperse, ma anche un aumento del grado della loro solvatazione (idratazione).
L'imposizione di una carica alle particelle coagulate della fase dispersa del sol favorisce, da un lato, il generale allentamento del sedimento e, dall'altro, il trasferimento di queste particelle in uno stato sospeso a causa del moto browniano. In questo caso, attorno alle particelle disperse si formano gusci di solvatazione, producendo il loro effetto di cuneo.
|
|
Come la coagulazione, la peptizzazione dei sol idrofobici non influenza le masse profonde del nucleo colloidale. Questi processi avvengono negli strati più sottili dell'interfaccia, quindi la peptizzazione richiede piccole quantità di elettroliti rispetto alla quantità di sedimento convertito allo stato sol (Figura 14). |
Quindi, se si prende la stessa quantità di coagulante e la si peptizza con quantità diverse di agente peptizzante, allora in piccole quantità avviene solo il suo adsorbimento senza dissolvere il precipitato (curva OA, Fig. 14); agente, aumenta anche la solubilità (curva AB). Se si continua ad aumentare la quantità di peptizzante, la solubilità, aumentando rapidamente, raggiunge un certo limite e non dipende più dalla quantità di peptizzante (curve BC e CD). Con un grande eccesso di peptizzante può verificarsi la coagulazione (curva DE).
La curva OD che abbiamo esaminato fornisce un quadro tipico della peptizzazione da adsorbimento.
Oltre all'adsorbimento, avviene anche la peptizzazione della dissoluzione. Questo tipo di peptizzazione copre tutti i casi in cui è associato il processo di peptizzazione
reazione chimica
molecole localizzate sulla superficie delle micelle colloidali.
Con una quantità costante di agente peptizzante e una quantità crescente di coagel, la peptizzabilità di quest'ultimo prima aumenta, raggiungendo il massimo, e poi diminuisce. Questo modello, stabilito da V. Ostwald e A. Butsag, fu chiamato regola dei sedimenti.
Gerasimenko Evgeniya
Questa presentazione è dedicata alla descrizione dell'effetto Tyndall e alla sua applicazione pratica.
Scaricamento: Anteprima: Per utilizzare le anteprime delle presentazioni, crea un account Google e accedi ad esso: https://accounts.google.com
John Tyndall fisico e ingegnere irlandese. Nato a Leighlin Bridge, nella contea di Carlow. Dopo il diploma di scuola superiore, lavorò come topografo e geometra in organizzazioni militari e nella costruzione di ferrovie. Allo stesso tempo si laureò all'Istituto Meccanico di Preston. Licenziato dal servizio geodetico militare per aver protestato contro le cattive condizioni di lavoro. Ha insegnato al Queenwood College (Hampshire), pur continuando la sua autoeducazione. Nel 1848–51 ha frequentato lezioni presso le Università di Marburg e Berlino. Ritornato in Inghilterra, divenne insegnante e poi professore alla Royal Institution di Londra. I lavori principali dello scienziato sono dedicati al magnetismo, all'acustica, all'assorbimento della radiazione termica da parte di gas e vapori e alla diffusione della luce nei mezzi torbidi. Ha studiato la struttura e il movimento dei ghiacciai nelle Alpi. Tyndall era estremamente appassionato dell'idea di divulgare la scienza. Teneva regolarmente conferenze pubbliche, spesso sotto forma di conferenze gratuite per tutti: per gli operai nei cortili delle fabbriche durante le pause pranzo, conferenze di Natale per i bambini alla Royal Institution. La fama di Tyndall come divulgatore raggiunse anche l'altra sponda dell'Atlantico: l'intera tiratura dell'edizione americana del suo libro Fragments of Science fu esaurita in un giorno. Morì di una morte assurda nel 1893: mentre preparava la cena, la moglie dello scienziato (che gli sopravvisse 47 anni) utilizzò per errore uno dei reagenti chimici conservati in cucina al posto del sale da cucina.
Descrizione dell'effetto Tyndall: il bagliore di un mezzo otticamente disomogeneo dovuto alla diffusione della luce che lo attraversa. È causata dalla diffrazione della luce su singole particelle o elementi di eterogeneità strutturale del mezzo, la cui dimensione è molto più piccola della lunghezza d'onda della luce diffusa. Caratteristico dei sistemi colloidali (ad esempio idrosoli, fumo di tabacco) con una bassa concentrazione di particelle di fase disperse aventi un indice di rifrazione diverso dall'indice di rifrazione del mezzo di dispersione. Tipicamente osservato come un cono di luce su uno sfondo scuro (cono di Tyndall) quando un raggio di luce focalizzato viene fatto passare lateralmente attraverso una cuvetta di vetro con pareti piane parallele riempita con una soluzione colloidale. La componente a onde corte della luce bianca (non monocromatica) è diffusa dalle particelle colloidali in modo più forte della componente a onde lunghe, quindi il cono Tyndall formato da essa in una cenere non assorbente ha una tinta blu. L'effetto Tyndall è essenzialmente uguale all'opalescenza. Ma tradizionalmente, il primo termine si riferisce all'intensa diffusione della luce in uno spazio limitato lungo il percorso del raggio, e il secondo alla debole diffusione della luce da parte dell'intero volume dell'oggetto osservato.
L'effetto Tyndall è percepito ad occhio nudo come un bagliore uniforme di una parte del volume di un sistema di diffusione della luce. La luce proviene da singoli punti: punti di diffrazione, chiaramente visibili sotto microscopio ottico sotto un'illuminazione sufficientemente forte del sol diluito. L'intensità della luce diffusa in una data direzione (a parametri costanti della luce incidente) dipende dal numero di particelle diffuse e dalla loro dimensione.
Caratteristiche di temporizzazione Tempo di inizio (registra da -12 a -6); Durata (log tc da -12 a 15); Tempo di degradazione (log td da -12 a -6); Tempo di sviluppo ottimale (log tk da -9 a -7). Implementazione tecnica effetto L'effetto può essere facilmente osservato quando si supera un raggio laser elio-neon attraverso una soluzione colloidale (semplicemente gelatina di amido non colorata). Diagramma
Applicazione dell'effetto Metodi basati sull'effetto Tyndall per rilevare, determinare la dimensione e la concentrazione delle particelle colloidali (ultramicroscopia, nefelometria sono ampiamente utilizzate in ricerca scientifica e pratica industriale).
Esempio. Ultramicroscopio. Un ultramicroscopio è uno strumento ottico per rilevare minuscole particelle (colloidali) le cui dimensioni sono inferiori al limite di risoluzione dei microscopi ottici convenzionali. La capacità di rilevare tali particelle utilizzando un ultramicroscopio è dovuta alla diffrazione della luce mediante l'effetto Tyndall. Sotto una forte illuminazione laterale, ogni particella nell'ultramicroscopio viene contrassegnata dall'osservatore come un punto luminoso (punto luminoso di diffrazione) su uno sfondo scuro. A causa della diffrazione sulle particelle più piccole, c'è pochissima luce, quindi in un ultramicroscopio, di regola, vengono utilizzate forti fonti di luce. A seconda dell'intensità dell'illuminazione, della lunghezza dell'onda luminosa, della differenza negli indici di rifrazione della particella e del mezzo, è possibile rilevare particelle di dimensioni comprese tra 20-50 nm e 1-5 micron. È impossibile determinare la vera dimensione, forma e struttura delle particelle dai punti di diffrazione. Un ultramicroscopio non fornisce immagini ottiche degli oggetti studiati. Tuttavia, utilizzando un ultramicroscopio, è possibile determinare la presenza e la concentrazione numerica delle particelle, studiarne il movimento e anche calcolare la dimensione media delle particelle se se ne conoscono la concentrazione in peso e la densità. Nello schema di un ultramicroscopio a fessura (Fig. 1a), il sistema in esame è immobile.
Nello schema di un ultramicroscopio a fessura, il sistema studiato è immobile. Rappresentazione schematica di un microscopio a fessura. La cuvetta 5 con l'oggetto in esame è illuminata dalla sorgente luminosa 1 (2 - condensatore, 4 - lente di illuminazione) attraverso una stretta fessura rettangolare 3, la cui immagine viene proiettata nella zona di osservazione. Attraverso l'oculare del microscopio di osservazione 6 sono visibili i punti luminosi delle particelle situati nel piano immagine della fenditura. Sopra e sotto l'area illuminata non viene rilevata la presenza di particelle.
In un ultramicroscopio a flusso, le particelle studiate si muovono attraverso il tubo verso l'occhio dell'osservatore. Rappresentazione schematica di un microscopio a flusso Attraversando la zona di illuminazione, vengono registrati come lampi luminosi visivamente o utilizzando un dispositivo fotometrico. Regolando la luminosità dell'illuminazione delle particelle osservate con un cuneo fotometrico mobile 7, è possibile selezionare per la registrazione particelle la cui dimensione supera un limite specificato. Utilizzando un moderno ultramicroscopio a flusso con una sorgente di luce laser e un sistema di registrazione delle particelle ottico-elettronico, la concentrazione di particelle negli aerosol viene determinata nell'intervallo da 1 a 109 particelle per 1 cm3 e si trovano anche le funzioni di distribuzione delle dimensioni delle particelle. Gli ultramicroscopi vengono utilizzati nello studio dei sistemi dispersi per controllare la purezza dell'aria atmosferica. Acqua, grado di contaminazione di mezzi otticamente trasparenti con inclusioni estranee.
Letteratura utilizzata 1. Fisica. Grande dizionario enciclopedico - M.: Bolshaya Enciclopedia russa, 1999.- P.90, 460. 2. Nuovo Dizionario Politecnico.- M.: Big Russian Encyclopedia, 2000.- P.20, 231, 460. Parole chiave bagliore otticamente disomogeneo mezzo bifase diffusione della luce mezzo disperso
***Una mela cadde su Newton, i cinesi ammirarono le gocce sui fiori di loto e John Tyndall, probabilmente camminando nella foresta, notò un cono di luce. Fiaba? Forse. Ma è in onore dell'ultimo eroe che prende il nome uno degli effetti più belli del nostro mondo: l'effetto Tyndall...***
La diffusione della luce è una delle caratteristiche generali sistemi altamente dispersi.
Con illuminazione laterale sistema dispersivo si osserva un caratteristico bagliore iridescente, solitamente bluastro, particolarmente chiaramente visibile su uno sfondo scuro.
Questa proprietà, associata alla diffusione della luce da parte delle particelle della fase dispersa, è chiamata opalescenza, dal nome di opale - opalus (latino), un minerale traslucido di colore bluastro o bianco-giallastro. Nel 1868 scoprì che quando una soluzione colloidale viene illuminata lateralmente con un fascio di luce proveniente da una forte sorgente, si osserva un cono brillante e uniformemente luminoso - Cono Tyndall, O Effetto Tyndall, mentre nel caso di una soluzione a basso peso molecolare il liquido appare otticamente vuoto, cioè la traccia del raggio è invisibile.
a sinistra c'è una soluzione di amido all'1%, a destra c'è l'acqua.
L'effetto Tyndall si verifica quando si diffonde su particelle sospese le cui dimensioni superano decine di volte le dimensioni degli atomi. Quando le particelle di sospensione si ingrandiscono fino a raggiungere dimensioni dell'ordine di 1/20 della lunghezza d'onda della luce (da circa 25 nm e oltre), la diffusione diventa policromatica, cioè la luce inizia a disperdersi uniformemente sull'intera gamma visibile di colori dal viola al rosso . Di conseguenza, l'effetto Tyndall scompare. Questo è il motivo per cui la nebbia densa o i cumuli ci appaiono bianchi: sono costituiti da una densa sospensione di polvere d'acqua con diametri delle particelle che vanno dai micron ai millimetri, che è ben al di sopra della soglia di diffusione Tyndall.
Si potrebbe pensare che il cielo ci appaia azzurro a causa dell’effetto Tyndall, ma non è così. In assenza di nuvole o fumo, il cielo diventa blu a causa della diffusione della “luce del giorno” da parte delle molecole d’aria. Questo tipo di diffusione è chiamato diffusione di Rayleigh (dal nome di Sir Rayleigh). Nello scattering Rayleigh la luce blu e ciano viene diffusa ancora più che nell'effetto Tyndall: ad esempio, la luce blu con una lunghezza d'onda di 400 nm viene diffusa nell'aria pulita nove volte più intensamente della luce rossa con una lunghezza d'onda di 700 nm. Questo è il motivo per cui il cielo ci appare blu: la luce solare è diffusa nell'intero intervallo spettrale, ma nella parte blu dello spettro è quasi un ordine di grandezza più forte che in quella rossa. I raggi ultravioletti che causano l'abbronzatura vengono dispersi in modo ancora più forte. Ecco perché l'abbronzatura è distribuita in modo abbastanza uniforme su tutto il corpo, coprendo anche le zone della pelle non esposte alla luce solare diretta.
- VKontakte 0
- Google+ 0
- OK 0
- Facebook 0