DEFINICJA
Nikiel- dwudziesty ósmy element Układ okresowy. Oznaczenie - Ni od łacińskiego „niccolum”. Znajduje się w czwartym okresie, grupa VIIIB. Odnosi się do metali. Ładunek jądrowy wynosi 28.
Podobnie jak kobalt, nikiel występuje w przyrodzie głównie w postaci związków z arsenem lub siarką; takie są na przykład minerały kupfernickel NiAs, arsenowo-niklowy połysk NiAsS itp. Nikiel jest bardziej powszechny niż kobalt [około 0,01% (mas.) skorupy ziemskiej].
Nikiel metaliczny ma srebrzystą barwę z żółtawym odcieniem (rys. 1), jest bardzo twardy, dobrze się poleruje i przyciąga magnesem. Charakteryzuje się wysoką odpornością na korozję - stabilny w atmosferze, w wodzie, w alkaliach i szeregu kwasów. Aktywnie rozpuszcza się w kwas azotowy. Odporność chemiczna niklu wynika z jego tendencji do pasywacji - tworzenia się na powierzchni warstw tlenków, które mają silne działanie ochronne.
Ryż. 1. Nikiel. Wygląd.
Masa atomowa i cząsteczkowa niklu
DEFINICJA
Względna masa cząsteczkowa substancji (M r) to liczba pokazująca, ile razy masa danej cząsteczki jest większa niż 1/12 masy atomu węgla, oraz względna masa atomowa pierwiastka (Ar)- ile razy średnia masa atomów pierwiastek chemiczny więcej niż 1/12 masy atomu węgla.
Ponieważ nikiel istnieje w stanie wolnym w postaci jednoatomowych cząsteczek Ni, wartości jego atomowej i waga molekularna dopasować. Są one równe 58,6934.
Izotopy niklu
Wiadomo, że nikiel może występować w przyrodzie w postaci pięciu stabilnych izotopów 58Ni, 60Ni, 61Ni, 62Ni i 64Ni. Ich liczby masowe to odpowiednio 58, 60, 61, 62 i 64. Jądro izotopu niklu 58 Ni zawiera dwadzieścia osiem protonów i trzydzieści neutronów, a pozostałe izotopy różnią się od niego tylko liczbą neutronów.
Istnieją sztuczne niestabilne izotopy niklu o liczbach masowych od 48 do 78, a także osiem meta stabilne stany, wśród których najdłużej żyjącym izotopem jest 59 Ni o okresie półtrwania 76 tysięcy lat.
jony niklu
Wzór elektroniczny przedstawiający orbitalny rozkład elektronów niklu jest następujący:
1s 2 2s 2 2p 6 3s 2 3p 6 3d 8 4s 2 .
W rezultacie interakcja chemiczna nikiel oddaje swoje elektrony walencyjne, tj. jest ich dawcą i zamienia się w dodatnio naładowany jon:
Ni 0 -2e → Ni 2+;
Ni 0 -3e → Ni 3+.
Cząsteczka i atom niklu
W stanie wolnym nikiel występuje w postaci jednoatomowych cząsteczek Ni. Oto kilka właściwości charakteryzujących atom i cząsteczkę niklu:
Stopy niklu
Większość niklu jest wykorzystywana do produkcji różnych stopów z żelazem, miedzią, cynkiem i innymi metalami. Dodatek niklu do stali zwiększa jej wytrzymałość i odporność na korozję.
Stopy na bazie niklu można podzielić na żaroodporne (nimon, inconel, hastella [ponad 60% niklu, 15-20% chromu i innych metali]), magnetyczne (permaloj) oraz stopy o specjalnych właściwościach (monel metaliczny, nikiel, konstantan , inwar, platyna).
Przykłady rozwiązywania problemów
PRZYKŁAD 1
| Ćwiczenia | Napisz równania reakcji, których można użyć do przeprowadzenia następujących przekształceń: NiCl 2 → Ni → NiSO 4 → Ni(NO 3) 2 → Ni(OH) 2 → NiCl 2. Narysuj równania reakcji zachodzących w roztworach w postaci jonowej i skróconej formy jonowej. |
| Odpowiedź | Umieszczając roztwór chlorku niklu (II), który jest bardziej aktywny niż nikiel metaliczny, można otrzymać nikiel w postaci wolnej (reakcja podstawienia): NiCl2 + Zn → Ni + ZnCl2 ; Ni 2+ + Zn 0 → Ni 0 + Zn 2+ . Nikiel rozpuszcza się w rozcieńczonym kwasie siarkowym, tworząc siarczan niklu (II): Ni + H2SO4 (rozcieńczony) → NiSO4 + H2; Ni 0 + 2H + → Ni 2+ + H 2 . Azotan niklu (II) można otrzymać w reakcji wymiany: NiSO 4 + Ba(NO 3) 2 → Ni(NO 3) 2 + BaSO 4 ↓; SO 4 2- + Ba 2+ → BaSO 4 ↓. Działając na azotan niklu (II) alkaliami, można otrzymać wodorotlenek niklu (II): Ni(NO 3) 2 + 2NaOH → Ni(OH) 2 ↓+ 2NaNO 3 ; Ni 2+ + 2OH - \u003d Ni (OH) 2 ↓. Chlorek niklu(II) z wodorotlenku niklu(II) można otrzymać w reakcji zobojętniania kwasem solnym: Ni(OH) 2 + 2HCl → NiCl 2 + 2H 2O; OH - + H + \u003d H2O. |
PRZYKŁAD 2
| Ćwiczenia | Jaką masę chlorku niklu (II) można otrzymać ogrzewając 17,7 g niklu i 12 litrów chloru (n.o.)? Jaką objętość 0,06 M roztworu można sporządzić z tej masy soli? |
| Rozwiązanie | Napiszmy równanie reakcji: Ni + Cl2 \u003d NiCl2. Znajdźmy liczbę moli niklu (masa molowa - 59 g / mol) i chloru, które przereagowały, korzystając z danych wskazanych w stanie problemu: n (Ni) = m (Ni) / M (Ni); n (Ni) \u003d 17,7 / 59 \u003d 0,3 mol. n (Cl2) \u003d V (Cl2) / Vm; n (Cl2) \u003d 12 / 22,4 \u003d 0,54 mol. Zgodnie z równaniem problemu n (Ni): n (Cl 2) = 1:1. Oznacza to, że chlor jest w nadmiarze i wszystkie dalsze obliczenia należy wykonać przy użyciu niklu. Znajdźmy ilość substancji i masę powstałego chlorku niklu (II) (masa molowa 130 g / mol): n (Ni): n (NiCl2) = 1:1; n (Ni) \u003d n (NiCl2) \u003d 0,3 mola. m (NiCl2) = n (NiCl2) x M (NiCl2); m (NiCl2) \u003d 0,3 × 130 \u003d 39 g. Oblicz objętość 0,06M roztworu, którą można otrzymać z 39 g chlorku niklu(II): V (NiCl2) \u003d n (NiCl2) / c (NiCl2); V (NiCl2) \u003d 0,3 / 0,06 \u003d 0,5 l. |
| Odpowiedź | Masa chlorku niklu (II) wynosi 39 g, objętość roztworu 0,06 M wynosi 0,5 l (500 ml). |
na temat: Nikiel i jego właściwości
Praca została opracowana przez studentów II roku grupy 5202
Nikitin Dmitry i Sharhemullin Emil.
Kazań 2013
Właściwości fizyczne niklu.
Pierwiastek został odkryty w 1761 roku. Nikiel jest pierwiastkiem dziesiątej grupy, czwartego okresu układu okresowego pierwiastków chemicznych. I. Mendelejew, o liczbie atomowej 28. Srebrno-biały metal, który nie matowieje w powietrzu. W czystej postaci jest bardzo plastyczny i może być przetwarzany pod ciśnieniem. Jest ferromagnesem, tj. podczas przewodzenia przez niego prądu ma wyraźne właściwości magnetyczne. Atomy niklu mają zewnętrzną konfigurację elektronową 3d 8 4s 2 . Jest to metal kowalny i ciągliwy, co umożliwia wytwarzanie z niego najcieńszych blach i rur.
Właściwości chemiczne niklu
Pod względem chemicznym Ni jest podobny do Fe i Co, ale także do Cu i metali szlachetnych. W związkach wykazuje zmienną wartościowość (najczęściej 2-wartościową). Nikiel jest metalem o średniej aktywności. Pochłania (zwłaszcza w stanie drobno rozdrobnionym) duże ilości gazów
Nikiel pali się tylko w postaci proszku. W tym przypadku tworzy dwa tlenki NiO i Ni 2 O 3 i odpowiednio dwa wodorotlenki Ni(OH) 2 i Ni(OH) 3 . Najważniejszymi rozpuszczalnymi solami niklu są octan, chlorek, azotan i siarczan. Wodne roztwory soli mają zwykle kolor zielony, a sole bezwodne są żółte lub brązowo-żółte. który jest często używany w chemii analitycznej.
Nasycenie N. gazami pogarsza jego właściwości mechaniczne. Interakcja z tlenem rozpoczyna się w temperaturze 500 ° C; w stanie drobno rozproszonym N. jest piroforyczny - zapala się samorzutnie w powietrzu. Spośród tlenków najważniejszym tlenkiem jest NiO - zielonkawe kryształy, praktycznie nierozpuszczalne w wodzie (minerał bunsenit). Wodorotlenek wytrąca się z roztworów soli niklu po dodaniu alkaliów w postaci gęstego, jabłkowo-zielonego osadu. Po podgrzaniu H. łączy się z halogenami, tworząc NiX 2 . Spalanie w oparach siarki daje siarczek o składzie podobnym do Ni 3 S 2 . Monosiarczek NiS można otrzymać przez ogrzewanie NiO z siarką. N. nie reaguje z azotem nawet w wysokich temperaturach (do 1400°C)
W stanie ciekłym N. rozpuszcza znaczną ilość C, która po ochłodzeniu wytrąca się w postaci grafitu. Gdy grafit jest izolowany, N. traci plastyczność i zdolność do obróbki pod ciśnieniem.
Nikiel jest odporny na wodę. Kwasy organiczne działają na N. dopiero po dłuższym kontakcie z nim. Kwasy siarkowy i chlorowodorowy powoli rozpuszczają N.; rozcieńczony kwas azotowy - bardzo łatwy; stężony HNO 3 pasywuje N., ale w mniejszym stopniu niż żelazo. Podczas interakcji z kwasami powstają sole 2-wartościowego Ni. Prawie wszystkie sole Ni(II) i mocne kwasy dobrze rozpuszczalne w wodzie, ich roztwory są kwaśne z powodu hydrolizy.
Złożone związki niklu.
Wiązanie niklu w kompleksy jest ważnym procesem diagnostycznym w chemii analitycznej.
Nikiel charakteryzuje się tworzeniem kompleksów. Zatem kation Ni 2+ z amoniakiem tworzy kompleks heksaaminy 2+ i kompleks dikwatetraaminy 2+ . Te kompleksy z anionami tworzą związki niebieskie lub fioletowe.
Sole nierozpuszczalne to szczawian i fosforan (kolor zielony), trzy siarczki: NiS (czarny), Ni 3 S 2 (żółtawo-brązowy) i Ni 3 S 4 (srebrno-biały). Lub dimetyloglioksymat niklu Ni (C 4 H 6 N 2 O 2) 2, dający wyraźny czerwony kolor w środowisku kwaśnym, który jest szeroko stosowany w analizie jakościowej do wykrywania niklu.
Wodne roztwory soli niklu(II) zawierają jon heksakwaniklu(II) 2+. Gdy roztwór amoniaku dodaje się do roztworu zawierającego te jony, wytrąca się wodorotlenek niklu (II), zielona galaretowata substancja. Ten osad rozpuszcza się po dodaniu nadmiaru amoniaku w wyniku tworzenia jonów heksaaminoniklu(II) 2+.
Nikiel tworzy kompleksy ze strukturami czworościennymi i płaskimi kwadratami. Na przykład kompleks tetrachloronikelanu (II) 2− ma strukturę czworościenną, podczas gdy kompleks tetracyjanonikelanu (II) 2− ma płaską strukturę kwadratową.
Charakterystyczna jest reakcja jonów Ni 2+ z dimetyloglioksymem, prowadząca do powstania różowo-czerwonego dimetyloglioksymatu niklu. Ta reakcja jest wykorzystywana do ilościowego oznaczania niklu, a produkt reakcji jest stosowany jako pigment w materiałach kosmetycznych i do innych celów.
Kwantyfikacja pierwiastka.
Odbywa się to głównie następującymi metodami:
1) Wytrącanie w postaci dimetoiglioksymatu niklu, jak już wspomniano.
2) strącanie w postaci eniklu-alfa-benzylodioksymu.
3) Wytrącanie w postaci wodorotlenku niklu (3) . Ta reakcja jest przeprowadzana przy użyciu żrącego potażu i wody bromowej.
4) Wytrącanie w postaci siarczków. Gdzie tlenek niklu będzie używany jako odważnik2.
5) Metoda elektrolityczna
6) Metoda wolumetryczna - czyli miareczkowanie cyjanku potasu do powstania cyjanku złożonego (Cejan potasu 2-niklu czterokrotnie)
7) Metoda kolorymetryczna polegająca na zmianie barwy jonu niklu heksaaminy lub barwy czerwonej rozpuszczalnego związku kompleksowego, który powstaje w wyniku reakcji jonów niklu 3 z dimetyloglioksymem w roztworze alkalicznym w obecności utleniacza agent.
8) Metoda kompleksometryczna.
GRAWIMETRYCZNA METODA OZNACZANIA NIKLU Metoda polega na strącaniu niklu w roztworze amoniaku z dimetyloglioksymem jako trudno rozpuszczalnym związkiem międzykompleksowym w obecności kwasu cytrynowego lub winowego.
METODA MIARECZKOWA DO OZNACZANIA NIKLU
Metoda polega na strącaniu niklu w roztworze amoniaku za pomocą dimetyloglioksymu jako trudno rozpuszczalnego związku wewnątrzkompleksowego w obecności kwasu cytrynowego lub winowego oraz oznaczaniu niklu metodą miareczkowania kompleksometrycznego z czernią eriochromową T jako wskaźnikiem.
Fabuła
Nikiel (angielski, francuski i niemiecki nikiel) został odkryty w 1751 roku. Jednak na długo przedtem górnicy saksońscy dobrze znali rudę, która z zewnątrz przypominała rudę miedzi i była używana w szklarstwie do barwienia szkła w zielony kolor. Wszelkie próby pozyskania miedzi z tej rudy zakończyły się niepowodzeniem, w związku z czym w koniec XVII V. Rudę nazwano Kupfernickel, co z grubsza oznacza „miedziany diabeł”. Rudę tę (czerwony nikiel piryt NiAs) badał w 1751 roku szwedzki mineralog Kronstedt. Udało mu się uzyskać zielony tlenek, a redukując ten ostatni, nowy metal zwany niklem. Kiedy Bergman otrzymał metal w czystszej postaci, stwierdził, że właściwości metalu są podobne do właściwości żelaza; Nikiel był badany bardziej szczegółowo przez wielu chemików, poczynając od Prousta. Nikkel to przekleństwo w języku górników. Powstało ze zniekształconego Mikołaja, ogólnego słowa, które miało kilka znaczeń. Ale przede wszystkim słowo Mikołaj służyło do określania ludzi o dwóch twarzach; ponadto oznaczało „psotnego małego ducha”, „podstępnego próżniaka” itp. W literaturze rosyjskiej początek XIX V. używano nazw nikolan (Scherer, 1808), nikolan (Zacharow, 1810), nicol i nikiel (Dvigubsky, 1824).
Właściwości fizyczne
Nikiel metaliczny ma srebrzysty kolor z żółtawym odcieniem, jest bardzo twardy, ciągliwy i ciągliwy, dobrze wypolerowany, przyciągany przez magnes, właściwości magnetyczne w temperaturach poniżej 340°C.
Właściwości chemiczne
Dichlorek niklu (NiCl2)
Atomy niklu mają zewnętrzną konfigurację elektronową 3d84s2. Stopień utlenienia Ni(II) jest najbardziej stabilny dla niklu.
Nikiel tworzy związki o stopniach utlenienia +2 i +3. W tym przypadku nikiel o stopniu utlenienia +3 występuje tylko w postaci złożonych soli. W przypadku związków niklu +2 znana jest duża liczba zwykłych i złożonych związków. Tlenek niklu Ni2O3 jest silnym utleniaczem.
Nikiel charakteryzuje się wysoką odpornością na korozję - jest stabilny w powietrzu, wodzie, alkaliach, wielu kwasach. Odporność chemiczna wynika z jego tendencji do pasywacji - tworzenia na jego powierzchni gęstej warstwy tlenków, która ma działanie ochronne. Nikiel aktywnie rozpuszcza się w kwasie azotowym.
Wraz z tlenkiem węgla CO nikiel łatwo tworzy lotny i wysoce toksyczny karbonyl Ni(CO)4.
Drobno zdyspergowany proszek niklu jest samozapalny w powietrzu.
Nikiel pali się tylko w postaci proszku. Tworzy dwa tlenki NiO i Ni2O3 oraz odpowiednio dwa wodorotlenki Ni(OH)2 i Ni(OH)3. Najważniejszymi rozpuszczalnymi solami niklu są octan, chlorek, azotan i siarczan. Roztwory są zwykle zabarwione na zielono, podczas gdy bezwodne sole są żółte lub brązowo-żółte. Sole nierozpuszczalne obejmują szczawian i fosforan (zielony), trzy siarczki NiS (czarny), Ni2S3 (żółtawy brąz) i Ni3S4 (czarny). Nikiel tworzy również liczne związki koordynacyjne i złożone. Na przykład dimetyloglioksymat niklu Ni(C4H6N2O2)2, który daje wyraźny czerwony kolor w środowisku kwaśnym, jest szeroko stosowany w analizie jakościowej do wykrywania niklu.
Wodny roztwór siarczanu niklu w słoiku jest zielony.
Wodne roztwory soli niklu(II) zawierają jon heksakwaniklu(II) 2+. Gdy roztwór amoniaku dodaje się do roztworu zawierającego te jony, wytrąca się wodorotlenek niklu (II), zielona galaretowata substancja. Ten osad rozpuszcza się po dodaniu nadmiaru amoniaku w wyniku tworzenia jonów heksaaminoniklu(II) 2+.
Nikiel tworzy kompleksy ze strukturami czworościennymi i płaskimi kwadratami. Na przykład kompleks tetrachloronikelanu (II) 2− ma strukturę czworościenną, podczas gdy kompleks tetracyjanonikelanu (II) 2− ma płaską strukturę kwadratową.
Analiza jakościowa i ilościowa wykorzystuje alkaliczny roztwór butanodioksymu, znanego również jako dimetyloglioksym, do wykrywania jonów niklu(II). Kiedy wchodzi w interakcję z jonami niklu (II), powstaje czerwony związek koordynacyjny bis (butanodionodioksymato) nikiel (II). Jest związkiem chelatowym, a ligand butanodioksymato jest dwukleszczowy.
Będąc w naturze
Nikiel jest dość powszechny w przyrodzie - jego zawartość w skorupa Ziemska wynosi ok. 0,01% (masa). Występuje w skorupie ziemskiej tylko w postaci związanej, meteoryty żelazne zawierają rodzimy nikiel (do 8%). Jego zawartość w skałach ultrazasadowych jest około 200 razy większa niż w skałach kwaśnych (1,2 kg/t i 8 g/t). W skałach ultramaficznych przeważająca ilość niklu związana jest z oliwinami zawierającymi 0,13–0,41% Ni. Izomorficznie zastępuje żelazo i magnez. Niewielka część niklu występuje w postaci siarczków. Nikiel wykazuje właściwości syderofilne i chalkofilowe. Przy zwiększonej zawartości siarki w magmie pojawiają się siarczki niklu wraz z miedzią, kobaltem, żelazem i platynoidami. Nikiel w procesie hydrotermalnym wraz z kobaltem, arsenem i siarką, a czasem z bizmutem, uranem i srebrem tworzy podwyższone stężenia w postaci arsenków i siarczków niklu. Nikiel jest powszechnie spotykany w rudach miedziowo-niklowych zawierających siarczki i arsen.
* Nikiel (czerwony nikiel piryt, kupfernickel) NiAs
* chloantyt (biały piryt niklowy) (Ni, Co, Fe)As2
* garnieryt (Mg, Ni)6(Si4O11)(OH)6*H2O i inne krzemiany
* piryty magnetyczne (Fe, Ni, Cu)S
* połysk arsenowo-niklowy (gersdorfit) NiAsS,
* pentlandyt (Fe,Ni)9S8
U roślin średnio 5 × 10-5 procent wagowych niklu, u zwierząt morskich - 1,6 × 10-4, u zwierząt lądowych - 1 × 10 Ludzkie ciało— 1…2×10-6. Wiele wiadomo o niklu w organizmach. Ustalono na przykład, że jego zawartość w ludzkiej krwi zmienia się wraz z wiekiem, że u zwierząt ilość niklu w organizmie wzrasta, wreszcie, że istnieją rośliny i mikroorganizmy - „koncentratory” niklu, zawierające tysiące a nawet setki tysięcy razy więcej niklu niż środowisko.
Złoża rud niklu
Główne złoża rud niklu znajdują się w Kanadzie, Rosji, Nowej Kaledonii, Filipinach, Indonezji, Chinach, Finlandii i Australii. Naturalne izotopy niklu.
Naturalny nikiel zawiera 5 trwałych izotopów: 58Ni (68,27%), 60Ni (26,10%), 61Ni (1,13%), 62Ni (3,59%), 64Ni (0,91%).
Paragon
Całkowite zasoby niklu w rudach na początek 1998 roku szacowane są na 135 mln ton, w tym wiarygodne zasoby wynoszą 49 mln ton.
Główne rudy niklu — nikiel (kupfernickel) NiAs, milleryt NiS, pentlandyt (FeNi)9S8 — również zawierają arsen, żelazo i siarkę; Wtrącenia pentlandytu występują również w pirotycie magmowym. Inne rudy, z których wydobywa się również Ni, zawierają zanieczyszczenia Co, Cu, Fe i Mg. Czasami nikiel jest głównym produktem procesu rafinacji, ale częściej otrzymuje się go jako produkt uboczny w innych technologiach obróbki metali. Spośród wiarygodnych rezerw, według różnych źródeł, od 40 do 66% niklu znajduje się w „rudach utlenionego niklu” (ONR), 33% w siarczku, 0,7% w innych. Od 1997 r. udział niklu wytwarzanego z przetwórstwa OHP wynosił około 40% światowej produkcji. W warunkach przemysłowych OHP dzieli się na dwa rodzaje: magnezowe i żelaziste.
Ogniotrwałe rudy magnezu z reguły poddawane są wytapianiu elektrycznemu żelazoniklu (5-50% Ni + Co, w zależności od składu surowca i cech technologicznych).
Najbardziej żelaziste - laterytowe rudy przetwarzane są metodami hydrometalurgicznymi z zastosowaniem ługowania amoniakowo-węglanowego lub ługowania w autoklawie kwasem siarkowym. W zależności od składu surowców i zastosowanych schematów technologicznych, końcowymi produktami tych technologii są: tlenek niklu (76-90% Ni), spiek (89% Ni), koncentraty siarczkowe o różnym składzie, a także metal elektrolityczny nikiel, proszki niklu i kobalt.
Mniej żelaziste - rudy nietronitowe topi się na mat. W przedsiębiorstwach działających w pełnym cyklu dalszy schemat przetwarzania obejmuje konwersję, prażenie kamienia, elektryczne wytapianie tlenku niklu w celu uzyskania niklu metalicznego. Po drodze wydobywany kobalt jest produkowany w postaci metalu i/lub soli. Kolejne źródło niklu: w popiołach węgli południowej Walii w Anglii - do 78 kg niklu na tonę. Podwyższona zawartość niklu w niektórych węglach, ropie naftowej, łupkach wskazuje na możliwość koncentracji niklu w skamieniałościach. materia organiczna. Przyczyny tego zjawiska nie zostały jeszcze wyjaśnione.
Większość niklu pozyskiwana jest z garnierytu i pirytu magnetycznego.
1. Ruda krzemianowa jest redukowana pyłem węglowym w obrotowych piecach rurowych do granulek żelazowo-niklowych (5-8% Ni), które są następnie oczyszczane z siarki, kalcynowane i traktowane roztworem amoniaku. Po zakwaszeniu roztworu otrzymuje się z niego elektrolitycznie metal.
2. Metoda karbonylowa (metoda Monda). Najpierw kamień miedziowo-niklowy otrzymuje się z rudy siarczkowej, nad którą przepuszcza się CO2 pod wysokim ciśnieniem. Powstaje łatwo lotny tetrakarbonynikel, którego rozkład termiczny daje szczególnie czysty metal.
3. Aluminotermiczna metoda odzyskiwania niklu z rudy tlenkowej: 3NiO + 2Al = 3Ni + Al2O3
Aplikacja
Stopy
Nikiel jest podstawą większości nadstopów, materiałów wysokotemperaturowych stosowanych w przemyśle lotniczym na części elektrowni.
* Monel metaliczny (65 - 67% Ni + 30 - 32% Cu + 1% Mn), żaroodporny do 500 °C, bardzo odporny na korozję;
* białe złoto (np. 585 próbek zawiera 58,5% złota oraz stop (ligatura) srebra i niklu (lub palladu));
* nichrom, stop odporny (60% Ni + 40% Cr);
*permaloj (76% Ni + 17% Fe + 5% Cu + 2% Cr), charakteryzuje się dużą podatnością magnetyczną przy bardzo niskich stratach histerezy;
* Invar (65% Fe + 35% Ni), prawie nie wydłuża się po podgrzaniu;
* Ponadto stopy niklu obejmują stale niklowe i chromowo-niklowe, srebro niklowe i różne stopy oporowe, takie jak konstantan, nikiel i mangan.
niklowanie
Niklowanie to tworzenie powłoki niklowej na powierzchni innego metalu w celu zabezpieczenia go przed korozją. Wykonuje się ją metodą galwanizacji z użyciem elektrolitów zawierających siarczan niklu(II), chlorek sodu, wodorotlenek boru, środki powierzchniowo czynne i substancje nabłyszczające oraz rozpuszczalne anody niklowe. Grubość powstałej warstwy niklu wynosi 12–36 µm. Stabilność połysku powierzchni można zapewnić przez późniejsze chromowanie (grubość warstwy chromu 0,3 µm).
Niklowanie bezprądowe przeprowadza się w roztworze mieszaniny chlorku niklu(II) i podfosforynu sodu w obecności cytrynianu sodu:
NiCl2 + NaH2PO2 + H2O = Ni + NaH2PO3 + 2HCl
Proces prowadzi się przy pH 4-6 i temperaturze 95°C.
Produkcja baterii
Produkcja akumulatorów żelazowo-niklowych, niklowo-kadmowych, niklowo-cynkowych, niklowo-wodorowych.
Technologie radiacyjne
Cząsteczki β+ emitujące nuklid 63Ni mają okres półtrwania 100,1 lat i są stosowane w krytronach.
Medycyna
* Stosowany do produkcji systemów zamków (tytanowo-niklowy).
* Protetyka
waluta
Nikiel jest szeroko stosowany w produkcji monet w wielu krajach. W Stanach Zjednoczonych moneta 5 centów jest potocznie nazywana niklem.
Rola biologiczna
Rola biologiczna: Nikiel jest jednym z pierwiastków śladowych niezbędnych do prawidłowego rozwoju organizmów żywych. Jednak niewiele wiadomo na temat jego roli w organizmach żywych. Wiadomo, że nikiel bierze udział w reakcjach enzymatycznych u zwierząt i roślin. U zwierząt gromadzi się w zrogowaciałych tkankach, zwłaszcza w piórach. Podwyższona zawartość niklu w glebie prowadzi do chorób endemicznych - brzydkie formy pojawiają się u roślin, a u zwierząt choroby oczu związane z gromadzeniem się niklu w rogówce. Dawka toksyczna (dla szczurów) - 50 mg. Szczególnie szkodliwe są lotne związki niklu, w szczególności jego tetrakarbonyl Ni(CO)4. MPC związków niklu w powietrzu waha się od 0,0002 do 0,001 mg/m3 (dla różnych związków).
Działanie fizjologiczne
Nikiel jest główną przyczyną alergii (kontaktowego zapalenia skóry) na metale, które mają kontakt ze skórą (biżuteria, zegarki, ćwieki do dżinsów). W Unii Europejskiej zawartość niklu w produktach mających kontakt z ludzką skórą jest ograniczona.
Karbonylek niklu jest wysoce toksyczny. Maksymalne dopuszczalne stężenie jego par w powietrzu pomieszczeń przemysłowych wynosi 0,0005 mg/m³.
W XX wieku stwierdzono, że trzustka jest bardzo bogata w nikiel. Nikiel podany po podaniu insuliny przedłuża działanie insuliny, a tym samym zwiększa aktywność hipoglikemiczną. Nikiel wpływa na procesy enzymatyczne, utlenianie kwasu askorbinowego, przyspiesza przemianę grup sulfhydrylowych w disiarczkowe. Nikiel może hamować działanie adrenaliny i obniżać ciśnienie krwi. Nadmierne spożycie niklu w organizmie powoduje bielactwo. Nikiel odkłada się w trzustce i przytarczycach.
Nikiel- prosta substancja, plastyczny, kowalny, srebrno-biały metal przejściowy, w zwykłej temperaturze w powietrzu jest pokryta cienką warstwą tlenku. Chemicznie nieaktywny. Należy do ciężkich metali nieżelaznych, nie występuje na ziemi w czystej postaci - zwykle wchodzi w skład różnych rud, ma dużą twardość, dobrze wypolerowany, jest ferromagnesem - przyciągany jest przez magnes, w układ okresowy Mendelejew jest oznaczony symbolem Ni i ma numer seryjny 28.
Zobacz też:
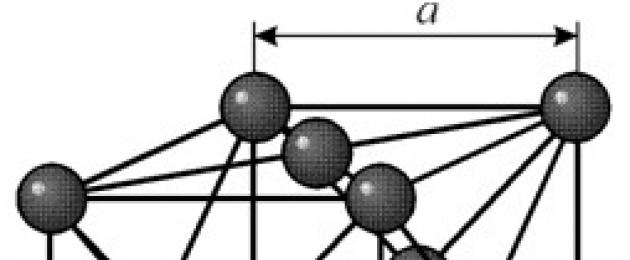
STRUKTURA
 Ma siatkę sześcienną centrowaną na ścianie z okresem a = 0,35238 å nm, grupą przestrzenną Fm3m. Ta struktura krystaliczna jest odporna na ciśnienie do co najmniej 70 GPa. W normalnych warunkach nikiel istnieje w postaci modyfikacji b mającej sześcienną siatkę centrowaną na ścianie (a = 3,5236 å). Natomiast nikiel poddany rozpylaniu katodowemu w atmosferze h 2 tworzy odmianę a o gęsto upakowanej siatce heksagonalnej (a = 2,65 å, c = 4,32 å), która po podgrzaniu do temperatury powyżej 200°C przekształca się w sześcienny. Kompaktowy sześcienny nikiel ma gęstość 8,9 g / cm 3 (20 ° C), promień atomowy 1,24 å
Ma siatkę sześcienną centrowaną na ścianie z okresem a = 0,35238 å nm, grupą przestrzenną Fm3m. Ta struktura krystaliczna jest odporna na ciśnienie do co najmniej 70 GPa. W normalnych warunkach nikiel istnieje w postaci modyfikacji b mającej sześcienną siatkę centrowaną na ścianie (a = 3,5236 å). Natomiast nikiel poddany rozpylaniu katodowemu w atmosferze h 2 tworzy odmianę a o gęsto upakowanej siatce heksagonalnej (a = 2,65 å, c = 4,32 å), która po podgrzaniu do temperatury powyżej 200°C przekształca się w sześcienny. Kompaktowy sześcienny nikiel ma gęstość 8,9 g / cm 3 (20 ° C), promień atomowy 1,24 å NIERUCHOMOŚCI
 Nikiel jest ciągliwym i ciągliwym metalem, z którego można wytwarzać najcieńsze blachy i rury. Wytrzymałość na rozciąganie 400-500 MN/m2, granica sprężystości 80 MN/m2, granica plastyczności 120 MN/m2; wydłużenie 40%; moduł sprężystości normalnej 205 Gn/m2; Twardość Brinella 600-800 MN/m 2 . W zakresie temperatur od 0 do 631K (górna granica odpowiada punktowi Curie). Ferromagnetyzm niklu wynika ze specyfiki struktury zewnętrznych powłok elektronowych jego atomów. Nikiel jest składnikiem najważniejszych materiałów i stopów magnetycznych o minimalnym współczynniku rozszerzalności cieplnej (permaloj, monel metaliczny, inwar itp.).
Nikiel jest ciągliwym i ciągliwym metalem, z którego można wytwarzać najcieńsze blachy i rury. Wytrzymałość na rozciąganie 400-500 MN/m2, granica sprężystości 80 MN/m2, granica plastyczności 120 MN/m2; wydłużenie 40%; moduł sprężystości normalnej 205 Gn/m2; Twardość Brinella 600-800 MN/m 2 . W zakresie temperatur od 0 do 631K (górna granica odpowiada punktowi Curie). Ferromagnetyzm niklu wynika ze specyfiki struktury zewnętrznych powłok elektronowych jego atomów. Nikiel jest składnikiem najważniejszych materiałów i stopów magnetycznych o minimalnym współczynniku rozszerzalności cieplnej (permaloj, monel metaliczny, inwar itp.).
REZERWY I PRODUKCJA
 Nikiel występuje w przyrodzie dość powszechnie - jego zawartość w skorupie ziemskiej wynosi około 0,01% (masowych). Występuje w skorupie ziemskiej tylko w postaci związanej; meteoryty żelazne zawierają rodzimy nikiel (do 8%). Jego zawartość w skałach ultrazasadowych jest około 200 razy większa niż w skałach kwaśnych (1,2 kg/t i 8 g/t). W skałach ultramaficznych przeważająca ilość niklu związana jest z oliwinami zawierającymi 0,13 - 0,41% Ni.
Nikiel występuje w przyrodzie dość powszechnie - jego zawartość w skorupie ziemskiej wynosi około 0,01% (masowych). Występuje w skorupie ziemskiej tylko w postaci związanej; meteoryty żelazne zawierają rodzimy nikiel (do 8%). Jego zawartość w skałach ultrazasadowych jest około 200 razy większa niż w skałach kwaśnych (1,2 kg/t i 8 g/t). W skałach ultramaficznych przeważająca ilość niklu związana jest z oliwinami zawierającymi 0,13 - 0,41% Ni.
W roślinach średnio 5 10 -5 procent wagowych niklu, w zwierzętach morskich - 1,6 10 -4, w zwierzętach lądowych - 1 10 -6, w organizmie człowieka - 1 ... 2 10 -6.
Większość niklu pozyskiwana jest z garnierytu i pirytu magnetycznego.
Ruda krzemianowa jest redukowana pyłem węglowym w obrotowych piecach rurowych do granulatu żelazowo-niklowego (5-8% Ni), który następnie jest oczyszczany z siarki, kalcynowany i traktowany roztworem amoniaku. Po zakwaszeniu roztworu otrzymuje się z niego elektrolitycznie metal.
Metoda karbonylowa (metoda Mond): Najpierw kamień miedziowo-niklowy otrzymuje się z rudy siarczkowej, nad którą przepuszcza się CO2 pod wysokim ciśnieniem. Powstaje łatwo lotny tetrakarbonynikel, którego rozkład termiczny daje szczególnie czysty metal.
Aluminotermiczna metoda odzyskiwania niklu z rudy tlenkowej: 3NiO + 2Al = 3Ni + Al 2 O 3
POCHODZENIE
 Złoża siarczkowych rud miedzi i niklu związane są z lopolitopodobnymi lub płytkowymi masywami warstwowych gabroidów, ograniczonymi do stref głębokich uskoków na starożytnych tarczach i platformach. charakterystyczna cecha złóż miedzi i niklu na świecie to spójny skład mineralny rud: pirotyn, pentlandyt, chalkopiryt, magnetyt; oprócz nich w rudach występują piryt, kubanit, polidymit, nikiel, milleryt, wiolaryt, platynowce, sporadycznie chromit, arsenki niklu i kobaltu, galena, sfaleryt, bornit, makinawit, walleryt, grafit, złoto rodzime.
Złoża siarczkowych rud miedzi i niklu związane są z lopolitopodobnymi lub płytkowymi masywami warstwowych gabroidów, ograniczonymi do stref głębokich uskoków na starożytnych tarczach i platformach. charakterystyczna cecha złóż miedzi i niklu na świecie to spójny skład mineralny rud: pirotyn, pentlandyt, chalkopiryt, magnetyt; oprócz nich w rudach występują piryt, kubanit, polidymit, nikiel, milleryt, wiolaryt, platynowce, sporadycznie chromit, arsenki niklu i kobaltu, galena, sfaleryt, bornit, makinawit, walleryt, grafit, złoto rodzime.
Egzogeniczne złoża krzemianowych rud niklu są powszechnie kojarzone z jednym lub drugim rodzajem wietrzejącej skorupy serpentenitów. podczas wietrzenia następuje stopniowy rozkład minerałów i przenoszenie elementów ruchomych za pomocą wody z górne części kora do dna. Tam pierwiastki te wytrącają się w postaci minerałów wtórnych.
Złoża tego typu zawierają zasoby niklu, które są 3 razy większe niż jego zasoby w rudach siarczkowych, a zasoby niektórych złóż sięgają 1 miliona ton lub więcej niklu. Duże rezerwy rud krzemianowych są skoncentrowane w Nowej Kaledonii, na Filipinach, w Indonezji, Australii i innych krajach. Średnia zawartość niklu w nich wynosi 1,1-2%. Ponadto rudy często zawierają kobalt.
APLIKACJA
Zdecydowana większość niklu wykorzystywana jest do otrzymywania stopów z innymi metalami (fe, cr, cu itp.), które wyróżniają się wysokimi właściwościami mechanicznymi, antykorozyjnymi, magnetycznymi czy elektrycznymi i termoelektrycznymi. W związku z rozwojem technologii odrzutowej i tworzeniem turbin gazowych szczególnie ważne są żaroodporne i żaroodporne stopy chromowo-niklowe. Stopy niklu są wykorzystywane do budowy reaktorów jądrowych.
Znaczna ilość niklu zużywana jest do produkcji baterii alkalicznych oraz powłok antykorozyjnych. Nikiel ciągliwy w czystej postaci jest używany do produkcji blach, rur itp. Jest również używany w przemysł chemiczny do produkcji specjalnego sprzętu chemicznego oraz jako katalizator wielu procesów chemicznych. Nikiel jest bardzo rzadkim metalem iw miarę możliwości powinien być zastępowany innymi, tańszymi i bardziej powszechnymi materiałami.
Jest stosowany w produkcji systemów zamków (tytanowo-niklowy), protetyce. Jest szeroko stosowany w produkcji monet w wielu krajach. W Stanach Zjednoczonych moneta 5 centów jest potocznie nazywana niklem. Nikiel jest również wykorzystywany do produkcji nawijanych strun instrumentów muzycznych.
Nikiel - Ni
KLASYFIKACJA
| Strunz (wydanie 8.) | 1/A.08-10 |
| Nickel-Strunz (wydanie 10.) | 1.AA.05 |
| Dana (7. wydanie) | 1.1.17.2 |
| Dana (wydanie 8.) | 1.1.11.5 | Hej, CIM Nr ref | 1.61 |
Właściwości niklu są ważnymi parametrami do wyszukiwania, przetwarzania i zastosowań metalu. Są one brane pod uwagę przy tworzeniu kompozycji z innymi materiałami.
Właściwości niklu decydują o jego zastosowaniu w produkcji
Nikiel jest metalem o charakterystycznej srebrzystobiałej barwie. W temperaturze 1453 ° C staje się płynny i wrze w temperaturze 2732 ° C. Nikiel jest plastyczny i łatwo obrabialny pod ciśnieniem.
Właściwości chemiczne niklu charakteryzują się zdolnością do tworzenia związków o różnym stopniu utlenienia. W warunkach naturalnych na powierzchni metalu pojawia się cienka warstwa tlenku.
Metal ma wysoki wskaźnik odporności na korozję. Nikiel nie reaguje z wieloma stężonymi kwasami i zasadami, ale aktywnie rozpuszcza się w rozcieńczonym kwasie azotowym.

Wchodząc w reakcje chemiczne, nikiel tworzy lotne metale oraz rozpuszczalne/nierozpuszczalne sole
Nie reagują z niklem.
- gazy obojętne;
- lit;
- potas;
- sód;
- cez;
- rubid;
- stront;
- bar;
- iryd;
- cez.
Nikiel łączy się z węglem, tworząc karbonyl, lotny metal przejściowy stosowany w produkcji materiałów o wysokiej czystości. Proszek niklu jest zdolny do samozapłonu w kontakcie z powietrzem, tworząc tlenki.
Nikiel wytwarza szereg rozpuszczalnych i nierozpuszczalnych soli. Na przykład roztwór siarczanu metalu nadaje cieczy zielony kolor. Sole nierozpuszczalne mają zwykle bogaty żółty kolor.
Formy znajdowania metali
W warunkach naturalnych nikiel występuje w połączeniu z wieloma pierwiastkami chemicznymi, aw postaci bryłek występuje w meteorytach żelaznych.
W warunkach hydrotermalnych nikiel tworzy związki z arsenem, kobaltem i srebrem. Podwyższone stężenia metali związane są z formacjami mineralnymi – arsenkami i siarczkami.

W naturze nikiel występuje zwykle w związkach z innymi pierwiastkami.
Surowcem do ekstrakcji cennego składnika są rudy siarczkowe, miedziowo-niklowe zawierające arsen:
- nikiel - związek z arsenem;
- chloantyt - białe piryty zawierające kobalt i żelazo;
- garnieryt – skała krzemianowa zawierająca magnez;
- piryty magnetyczne - związek siarki z żelazem i miedzią;
- gersdorfit - połysk arsenowo-niklowy;
- pentlandyt jest związkiem siarki, żelaza i niklu.
Zawartość metali w organizmach żywych zależy od warunków i środowiska. Niektórzy przedstawiciele flory i fauny są w stanie skoncentrować metal.
Główne złoża rud znajdują się w Kanadzie, Federacja Rosyjska, Albania, Republika Południowej Afryki, Kuba, Grecja.
Proces wydobywania metalu z rud wiąże się z zastosowaniem technologii w zależności od rodzaju surowca. Nikiel jest czasami niewielkim materiałem wzbogacającym skałę.
Rudy ogniotrwałe zawierające magnez poddawane są wytopowi elektrycznemu. Rudy laterytowe zawierające żelazo są przetwarzane metodą hydrometalurgiczną, a następnie poddawane obróbce roztworami alkalicznymi.
Skała o niższej zawartości żelaza jest topiona, wypalana i wytapiana elektrycznie. Po drodze odzyskuje się metaliczny kobalt lub jego sole. Podwyższoną zawartość metalu obserwuje się w popiele z węgli kamiennych w Anglii. Fakt ten jest związany z aktywnością mikroorganizmów skupiających nikiel.
Plastyczność i inne właściwości fizyczne skład niklu zależy od czystości materiału. Niewielka domieszka siarki powoduje, że metal staje się kruchy. Dodatek magnezu do stopionego materiału oczyszcza mieszaninę z drobnych zanieczyszczeń, tworząc związek z siarką.
Branże, w których stosuje się nikiel
Fizyczne i chemiczne właściwości metalu decydują o jego zastosowaniu:
- w produkcji stali nierdzewnej;
- do tworzenia stopów niezawierających żelaza;
- w celu nakładania powłok ochronnych na wyroby metodą galwaniczną;
- do produkcji odczynników chemicznych;
- w metalurgii proszków.
Metal jest używany do produkcji baterii za pomocą procesów katalitycznych. reakcje chemiczne w produkcji przemysłowej. Stopy tytanu są doskonałym materiałem do wykonywania protez i urządzeń do wyrównywania zębów.
Kompozycja oparta na pierwiastku chemicznym nr 28 jest surowcem do bicia monet, produkcji cewek do papierosów elektronicznych. Służy do nawijania strun instrumentów muzycznych.
Do produkcji rdzeni do elektromagnesów stosuje się kompozycje - permaloje, w tym 20–60% żelaza. Nikiel jest wykorzystywany do produkcji różnych części i urządzeń dla przemysłu chemicznego.
Tlenki metali są wykorzystywane do produkcji szkła, szkliw i ceramiki. Nowoczesna produkcja specjalizuje się w wytwarzaniu różnorodnych wyrobów walcowanych: drutu, taśmy, folii, rur.

Nikiel ma szeroki zakres zastosowań, od powłok po chemikalia
Odporność na agresywne środowiska umożliwia stosowanie niklu walcowanego do transportu alkaliów w przemyśle chemicznym.
Instrumenty ze stopów niklu są stosowane w medycynie i badania naukowe. Metal jest używany do tworzenia precyzyjnych instrumentów pilot procesy w energetyce jądrowej, instalacje radarowe.
Charakterystyka stopów niklu
W kompozycjach metal łączy się głównie z żelazem i kobaltem. Jest stosowany jako główny składnik stopowy do produkcji różnych stali konstrukcyjnych, stopów magnetycznych i niemagnetycznych.
Stopy metali na bazie pierwiastka chemicznego nr 28 mają wytrzymałość, odporność na temperatury, odkształcenia i wpływy środowiska. Ich liczba sięga kilku tysięcy. Najczęstsze kompozycje to kombinacje z chromem, molibdenem, aluminium, tytanem, berylem.
Metal jest uważany za ligaturowy składnik złota, który nadaje biżuterii charakterystyczny biały kolor i wytrzymałość. W odniesieniu do tego składu krążą opinie o uczulającym działaniu niklu na skórę.
W połączeniu z chromem powstaje związek nichromowy, który jest odporny na działanie wysoka temperatura, minimalny współczynnik oporu elektrycznego, plastyczność.
Służy do produkcji urządzeń grzewczych, części, jako powłoka. Wysoka wytrzymałość połączenia pozwala na jego obróbkę skrawaniem, toczenie, spawanie, tłoczenie.

Stopy niklu mają wysoką wytrzymałość, co pozwala na ich szerokie zastosowanie w produkcji.
Specjalną grupę tworzą stopy, do których należy miedź. Wśród nich najpopularniejsze to:
- monel;
- mosiądz;
- brązowy;
- nowe srebro.
Ponad sto lat temu stwierdzono, że kompozycja żelazowo-niklowa zawierająca 28% opisywanego metalu traci swoje właściwości magnetyzujące. Stopy zawierające 36% niklu charakteryzują się niewielką rozszerzalnością liniową, co pozwala na zastosowanie go w produkcji precyzyjnych przyrządów i przyrządów.
Ta kompozycja, oznaczona jako FeNi36, nazywana jest invarem, czyli „niezmiennym”. Stop Kovar zawierający 29% niklu, 17% kobaltu i 54% żelaza znalazł szerokie zastosowanie w produkcji.
Ma wysoką przyczepność do stopionego szkła, co pozwala na wykorzystanie kompozycji do wykonywania przewodów elektrycznych przechodzących przez tę substancję.
- W kontakcie z 0
- Google+ 0
- OK 0
- Facebook 0