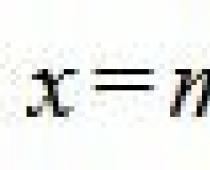Которое необходимо для изменения температуры рабочего тела, в данном случае, воздуха, на один градус. Теплоемкость воздуха непосредственно зависит от температуры и давления. При этом для исследования разных видов теплоемкости могут применяться различные методы.
Математически теплоемкость воздуха выражается как отношение количества тепла к приращению его температуры. Теплоемкость тела, имеющего массу 1 кг, принято называть удельной. Молярная теплоемкость воздуха – теплоемкость одного моля вещества. Обозначается теплоемкость – Дж/К. Молярная теплоемкость соответственно Дж/(моль*К).
Теплоемкость можно считать физической характеристикой какого-либо вещества, в данном случае воздуха, в том случае, если измерение проводится в постоянных условиях. Чаще всего подобные измерения проводятся при постоянном давлении. Так определяется изобарная теплоемкость воздуха. Она возрастает с увеличение температуры и давления, а также является линейной функцией данных величин. В этом случае изменение температуры происходит при постоянном давлении. Для расчета изобарной теплоемкости необходимо определить псевдокритическую температуру и давление. Она определяется с использованием справочных данных.
Теплоемкость воздуха. Особенности
Воздух представляет собой газовую смесь. При их рассмотрении в термодинамике приняты следующие допущения. Каждый газ в составе смеси должен быть равномерно распределен по всему объемы. Таким образом, объем газа равен объему всей смеси. Каждый газ в составе смеси обладает своим парциальным давлением, которое он оказывает на стенки сосуда. Каждый из компонентов газовой смеси должен иметь температуру, равную температуре всей смеси. При этом сумма парциальных давлений всех компонентов равняется давлению смеси. Расчет теплоемкости воздуха выполняется на основе данных о составе газовой смеси и теплоемкости отдельных компонентов.
Теплоемкость неоднозначно характеризует вещество. Из первого закона термодинамики можно сделать вывод, что внутренняя энергия тела изменяется не только в зависимости от количества полученного тепла, но и от совершенной телом работы. При различных условиях протекания процесса теплопередачи, работа тела может различаться. Таким образом, одинаковое сообщенное телу количество теплоты, может вызвать различные по значению изменения температуры и внутренней энергии тела. Эта особенность характерна только для газообразных веществ. В отличие от твердых и жидких тел, газообразные вещества, могут сильно изменять объем и совершать работу. Именно поэтому теплоемкость воздуха определяет характер самого термодинамического процесса.
Однако при постоянном объеме воздух не совершает работу. Поэтому изменение внутренней энергии пропорционально изменению его температуры. Отношение теплоемкости в процессе с постоянным давлением, к теплоемкости в процессе с постоянным объемом является частью формулы адиабатного процесса. Оно обозначается греческой литерой гамма.
Из истории
Термины «теплоемкость» и «количество теплоты» не очень удачно описывают свою суть. Связано это с тем, что они пришли в современную науку из теории теплорода, которая была популярна в восемнадцатом веке. Последователи этой теории рассматривали теплоту как некое невесомое вещество, которое содержится в телах. Это вещество не может быть ни уничтожено, ни создано. Охлаждение и нагревание тел объясняли уменьшением или увеличением содержания теплорода соответственно. Со временем эта теория была признана несостоятельной. Она не могла объяснить, почему одинаковое изменение внутренней энергии какого-либо тела получается при передаче ему разного количества теплоты, а также зависит от совершаемой телом работы.
Под удельной теплоемкостью вещества понимают количество теплоты, которое нужно сообщить или отнять от единицы вещества (1 кг, 1 м 3 , 1 моль), чтобы изменить его температуру на один градус.
В зависимости от единицы заданного вещества различают следующие удельные теплоемкости:
Массовую теплоемкость С , отнесенную к 1 кг газа, Дж/(кг∙К);
Молярную теплоемкость µС , отнесенную к 1 кмолю газа, Дж/(кмоль∙К);
Объемную теплоемкость С′ , отнесенную к 1 м 3 газа, Дж/(м 3 ∙К).
Удельные теплоемкости связаны между собой соотношением:
где υ н - удельный объем газа при нормальных условиях (н.у.), м 3 /кг; µ - молярная масса газа, кг/кмоль.
Теплоемкость идеального газа зависит от характера процесса подвода (или отвода) теплоты, от атомности газа и температуры (теплоемкость реальных газов зависит также от давления).
Связь между массовыми изобарной С P и изохорной С V теплоемкостями устанавливается уравнением Майера:
С P - С V = R , (1.2)
где R – газовая постоянная, Дж/(кг∙К).
При нагревании идеального газа в замкнутом сосуде постоянного объема теплота расходуется только на изменение энергии движения его молекул, а при нагревании при постоянном давлении, благодаря расширению газа, одновременно совершается работа против внешних сил.
Для молярных теплоемкостей уравнение Майера имеет вид:
µС р - µС v = µR , (1.3)
где µR =8314Дж/(кмоль∙К) – универсальная газовая постоянная.
Объем идеального газа V н , приведенный к нормальным условиям, определяется из следующего соотношения:
![]() (1.4)
(1.4)
где Р н – давление при нормальных условиях, Р н = 101325 Па = 760 мм ртст; Т н – температура при нормальных условиях, Т н = 273,15 K; P t , V t , T t – рабочие давление, объем и температура газа.
Отношение изобарной теплоемкости к изохорной обозначают k и называют показателем адиабаты :
![]() (1.5)
(1.5)
Из (1.2) и с учетом (1.5) получаем:
Для точных расчетов средняя теплоемкость определяется по формуле:
![]() (1.7)
(1.7)
В тепловых расчетах различного оборудования часто определяется количество тепла, которое требуется для нагрева или охлаждения газов:
Q = C∙m ∙(t 2 - t 1), (1.8)
Q = C′∙V н ∙(t 2 - t 1), (1.9)
где V н – объем газа при н.у., м 3 .
Q = µC∙ν ∙(t 2 - t 1), (1.10)
где ν – количество газа, кмоль.
Теплоемкость. Использование теплоемкости для описания процессов в закрытых системах
В соответствии с уравнением (4.56) теплота может быть определена, если известно изменение энтропии S системы. Однако то обстоятельство, что энтропия не может быть измерена непосредственно, создает некоторые осложнения, особенно при описании изохорных и изобарных процессов. Возникает необходимость в определении количества теплоты с помощью измеряемой на опыте величины.
В качестве такой величины может выступать теплоемкость системы. Наиболее общее определение теплоемкости вытекает из выражения первого закона термодинамики (5.2), (5.3). Исходя из него, любая емкость системы С по отношению к работе вида m определяется уравнением
C m = dA m / dP m = P m d e g m / dP m , (5.42)
где С m – емкость системы;
P m и g m – соответственно обобщенный потенциал и координата состояния вида m.
Величина C m показывает, какое количество работы вида m необходимо совершить при заданных условиях, чтобы изменить m-й обобщенный потенциал системы на единицу его измерения.
Понятие емкости системы по отношению к той или иной работе в термодинамике широко используется лишь при описании теплового взаимодействия между системой и окружающей средой.
Емкость системы по отношению к теплоте называется теплоемкостью и задается равенством
С = d e Q / dT = Td e S тепл / dT . (5.43)
Таким образом, теплоемкость может быть определена как количество теплоты, которое необходимо сообщить системе, чтобы изменить ее температуру на один Кельвин.
Теплоемкость, подобно внутренней энергии и энтальпии, является экстенсивной величиной, пропорциональной количеству вещества. На практике используют теплоемкость, отнесенную к единице массы вещества, – удельную теплоемкость , и теплоемкость, отнесенную к одному молю вещества, – молярную теплоемкость . Удельная теплоемкость в СИ выражается в Дж/(кг·К), а молярная – в Дж/(моль·К).
Удельная и молярная теплоемкости связаны соотношением:
С моль = С уд М, (5.44)
где М - молекулярная масса вещества.
Различают истинную (дифференциальную) теплоемкость , определяемую из уравнения (5.43) и представляющую собой элементарное приращение теплоты при бесконечно малом изменении температуры, и среднюю теплоемкость, представляющую собой отношение полного количества теплоты к полному изменению температуры в данном процессе:
Q/DT . (5.45)
Связь между истинной и средней удельной теплоемкостью устанавливается соотношением
При постоянных давлении или объеме теплота и соответственно теплоемкость приобретают свойства функции состояния, т.е. становятся характеристиками системы. Именно эти теплоемкости - изобарную С Р (при постоянном давлении) и изохорную С V (при постоянном объеме) наиболее широко используют в термодинамике.
Если система нагревается при постоянном объеме, то в соответствии с выражением (5.27) изохорная теплоемкость C V записывается в виде
C V = ![]() . (5.48)
. (5.48)
Если система нагревается при постоянном давлении, то в соответствии с уравнением (5.32) изобарная теплоемкость С Р предстает в виде
С Р = ![]() . (5.49)
. (5.49)
Чтобы найти связь между С Р и С V , надо продифференцировать выражение (5.31) по температуре. Для одного моля идеального газа это выражение с учетом уравнения (5.18) можно представить в виде
H = U + pV = U + RT . (5.50)
dH/dT = dU/dT + R, (5.51)
а разность между изобарной и изохорной теплоемкостями для одного моля идеального газа численно равна универсальной газовой постоянной R:
С Р - С V = R . (5.52)
Теплоемкость при постоянном давлении всегда больше теплоемкости при постоянном объеме, так как нагревание вещества при постоянном давлении сопровождается работой расширения газа.
Используя выражение внутренней энергии идеального одноатомного газа (5.21), получим значение его теплоемкости для одного моля идеального одноатомного газа:
C V = dU/dT = d(3/2 RT)dT = 3/2 R » 12,5 Дж/(моль·К); (5.53)
C Р = 3/2R + R = 5/2 R » 20,8 Дж/(моль·К). (5.54)
Таким образом, для одноатомных идеальных газов C V иC p не зависит от температуры, поскольку вся подведенная тепловая энергия расходуется только на ускорение поступательного движения. Для многоатомных молекул наряду с изменением поступательного движения может происходить и изменение вращательного и колебательного внутримолекулярного движения. Для двухатомных молекул обычно учитывают дополнительно вращательное движение, вследствие чего численные значения их теплоемкостей составляют:
C V = 5/2 R » 20,8 Дж/(моль·К); (5.55)
C p = 5/2 R + R = 7/2 R » 29,1 Дж/(моль·К). (5.56)
Попутно коснемся теплоемкостей веществ в других (кроме газообразного) агрегатных состояниях. Для оценки теплоемкостей твердых химических соединений нередко используют приближенное правило аддитивности Неймана и Коппа, согласно которому молярная теплоемкость химических соединений в твердом состоянии равна сумме атомных теплоемкостей элементов, входящих в данное соединение. Так, теплоемкость сложного химического соединения с учетом правила Дюлонга и Пти можно оценить так:
C V = 25n Дж/(моль·К), (5.57)
где n - число атомов в молекулах соединений.
Теплоемкости жидкостей и твердых тел вблизи температуры плавления (кристаллизации) почти равны. Вблизи нормальной температуры кипения большинство органических жидкостей имеет удельную теплоемкость 1700 - 2100 Дж/кг·К. В промежутках между этими температурами фазовых переходов теплоемкость жидкости может значительно отличаться (зависит от температуры). В общем виде зависимость теплоемкости твердых тел от температуры в интервале 0 – 290К в большинстве случаев хорошо передается полуэмпирическим уравнением Дебая (для кристаллической решетки) в области низких температур
C Р » C V = eT 3 , (5.58)
в котором коэффициент пропорциональности (e) зависит от природы вещества (эмпирическая константа).
Зависимость теплоемкости газов, жидкостей и твердых тел от температуры при обычных и высоких температурах принято выражать с помощью эмпирических уравнений, имеющих вид степенных рядов:
С Р = a + bT + cT 2 (5.59)
С Р = a + bT + c"T -2 , (5.60)
где a, b, c и c" - эмпирические температурные коэффициенты.
Возвращаясь к описанию процессов в закрытых системах с привлечением метода теплоемкостей, запишем некоторые уравнения, приведенные в параграфе 5.1, в несколько ином виде.
Изохорный процесс . Выражая внутреннюю энергию (5.27) через теплоемкость, получим
dU V = dQ V = U 2 – U 1 = C V dT = C V dT . (5.61)
С учетом того, что теплоемкость идеального газа не зависит от температуры, уравнение (5.61) можно записать так:
DU V = Q V = U 2 - U 1 = C V DT . (5.62)
Чтобы вычислить значение интеграла (5.61) для реальных одно- и многоатомных газов, надо знать конкретный вид функциональной зависимости C V = f(T) типа (5.59) или (5.60).
Изобарный процесс. Для газообразного состояния вещества первый закон термодинамики (5.29) для этого процесса с учетом записи работы расширения (5.35) и с использованием метода теплоемкостей записывается так:
Q Р = С V DT + RDT = C Р DT = DH (5.63)
Q Р = DH Р = H 2 – H 1 = C Р dT . (5.64)
Если система является идеальным газом и теплоемкость С Р не зависит от температуры, соотношение (5.64) переходит в (5.63). Для решения уравнения (5.64), описывающего реальный газ, необходимо знать конкретный вид зависимости C p = f(T).
Изотермический процесс. Изменение внутренней энергии идеального газа в процессе, протекающем при постоянной температуре
dU T = C V dT = 0. (5.65)
Адиабатический процесс. Так как dU = C V dT, то для одного моля идеального газа изменение внутренней энергии и совершаемая работа равны соответственно:
DU = C V dT = C V (T 2 - T 1); (5.66)
А мех = -DU = C V (T 1 - T 2). (5.67)
Анализ уравнений, характеризующих различные термодинамические процессы при условиях: 1) p = сonst; 2) V = сonst; 3) T = сonst и 4) dQ = 0 показывает, что все они могут быть представлены общим уравнением:
pV n = сonst. (5.68)
В этом уравнении показатель "n" может принимать значения от 0 до¥ для разных процессов:
1. изобарного (n = 0);
2. изотермического (n = 1);
3. изохорного (n = ¥);
4. адиабатического (n = g; где g = C Р /C V – адиабатический коэффициент).
Полученные соотношения справедливы для идеального газа и представляют собой следствие его уравнения состояния, а рассмотренные процессы - частные и предельные проявления реальных процессов. Реальные же процессы, как правило, являются промежуточными, протекают при произвольных значениях "n" и получили название политропных процессов.
Если сравнить работу расширения идеального газа, производимую в рассмотренных термодинамических процессах, с изменением объема от V 1 до V 2 , то, как видно из рис. 5.2, наибольшая работа расширения совершается в изобарном процессе, меньшая – в изотермическом и еще меньшая – в адиабатическом. Для изохорного процесса работа равна нулю.
Рис. 5.2. P = f (V) –зависимость для различных термодинамических процессов (заштрихованные области характеризуют работу расширения в соответствующем процессе)
Рассмотрены основные физические свойства воздуха: плотность воздуха, его динамическая и кинематическая вязкость, удельная теплоемкость, теплопроводность, температуропроводность, число Прандтля и энтропия. Свойства воздуха даны в таблицах в зависимости от температуры при нормальном атмосферном давлении.
Плотность воздуха в зависимости от температуры
Представлена подробная таблица значений плотности воздуха в сухом состоянии при различных температурах и нормальном атмосферном давлении. Чему равна плотность воздуха? Аналитически определить плотность воздуха можно, если разделить его массу на объем, который он занимает при заданных условиях (давление, температура и влажность). Также можно вычислить его плотность по формуле уравнения состояния идеального газа . Для этого необходимо знать абсолютное давление и температуру воздуха, а также его газовую постоянную и молярный объем. Это уравнение позволяет вычислить плотность воздуха в сухом состоянии.
На практике, чтобы узнать какова плотность воздуха при различных температурах , удобно воспользоваться готовыми таблицами. Например, приведенной таблицей значений плотности атмосферного воздуха в зависимости от его температуры. Плотность воздуха в таблице выражена в килограммах на кубический метр и дана в интервале температуры от минус 50 до 1200 градусов Цельсия при нормальном атмосферном давлении (101325 Па).
| t, °С | ρ, кг/м 3 | t, °С | ρ, кг/м 3 | t, °С | ρ, кг/м 3 | t, °С | ρ, кг/м 3 |
|---|---|---|---|---|---|---|---|
| -50 | 1,584 | 20 | 1,205 | 150 | 0,835 | 600 | 0,404 |
| -45 | 1,549 | 30 | 1,165 | 160 | 0,815 | 650 | 0,383 |
| -40 | 1,515 | 40 | 1,128 | 170 | 0,797 | 700 | 0,362 |
| -35 | 1,484 | 50 | 1,093 | 180 | 0,779 | 750 | 0,346 |
| -30 | 1,453 | 60 | 1,06 | 190 | 0,763 | 800 | 0,329 |
| -25 | 1,424 | 70 | 1,029 | 200 | 0,746 | 850 | 0,315 |
| -20 | 1,395 | 80 | 1 | 250 | 0,674 | 900 | 0,301 |
| -15 | 1,369 | 90 | 0,972 | 300 | 0,615 | 950 | 0,289 |
| -10 | 1,342 | 100 | 0,946 | 350 | 0,566 | 1000 | 0,277 |
| -5 | 1,318 | 110 | 0,922 | 400 | 0,524 | 1050 | 0,267 |
| 0 | 1,293 | 120 | 0,898 | 450 | 0,49 | 1100 | 0,257 |
| 10 | 1,247 | 130 | 0,876 | 500 | 0,456 | 1150 | 0,248 |
| 15 | 1,226 | 140 | 0,854 | 550 | 0,43 | 1200 | 0,239 |
При 25°С воздух имеет плотность 1,185 кг/м 3 . При нагревании плотность воздуха снижается — воздух расширяется (его удельный объем увеличивается). С ростом температуры, например до 1200°С, достигается очень низкая плотность воздуха, равная 0,239 кг/м 3 , что в 5 раз меньше ее значения при комнатной температуре. В общем случае, снижение при нагреве позволяет проходить такому процессу, как естественная конвекция и применяется, например, в воздухоплавании.
Если сравнить плотность воздуха относительно , то воздух легче на три порядка — при температуре 4°С плотность воды равна 1000 кг/м 3 , а плотность воздуха составляет 1,27 кг/м 3 . Необходимо также отметить значение плотности воздуха при нормальных условиях. Нормальными условиями для газов являются такие, при которых их температура равна 0°С, а давление равно нормальному атмосферному. Таким образом, согласно таблице, плотность воздуха при нормальных условиях (при НУ) равна 1,293 кг/м 3 .
Динамическая и кинематическая вязкость воздуха при различных температурах
При выполнении тепловых расчетов необходимо знать значение вязкости воздуха (коэффициента вязкости) при различной температуре. Эта величина требуется для вычисления числа Рейнольдса, Грасгофа, Релея, значения которых определяют режим течения этого газа. В таблице даны значения коэффициентов динамической μ и кинематической ν вязкости воздуха в диапазоне температуры от -50 до 1200°С при атмосферном давлении.
Коэффициент вязкости воздуха с ростом его температуры значительно увеличивается. Например, кинематическая вязкость воздуха равна 15,06·10 -6 м 2 /с при температуре 20°С, а с ростом температуры до 1200°С вязкость воздуха становиться равной 233,7·10 -6 м 2 /с, то есть увеличивается в 15,5 раз! Динамическая вязкость воздуха при температуре 20°С равна 18,1·10 -6 Па·с.
При нагревании воздуха увеличиваются значения как кинематической, так и динамической вязкости. Эти две величины связаны между собой через величину плотности воздуха, значение которой уменьшается при нагревании этого газа. Увеличение кинематической и динамической вязкости воздуха (как и других газов) при нагреве связано с более интенсивным колебанием молекул воздуха вокруг их равновесного состояния (согласно МКТ).
| t, °С | μ·10 6 , Па·с | ν·10 6 , м 2 /с | t, °С | μ·10 6 , Па·с | ν·10 6 , м 2 /с | t, °С | μ·10 6 , Па·с | ν·10 6 , м 2 /с |
|---|---|---|---|---|---|---|---|---|
| -50 | 14,6 | 9,23 | 70 | 20,6 | 20,02 | 350 | 31,4 | 55,46 |
| -45 | 14,9 | 9,64 | 80 | 21,1 | 21,09 | 400 | 33 | 63,09 |
| -40 | 15,2 | 10,04 | 90 | 21,5 | 22,1 | 450 | 34,6 | 69,28 |
| -35 | 15,5 | 10,42 | 100 | 21,9 | 23,13 | 500 | 36,2 | 79,38 |
| -30 | 15,7 | 10,8 | 110 | 22,4 | 24,3 | 550 | 37,7 | 88,14 |
| -25 | 16 | 11,21 | 120 | 22,8 | 25,45 | 600 | 39,1 | 96,89 |
| -20 | 16,2 | 11,61 | 130 | 23,3 | 26,63 | 650 | 40,5 | 106,15 |
| -15 | 16,5 | 12,02 | 140 | 23,7 | 27,8 | 700 | 41,8 | 115,4 |
| -10 | 16,7 | 12,43 | 150 | 24,1 | 28,95 | 750 | 43,1 | 125,1 |
| -5 | 17 | 12,86 | 160 | 24,5 | 30,09 | 800 | 44,3 | 134,8 |
| 0 | 17,2 | 13,28 | 170 | 24,9 | 31,29 | 850 | 45,5 | 145 |
| 10 | 17,6 | 14,16 | 180 | 25,3 | 32,49 | 900 | 46,7 | 155,1 |
| 15 | 17,9 | 14,61 | 190 | 25,7 | 33,67 | 950 | 47,9 | 166,1 |
| 20 | 18,1 | 15,06 | 200 | 26 | 34,85 | 1000 | 49 | 177,1 |
| 30 | 18,6 | 16 | 225 | 26,7 | 37,73 | 1050 | 50,1 | 188,2 |
| 40 | 19,1 | 16,96 | 250 | 27,4 | 40,61 | 1100 | 51,2 | 199,3 |
| 50 | 19,6 | 17,95 | 300 | 29,7 | 48,33 | 1150 | 52,4 | 216,5 |
| 60 | 20,1 | 18,97 | 325 | 30,6 | 51,9 | 1200 | 53,5 | 233,7 |
Примечание: Будьте внимательны! Вязкость воздуха дана в степени 10 6 .
Удельная теплоемкость воздуха при температуре от -50 до 1200°С
Представлена таблица удельной теплоемкости воздуха при различных температурах. Теплоемкость в таблице дана при постоянном давлении (изобарная теплоемкость воздуха) в интервале температуры от минус 50 до 1200°С для воздуха в сухом состоянии. Чему равна удельная теплоемкость воздуха? Величина удельной теплоемкости определяет количество тепла, которое необходимо подвести к одному килограмму воздуха при постоянном давлении для увеличения его температуры на 1 градус. Например, при 20°С для нагревания 1 кг этого газа на 1°С в изобарном процессе, требуется подвести 1005 Дж тепла.
Удельная теплоемкость воздуха увеличивается с ростом его температуры. Однако, зависимость массовой теплоемкости воздуха от температуры не линейная. В интервале от -50 до 120°С ее величина практически не меняется — в этих условиях средняя теплоемкость воздуха равна 1010 Дж/(кг·град). По данным таблицы видно, что значительное влияние температура начинает оказывать со значения 130°С. Однако, температура воздуха влияет на его удельную теплоемкость намного слабее, чем на вязкость. Так, при нагреве с 0 до 1200°С теплоемкость воздуха увеличивается лишь в 1,2 раза – с 1005 до 1210 Дж/(кг·град).
Следует отметить, что теплоемкость влажного воздуха выше, чем сухого. Если сравнить и воздуха, то очевидно, что вода обладает более высоким ее значением и содержание воды в воздухе приводит к увеличению удельной теплоемкости.
| t, °С | C p , Дж/(кг·град) | t, °С | C p , Дж/(кг·град) | t, °С | C p , Дж/(кг·град) | t, °С | C p , Дж/(кг·град) |
|---|---|---|---|---|---|---|---|
| -50 | 1013 | 20 | 1005 | 150 | 1015 | 600 | 1114 |
| -45 | 1013 | 30 | 1005 | 160 | 1017 | 650 | 1125 |
| -40 | 1013 | 40 | 1005 | 170 | 1020 | 700 | 1135 |
| -35 | 1013 | 50 | 1005 | 180 | 1022 | 750 | 1146 |
| -30 | 1013 | 60 | 1005 | 190 | 1024 | 800 | 1156 |
| -25 | 1011 | 70 | 1009 | 200 | 1026 | 850 | 1164 |
| -20 | 1009 | 80 | 1009 | 250 | 1037 | 900 | 1172 |
| -15 | 1009 | 90 | 1009 | 300 | 1047 | 950 | 1179 |
| -10 | 1009 | 100 | 1009 | 350 | 1058 | 1000 | 1185 |
| -5 | 1007 | 110 | 1009 | 400 | 1068 | 1050 | 1191 |
| 0 | 1005 | 120 | 1009 | 450 | 1081 | 1100 | 1197 |
| 10 | 1005 | 130 | 1011 | 500 | 1093 | 1150 | 1204 |
| 15 | 1005 | 140 | 1013 | 550 | 1104 | 1200 | 1210 |
Теплопроводность, температуропроводность, число Прандтля воздуха
В таблице представлены такие физические свойства атмосферного воздуха, как теплопроводность, температуропроводность и его число Прандтля в зависимости от температуры. Теплофизические свойства воздуха даны в интервале от -50 до 1200°С для сухого воздуха. По данным таблицы видно, что указанные свойства воздуха существенно зависят от температуры и температурная зависимость рассмотренных свойств этого газа различна.
Транспортная энергетика (хладотранспорт) Влажность воздуха. Теплоёмкость и энтальпия воздухаВлажность воздуха. Теплоёмкость и энтальпия воздуха
Атмосферный воздух представляет собой смесь сухого воздуха и водяного пара (от 0,2% до 2,6%). Таким образом, воздух практически всегда можно рассматривать как влажный.
Механическая смесь сухого воздуха с водяным паром называется влажным воздухом или воздушно-паровой смесью. Максимально возможное содержание парообразной влаги в воздухе m п.н зависит от температуры t и давления P смеси. При изменении t и P воздух может перейти из первоначально ненасыщенного в состояние насыщения водяными парами, и тогда избыточная влага начнёт выпадать в газовом объёме и на ограждающих поверхностях в виде тумана, инея или снега.
Основными параметрами, характеризующими состояние влажного воздуха, являются: температура, давление, удельный объем, влагосодержание, абсолютная и относительная влажность, молекулярная масса, газовая постоянная, теплоемкость и энтальпия.
По закону Дальтона для газовых смесей полное давление влажного воздуха (Р) есть сумма парциальных давлений сухого воздуха Р c и водяных паров Р п: Р = Р c + Р п.
Аналогично, объём V и масса m влажного воздуха будет определятся соотношениями:
V = V c + V п, m = m c + m п.
Плотность и удельный объем влажного воздуха (v) определяется:
![]()
Молекулярная масса влажного воздуха:
![]()
где В - барометрическое давление.
Поскольку в процессе сушки влажность воздуха непрерывно увеличивается, а количество сухого воздуха в паровоздушной смеси остается постоянным, то о процессе сушки судят по тому, как изменяется количество водяного пара на 1 кг сухого воздуха, и все показатели паровоздушной смеси (теплоемкость, влагосодержание, энтальпия и др.) относят к 1 кг сухого воздуха, находящегося во влажном воздухе.
d = m п / m c , г/кг, или, Х = m п /m c .
Абсолютная влажность воздуха - масса пара в 1 м 3 влажного воздуха. Эта величина численно равна .
Относительная влажность воздуха - это отношение абсолютной влажности ненасыщенного воздуха к абсолютной влажности насыщенного воздуха при заданных условиях:
здесь , но чаще относительную влажность задают в процентах.
Для плотности влажного воздуха справедливо соотношение:
Удельная теплоёмкость влажного воздуха:
c = с c + с п ×d/1000 = с c + с п ×X, кДж/(кг× °С),
где с c - удельная теплоёмкость сухого воздуха, с c = 1,0;
с п - удельная теплоёмкость пара; с п = 1,8.
Теплоемкость сухого воздуха при постоянном давлении и небольших интервалах температур (до 100 о С) для приближенных расчетов можно считать постоянной, равной 1,0048 кДж/(кг×°С). Для перегретого пара средняя изобарная теплоемкость при атмосферном давлении и невысоких степенях перегрева может быть принято также постоянной и равной 1,96 кДж/(кг×К).
Энтальпия (i) влажного воздуха - это один из основных его параметров, который широко применяется при расчетах сушильных установок главным образом для определния теплоты, расходуемой на испарение влаги из подсушиваемых материалов. Энтальпию влажного воздуха относят к одному килограмму сухого воздуха в паровоздушной смеси и определяют как сумму энтальпий сухого воздуха и водяного пара, то есть
i = i c + i п ×Х, кДж/кг.
При расчете энтальпии смесей начальная точка отсчета энтальпий каждого из компонентов должна быть одной и той же. Для расчетов влажного воздуха можно принять, что энтальпия воды равна нулю при 0 о С, тогда и энтальпию сухого воздуха также отсчитываем от 0 о С, то есть i в = с в *t = 1,0048t.
Лабораторная работа № 1
Определение массовой изобарной
теплоемкости воздуха
Теплоемкость – это теплота, которую необходимо подвести к единичному количеству вещества, чтобы нагреть его на 1 К. Единичное количество вещества можно измерить в килограммах, кубометрах при нормальных физических условиях и кило молях. Киломоль газа – это масса газа в килограммах, численно равная его молекулярной массе. Таким образом, существует три вида теплоемкостей: массовая c, Дж/(кг⋅К); объемная с′, Дж/(м3⋅К) и мольная , Дж/(кмоль⋅К). Поскольку киломоль газа имеет массу в μ раз больше одного килограмма, отдельного обозначения для мольной теплоемкости не вводят. Соотношения между теплоемкостями:
где = 22,4 м3/кмоль – объем киломоля идеального газа при нормальных физических условиях; – плотность газа при нормальных физических условиях, кг/м3.
Истинная теплоемкость газа – это производная от теплоты по температуре:
Подведенная к газу теплота зависит от термодинамического процесса. Она может быть определена по первому закону термодинамики для изохорного и изобарного процессов:
Здесь – теплота, подведенная к 1 кг газа в изобарном процессе; – изменение внутренней энергии газа; – работа газов против внешних сил.
По существу формула (4) формулирует 1-е начало термодинамики, откуда следует уравнение Майера:
Если положить = 1 К, то , то есть физический смысл газовой постоянной – это работа 1 кг газа в изобарном процессе при изменении его температуры на 1 К.
Уравнение Майера для 1 кило моля газа имеет вид
где = 8314 Дж/(кмоль⋅К) – универсальная газовая постоянная.
Кроме уравнения Майера, изобарная и изохорная массовые теплоемкости газов связаны между собой через показатель адиабаты k (табл.1):
Таблица 1.1
Значения показателей адиабаты для идеальных газов
Атомность газов | |
Одноатомные газы | |
Двухатомные газы | |
Трех - и многоатомные газы |
ЦЕЛЬ РАБОТЫ
Закрепление теоретических знаний по основным законам термодинамики. Практическое освоение метода определения теплоемкости воздуха на основе энергетического баланса.
Экспериментальное определение удельной массовой теплоемкости воздуха и сопоставление полученного результата со справочным значением.
1.1. Описание лабораторной установки
Установка (рис. 1.1) состоит из латунной трубы 1 внутренним диаметром d =
= 0,022 м, на конце которой расположен электронагревас тепловой изоляцией 10. Внутри трубы движется поток воздуха, который подается 3. Расход воздуха может регулироваться изменением числа оборотов вентилятора. В трубе 1 установлена трубка полного напора 4 и избыточного статического давления 5, которые подсоединены к манометрам 6 и 7. Кроме того, в трубе 1 установлена термопара 8, которая может перемещаться по сечению одновременно с трубкой полного напора. Величина ЭДС термопары определяется по потенциометру 9. Нагрев воздуха, движущегося по трубе, регулируется с помощью лабораторного автотрансформатора 12 путем изменения мощности нагревателя, которая определяется по показаниям амперметра 14 и вольтметра 13. Температура воздуха на выходе из нагревателя определяется термометром 15.
1.2. МЕТОДИКА ПРОВЕДЕНИЯ ЭКСПЕРИМЕНТА
Тепловой поток нагревателя, Вт:
где I – ток, А; U – напряжение, В; = 0,96; =
= 0,94 – коэффициент тепловых потерь.

Рис.1.1. Схема экспериментальной установки:
1 – труба; 2 – конфузор; 3 – вентилятор; 4 – трубка для измерения динамического напора;
5 – патрубок; 6, 7 – дифманометры; 8 – термопара; 9 – потенциометр; 10 – изоляция;
11 – электронагреватель; 12 – лабораторный автотрансформатор; 13 – вольтметр;
14 – амперметр; 15 – термометр
Тепловой поток, воспринятый воздухом, Вт:
где m – массовый расход воздуха, кг/с; – экспериментальная, массовая изобарная теплоемкость воздуха, Дж/(кг·К); – температура воздуха на выходе из нагревательного участка и на входе в него, °С.
Массовый расход воздуха, кг/с:
![]() . (1.10)
. (1.10)
Здесь – средняя скорость воздуха в трубе, м/с; d – внутренний диаметр трубы, м; – плотность воздуха при температуре , которая находится по формуле, кг/м3:
![]() , (1.11)
, (1.11)
где = 1,293 кг/м3 – плотность воздуха при нормальных физических условиях; B – давление, мм. рт. ст; – избыточное статическое давление воздуха в трубе, мм. вод. ст.
Скорости воздуха определяются по динамическому напору в четырех равновеликих сечениях, м/с:
где – динамический напор, мм. вод. ст. (кгс/м2); g = 9,81 м/с2 – ускорение свободного падения.
Средняя скорость воздуха в сечении трубы, м/с:
Средняя изобарная массовая теплоемкость воздуха определяется из формулы (1.9), в которую тепловой поток подставляется из уравнения (1.8). Точное значение теплоемкости воздуха при средней температуре воздуха находится по таблице средних теплоемкостей или по эмпирической формуле, Дж/(кг⋅К):
![]() . (1.14)
. (1.14)
Относительная погрешность эксперимента, %:
![]() . (1.15)
. (1.15)
1.3. Проведение эксперимента и обработка
результатов измерений
Эксперимент проводится в следующей последовательности.
1. Включается лабораторный стенд и после установления стационарного режима снимаются следующие показания:
Динамический напор воздуха в четырех точках равновеликих сечений трубы;
Избыточное статическое давление воздуха в трубе ;
Ток I, А и напряжение U, В;
Температура воздуха на входе , °С (термопара 8);
Температура на выходе , °С (термометр 15);
Барометрическое давление B, мм. рт. ст.
Эксперимент повторяется для следующего режима. Результаты измерений заносятся в табл.1.2. Расчеты выполняются в табл. 1.3.
Таблица 1.2
Таблица измерений
Наименование величины | |||
Температура воздуха на входе , °C | |||
Температура воздуха на выходе , °C |
|||
Динамический напор воздуха , мм. вод. ст. | |||
Избыточное статическое давление воздуха , мм. вод. ст. |
|||
Барометрическое давление B, мм. рт. ст. |
|||
Напряжение U, В |
Таблица 1.3
Таблица расчетов
Наименование величин |
|
|||
Динамический напор , Н/м2 | ||||
Средняя температура потока на входе , °C |