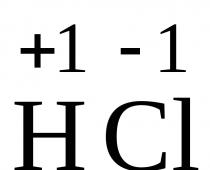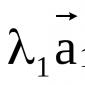Nota explicativa Prueba temática "Patrones de cambios en las propiedades químicas de los elementos y sus compuestos por períodos y grupos"diseñado para preparar a los estudiantes para el Unificado Examen de Estado en Quimica. Público objetivo: 11º grado. Formulaciones tareas de prueba corresponder Versión de demostración Prueba y medición de materiales en química 2018.
Las tareas se compilan por analogía con las pruebas publicadas en el manual del Examen Estatal Unificado. Química: típica opciones de examen: 30 opciones / ed. AUTOMÓVIL CLUB BRITÁNICO. Kaverina", publicado por la editorial "Educación Nacional" (Moscú, 2017)
Patrones de cambios en las propiedades químicas de los elementos y sus compuestos por períodos y grupos.
| 1)cl | 2) k | 3) Sí | 4)S | 5) Oh |
- De los elementos químicos indicados en la serie, seleccione tres elementos que se encuentren en la Tabla Periódica de Elementos Químicos D.I. Mendeleev se encuentra en el mismo período. Organice los elementos seleccionados en orden de electronegatividad decreciente.
Escriba los números de los elementos seleccionados en la secuencia requerida en el campo de respuesta.
Respuesta:
De los elementos químicos indicados en la serie, seleccione tres elementos que se encuentren en la Tabla Periódica de Elementos Químicos D.I. Mendeleev está en el mismo grupo. Organice los elementos seleccionados en orden creciente de propiedades ácidas de sus compuestos de hidrógeno.
De los elementos químicos indicados en la serie, seleccione tres elementos que se encuentren en la Tabla Periódica de Elementos Químicos D.I. Mendeleev está en el mismo grupo. Ordene los elementos seleccionados en orden decreciente de sus propiedades metálicas.
De los elementos químicos indicados en la serie, seleccione tres elementos que se encuentren en la Tabla Periódica de Elementos Químicos D.I. Mendeleev se encuentra en el mismo período. Organice los elementos seleccionados en orden creciente de propiedades ácidas de sus hidróxidos superiores.
De los elementos químicos indicados en la serie, seleccione tres elementos que se encuentren en la Tabla Periódica de Elementos Químicos D.I. Mendeleev se encuentra en el mismo período. Organice los elementos seleccionados en orden creciente de número de electrones externos en los átomos de estos elementos.
De los elementos químicos indicados en la serie, seleccione tres elementos que se encuentren en la Tabla Periódica de Elementos Químicos D.I. Mendeleev se encuentra en el mismo período. Organice los elementos seleccionados en orden creciente de radio de sus átomos.
De los elementos químicos indicados en la serie, seleccione tres elementos que se encuentren en la Tabla Periódica de Elementos Químicos D.I. Mendeleev se encuentra en el mismo período. Organice los elementos seleccionados en orden de aumentar las propiedades oxidantes de sus átomos.
De los elementos químicos indicados en la serie, seleccione tres elementos que se encuentren en la Tabla Periódica de Elementos Químicos D.I. Mendeleev está en el mismo grupo. Ordene los elementos seleccionados para mejorar las propiedades básicas de los óxidos que forman.
Seleccione tres metales de los elementos químicos enumerados en la serie. Organizar los elementos seleccionados en orden decreciente propiedades reductoras.
De los elementos químicos indicados en la serie, seleccione tres elementos que se encuentren en la Tabla Periódica de Elementos Químicos D.I. Mendeleev está en el mismo grupo.
Organice estos elementos en orden creciente de fuerza de atracción de los electrones de valencia.
Respuestas
Pregunta 1
Pregunta 2
Pregunta 3
Una de las leyes más importantes de la naturaleza es la ley periódica, descubierta en 1869 por Mendeleev, que formuló de la siguiente manera: “Las propiedades de las sustancias simples, así como las formas y propiedades de los compuestos, dependen periódicamente de los pesos atómicos de los elementos."
Con el desarrollo de la química cuántica, la ley periódica recibió una estricta justificación teórica, y con ella una nueva formulación: “Las propiedades de las sustancias simples, así como las formas y propiedades de los compuestos de los elementos, dependen periódicamente de la magnitud de la cargas de los núcleos de sus átomos”.
Antes de Mendeleev, muchos intentaron sistematizar los elementos; Mayer (Alemania) fue el que más se acercó. En 1864, en su libro, dio una tabla en la que también estaban ordenados los elementos en orden creciente de sus masas atómicas, pero en esta tabla Mayer colocó sólo 27 elementos, menos de la mitad de los conocidos en ese momento. Es mérito de Mendeleev que en su tabla hubiera un lugar no sólo para todos los elementos conocidos, sino que también se dejaran espacios vacíos para los que aún no se conocían. elementos abiertos(eca-boro – Sc, eka-aluminio – Ga, eca-silicio – Ge).

Desde el punto de vista de la estructura electrónica del átomo:
Período Se llama secuencia horizontal de elementos que comienza con un metal alcalino y termina con un gas noble con mismo valor máximo número cuántico principal igual al número del período.
El número de elementos en un período está determinado por la capacidad de los subniveles.
Por grupo Los elementos son una colección vertical de elementos que tienen la misma configuración electrónica y una cierta similitud química. El número del grupo (a excepción de los subgrupos laterales I, II, VIII) es igual a la suma de los electrones de valencia.
Además de la división por períodos (determinada por el número cuántico principal), existe la división por familias, determinado por el número cuántico orbital. Si el subnivel s de un elemento está lleno, entonces la familia s o el elemento s; subnivel p – elemento p; subnivel d – elemento d; Subnivel f – elemento f.
En la forma de período corto del sistema periódico hay 8 grupos, cada uno de los cuales se divide en un subgrupo principal y secundario. Los subgrupos principales I y II están llenos de elementos s; Subgrupos principales III-VIII: elementos p. Los elementos d se encuentran en subgrupos secundarios. Los elementos f se colocan en grupos separados.
Por lo tanto, cada elemento en la tabla periódica de elementos ocupa un lugar estrictamente definido, que está marcado con un número de serie y está asociado con la estructura de las capas electrónicas del átomo.
1.2.1. Patrones de cambios en las propiedades de los elementos y sus compuestos por períodos y grupos.
Los estudios experimentales han establecido la dependencia de las propiedades químicas y físicas de los elementos de su posición en la tabla periódica.
Energía de ionización es la energía que se debe gastar para desprender y eliminar un electrón de un átomo, ion o molécula . Se expresa en J o eV (1 eV = 1,6,10 -19 J).
La energía de ionización es medida de la capacidad restaurativaátomo. Cuanto menor sea el valor de la energía de ionización, mayor será la capacidad reductora del átomo. Los átomos pierden un electrón y se convierten en iones cargados positivamente.
Afinidad electronica es la energía liberada cuando se añade un electrón a un átomo, molécula o radical.
La energía de afinidad electrónica de los átomos cambia naturalmente de acuerdo con la naturaleza de las estructuras electrónicas de los átomos de los elementos. En periodos de izquierda a derecha Aumenta la afinidad electrónica y las propiedades oxidantes de los elementos. En los grupos de arriba a abajo, la afinidad electrónica tiende a disminuir.
Los halógenos tienen la mayor afinidad electrónica porque... Al añadir un electrón a un átomo neutro, éste adquiere la configuración electrónica completa de un gas noble.
La característica de qué átomo cede o gana un electrón más fácilmente se llama electronegatividad que es igual a la mitad de la suma de la energía de ionización y la afinidad electrónica.
La electronegatividad aumenta de izquierda a derecha para los elementos de cada período y disminuye de arriba a abajo para los elementos del mismo grupo PS.
Radios atómicos e iónicos.
Los átomos y los iones no tienen límites estrictamente definidos debido a la naturaleza ondulatoria de los electrones. Por lo tanto, se determinan los radios condicionales de átomos e iones conectados entre sí mediante enlaces químicos en cristales.
Los radios de los átomos de los metales disminuyen en períodos en los que aumenta el número atómico de los elementos., porque con el mismo número de capas de electrones, aumenta la carga del núcleo y, en consecuencia, la atracción de los electrones por él.
Dentro de cada grupo de elementos, por regla general, los radios de los átomos aumentan de arriba a abajo., porque el número de niveles de energía aumenta. Los radios de los iones también dependen periódicamente del número atómico del elemento.

Ejemplo.¿Cómo cambian los tamaños de los átomos dentro de un período, durante la transición de un período a otro y dentro de un grupo? ¿Qué elementos tienen valores de tamaño atómico mínimo y máximo?
Dentro de un período (de izquierda a derecha), los tamaños de los átomos disminuyen, porque La carga nuclear aumenta y los electrones son atraídos con más fuerza hacia el núcleo. En los subgrupos principales, los tamaños de los átomos aumentan, porque aumenta el número de capas electrónicas. En los subgrupos laterales, tales cambios son menos notables debido a la compresión d, y durante la transición del período V al VI, incluso hay una disminución en el tamaño de los átomos debido a la compresión f.
Según estas reglas, el tamaño mínimo de un átomo es helio, y el máximo – cesio. El francio no tiene isótopos de larga vida (el isótopo natural es radiactivo, su vida media es de 21 minutos).
Metales y no metales. La división de elementos y sustancias simples en metales y no metales es hasta cierto punto arbitraria.
En términos de propiedades físicas, los metales se caracterizan por una alta conductividad térmica y eléctrica, un coeficiente de conductividad de temperatura negativo, brillo metálico específico, maleabilidad, plasticidad, etc.
Según sus propiedades químicas, los metales se caracterizan por tener propiedades básicas de óxidos e hidróxidos y propiedades reductoras.
Tales diferencias en las propiedades de sustancias simples están asociadas con la naturaleza del enlace químico durante su formación. Un enlace metálico en los metales se forma cuando hay deficiencia de electrones de valencia, y un enlace covalente en los no metales cuando hay una cantidad suficiente de ellos. En base a esto, es posible trazar un límite vertical entre elementos de los grupos IIIA y IV. A la izquierda están los elementos con deficiencia de electrones de valencia, a la derecha, los que tienen exceso. Esta es la frontera de Tsintl.
Ejemplo.¿En qué se diferencian los metales típicos de los no metales? ¿Por qué y cómo cambian las propiedades metálicas al aumentar el número atómico de elementos?
La tabla periódica de elementos contiene principalmente metales y algunos no metales (22 en total). Los metales incluyen todos los elementos s. Esto se debe a la presencia de un pequeño número de electrones de valencia (1 o 2), producto de esta deficiencia de electrones se forma un enlace metálico.
Todos los elementos d y f también son metales. Cuando se forman enlaces químicos, los electrones s del nivel de energía externo y parte o todos los electrones d del penúltimo nivel actúan como electrones de valencia en los átomos de los elementos d, y los electrones d participan únicamente en la formación de enlaces químicos. después de que todos los electrones s externos estén unidos. Además, la facilidad de eliminación de los electrones s se ve facilitada por el efecto de blindaje de la carga nuclear. Consiste en reducir el impacto sobre el electrón. Carga positiva núcleo debido a la presencia de otros electrones entre el electrón en cuestión y el núcleo (estos son electrones d o f).
En los elementos p, existe una competencia entre un aumento en el número de electrones de valencia (propiedades no metálicas) y el blindaje de la carga nuclear (se mejoran las propiedades metálicas). En este sentido, para los elementos p del subgrupo de arriba a abajo, aumenta la estabilidad de los estados de oxidación más bajos.
Según el período, de derecha a izquierda, las propiedades no metálicas de los átomos aumentan, debido al aumento de la carga del núcleo atómico y a la dificultad de ceder electrones. En el subgrupo de arriba a abajo, las propiedades metálicas aumentan, ya que se debilita la conexión de los electrones externos con el núcleo.
Las propiedades de los compuestos se dividen en ácido-base y redox. La tabla periódica de elementos explica bien estos patrones. Consideremos esto usando hidróxidos como ejemplo.
Si un elemento tiene un estado de oxidación pequeño (+1 o +2), por ejemplo, Na-O-H, entonces el enlace Na-O es menos fuerte que O-H y el enlace se rompe a lo largo del enlace más débil.
Na-O-H Na + + OH - . El compuesto tiene propiedades básicas.
Si el estado de oxidación de un elemento es alto (de +5 a +7), entonces el enlace elemento-oxígeno es más fuerte que Conexión OH y el compuesto tiene propiedades ácidas. En el ácido nítrico, el estado de oxidación del nitrógeno es alto (+5).

h + +NO 3 -
Los compuestos en el estado de oxidación +3 y +4 exhiben propiedades anfóteras, es decir Dependiendo del interlocutor, pueden presentar propiedades tanto ácidas como básicas. Pero hay excepciones: Zn +2, Be +2, Sn +2, Pb +2, Ge +2 tienen un estado de oxidación de +2, pero son compuestos anfóteros.
Por periodo de derecha a izquierda aumenta el estado de oxidación más alto, igual al número de grupo, por lo tanto Las propiedades no metálicas y ácidas aumentan..
Por subgrupo De arriba hacia abajo Las propiedades metálicas y básicas aumentan., porque El tamaño del átomo aumenta y el enlace con el átomo vecino se debilita. .
Así, la tabla periódica permite analizar la posición de sustancias simples en relación con las características de sus propiedades (metales, no metales).

La ley periódica de Mendeleev permite determinar las propiedades de sustancias simples en compuestos químicos. Por primera vez, la predicción de propiedades la llevó a cabo el propio Mendeleev. Calculó las propiedades de aquellos elementos que aún no habían sido descubiertos.
Se determinan las propiedades de los elementos y sus conexiones.: 1 - cargas de núcleos atómicos, 2 - radios atómicos.
Periodos pequeños. Consideremos el cambio en algunas propiedades de los elementos y sus compuestos usando el ejemplo del período II (ver Tabla 3). En el segundo período, con un aumento en la carga positiva de los núcleos atómicos, hay un aumento constante en el número de electrones en el nivel externo, que está más alejado del núcleo atómico y, por lo tanto, se deforma fácilmente, lo que conduce a una rápida disminución. en el radio de los átomos. Esto explica el rápido debilitamiento de las propiedades metálicas y reductoras de los elementos, el fortalecimiento de las propiedades no metálicas y oxidantes, el aumento de las propiedades ácidas de los óxidos e hidróxidos y la disminución de las propiedades básicas. El período finaliza con un gas noble (Ne). En el tercer período, las propiedades de los elementos y sus compuestos cambian de la misma manera que en el segundo, ya que los átomos de los elementos de este período repiten las estructuras electrónicas de los átomos de los elementos del segundo período (3s- y 3p-subniveles)
Períodos largos (IV, V). En las filas pares de períodos grandes (IV, V), a partir del tercer elemento, hay un aumento constante en el número de electrones en el penúltimo nivel y la estructura del nivel exterior permanece sin cambios. El penúltimo nivel se sitúa más cerca del núcleo del átomo y por tanto se deforma en menor medida. Esto conduce a una disminución más lenta del radio de los átomos. Por ejemplo:
Una consecuencia del lento cambio en el radio de los átomos y del mismo número de electrones en el nivel exterior es una lenta disminución de las propiedades metálicas y reductoras de los elementos y sus compuestos. Así, en la fila par del período IV, K - Mn son metales activos, Fe - Ni son metales de actividad media (compárese con los elementos del período II, donde el tercer elemento, el boro, ya es un no metal).
Y a partir del grupo III de la serie impar, las propiedades de los elementos y sus compuestos cambian de la misma forma que en pequeños períodos, a medida que comienza a construirse el nivel externo. Por tanto, la estructura del nivel energético es decisiva en las propiedades de los elementos y sus compuestos. Cada período considerado también termina con un gas noble.
Habiendo considerado el cambio en algunas propiedades de los elementos y sus compuestos durante los períodos, podemos sacar las siguientes conclusiones:
1. Comienza cada período metal alcalino, y termina con un gas noble.
2. Las propiedades de los elementos y sus compuestos se repiten periódicamente porque las estructuras de los niveles de energía se repiten periódicamente. En este significado fisico ley periódica.
En los subgrupos principales, aumenta el número de niveles de energía, lo que conduce a un aumento de los radios atómicos. Por tanto, en los subgrupos principales (de arriba a abajo), la electronegatividad disminuye, aumentan las propiedades megalíticas y reductoras de los elementos, disminuyen las propiedades no metálicas y oxidantes, aumentan las propiedades básicas de óxidos e hidróxidos y disminuyen las propiedades ácidas. Por ejemplo, consideremos el subgrupo principal del grupo II.
Por tanto, las propiedades de un elemento y sus compuestos son intermedias entre dos elementos vecinos en términos de período y subgrupo.
Utilizando las coordenadas (número de período y número de grupo) de un elemento en el sistema periódico de D. I. Mendeleev, se puede determinar la estructura electrónica de su átomo y, por tanto, predecir sus propiedades principales.
1. número de niveles de electrones en un átomo define Periodo No., que contiene el elemento correspondiente.
2. Número total de electrones, ubicado en los orbitales s y p del nivel exterior (para elementos de los subgrupos principales) y en los orbitales d de los orbitales preexternos y s del nivel exterior (para elementos de los subgrupos laterales; excepciones:
define Número de grupo.
3. elementos f Están localizados ya sea en un subgrupo lateral del grupo III (opción a corto plazo), o entre los grupos IIA y IIIB (opción a largo plazo) - lantánidos(№ 57-70), actínidos(№ 89-102).
4. átomos elementos de diferentes épocas, pero un subgrupo tener estructura idéntica de niveles electrónicos externos y preexternos y, por tanto, tienen propiedades químicas similares.
5. Número máximo de oxidación de un elemento. coincide con el número del grupo en el que se encuentra el elemento. La naturaleza de los óxidos e hidróxidos formados por el elemento. depende de número oxidativo de elementos en ellos. Óxidos e hidróxidos en los que el elemento se encuentra en estado de oxidación:
Cómo mas grado oxidación del elemento formador de ácido, más pronunciadas son las propiedades ácidas de los óxidos e hidróxidos.
En consecuencia: los óxidos e hidróxidos de elementos de los grupos I-III son predominantemente anfóteros. Los óxidos e hidróxidos de elementos de los grupos IV-VII son predominantemente ácidos (en el grado máximo de oxidación). Los óxidos e hidróxidos de los mismos elementos, pero con menor estado de oxidación, pueden ser de diferente naturaleza.
6. Conexiones de elementos con hidrógeno puede ser dividido en 3 grandes grupos:
a) hidruros salinos de metales activos (LiH - ,CaH - y etc.);
b) compuestos de hidrógeno covalentes de elementos p (B 2 H 6, CH 4, NH 3, H 2 O, HF, etc.);
c) fases metálicas formadas por elementos d y f; estos últimos suelen ser compuestos no estequiométricos y, a menudo, es difícil decidir si clasificarlos como compuestos individuales o soluciones sólidas.
Los compuestos de hidrógeno de los elementos del grupo IV (CH 4 -metano, SiH 4 - silano) no interactúan con ácidos y bases y son prácticamente insolubles en agua.
Los compuestos de hidrógeno de los elementos del grupo V (NH 3 -amoníaco) forman bases cuando se disuelven en agua.
Los compuestos de hidrógeno de elementos de los grupos VI y VII (H 2 S, HF) forman ácidos cuando se disuelven en agua.
7. elementos del segundo período, en cuyos átomos se llena el segundo capa de electrones, son muy diferentes de todos los demás elementos. Esto se explica por el hecho de que la energía de los electrones en la segunda capa es significativamente menor que la energía de los electrones en las capas siguientes, y porque la segunda capa no puede contener más de ocho electrones.
8. Los elementos d del mismo período difieren menos entre sí que los elementos de los subgrupos principales en los que se forman las capas electrónicas exteriores.
9. Las diferencias en las propiedades de los lantánidos, en cuyos átomos se construye la capa f, que pertenece a la tercera capa exterior, son insignificantes.
cada periodo(a excepción del primero) comienza con un metal típico y termina con un gas noble, precedido por un no metal típico.
Cambiar las propiedades de los elementos dentro de un período:
1) debilitamiento de las propiedades metálicas;
2) disminuir el radio del átomo;
3) fortalecimiento de las propiedades oxidantes;
4) aumenta la energía de ionización;
5) aumenta la afinidad electrónica;
6) aumenta la electronegatividad;
7) aumentan las propiedades ácidas de los óxidos e hidróxidos;
8) a partir del grupo IV (para elementos p), aumenta la estabilidad de los compuestos de hidrógeno y aumentan sus propiedades ácidas.
Cambiar las propiedades de los elementos dentro de un grupo:
1) aumentan las propiedades metálicas;
2) el radio del átomo aumenta;
3) fortalecimiento de las propiedades reconstituyentes;
4) la energía de ionización disminuye;
5) la afinidad electrónica disminuye;
6) la electronegatividad disminuye;
7) aumentan las propiedades básicas de los óxidos e hidróxidos;
8) a partir del grupo IV (para elementos p), la estabilidad de los compuestos de hidrógeno disminuye y aumentan sus propiedades ácidas y oxidantes.
VALENCIA- la capacidad de los átomos de los elementos para formarse enlaces químicos. La valencia está determinada cuantitativamente por el número de electrones desapareados.
En 1852, el químico inglés Edward Frankland introdujo el concepto de fuerza conectora. Esta propiedad de los átomos pasó a denominarse posteriormente valencia.
![]() la valencia es 2 porque hay 2 electrones desapareados.
la valencia es 2 porque hay 2 electrones desapareados.
ESTADO DE OXIDACIÓN- la carga condicional de un átomo, que se calcula partiendo del supuesto de que la molécula está formada únicamente por iones.
A diferencia de la valencia, el número de oxidación tiene signo.
Estado de oxidación positivoigual al número de electrones extraídos (donados) de un átomo determinado. Un átomo puede ceder todos sus electrones desapareados.
Estado de oxidación negativoigual al número de electrones atraídos (unidos) a un átomo dado; sólo los no metales lo exhiben. Los átomos no metálicos añaden la cantidad de electrones necesarios para formar una configuración estable de ocho electrones del nivel exterior.
Por ejemplo: N-3; S-2; Cl-; C-4.
El patrón principal de este cambio es el fortalecimiento del carácter metálico de los elementos a medida que aumenta Z. Este patrón se manifiesta especialmente claramente en los subgrupos IIIa-VIIa. Para los metales de los subgrupos I A-III A, se observa un aumento en la actividad química. Para los elementos de los subgrupos IVA - VIIA, a medida que aumenta Z, se observa un debilitamiento de la actividad química de los elementos. Para los elementos del subgrupo b, el cambio en la actividad química es más complejo.
Teoría tabla periódica Fue desarrollado por N. Bohr y otros científicos en los años 20. Siglo XX y se basa en un esquema real para la formación de configuraciones electrónicas de átomos. Según esta teoría, a medida que aumenta Z, el llenado de las capas y subcapas de electrones en los átomos de los elementos incluidos en los períodos de la tabla periódica se produce en la siguiente secuencia:
Números de período
1 2 3 4 5 6 7
1s 2s2p 3s3p 4s3d4p 5s4d5p 6s4f5d6p 7s5f6d7p
Con base en la teoría del sistema periódico, se puede dar la siguiente definición de período: un período es un conjunto de elementos, comenzando con un elemento con valor n. igual al número del período, y l=0 (elementos s) y terminando con un elemento con el mismo valor n y l = 1 (elementos p) (ver Átomo). La excepción es el primer período, que contiene sólo 1s elementos. De la teoría del sistema periódico, el número de elementos en los períodos es el siguiente: 2, 8, 8. 18, 18, 32...
En la figura, los símbolos de los elementos de cada tipo (elementos s, p, d y f) están representados sobre un fondo de color específico: elementos s - en rojo, elementos p - en naranja, elementos d - en azul, elementos f - en verde. Cada celda muestra los números atómicos y las masas atómicas de los elementos, así como las configuraciones electrónicas de las capas electrónicas externas, que determinan principalmente las propiedades químicas de los elementos.
De la teoría del sistema periódico se deduce que los subgrupos a incluyen elementos con un número de período igual o igual a l = 0 y 1. Los subgrupos b incluyen aquellos elementos en cuyos átomos se completó la capa que anteriormente permaneció ocurre algo incompleto. Es por eso que el primer, segundo y tercer período no contienen elementos de los subgrupos b.
Estructura de la tabla periódica de elementos químicos. Está estrechamente relacionado con la estructura de los átomos de los elementos químicos. A medida que Z aumenta, periódicamente se repiten tipos similares de configuración de las capas electrónicas externas. Es decir, determinan las principales características del comportamiento químico de los elementos. Estas características se manifiestan de manera diferente para los elementos de los subgrupos A (elementos s y p), para los elementos de los subgrupos b (elementos d de transición) y para los elementos de las familias f: lantánidos y actínidos. Un caso especial lo representan los elementos del primer período: hidrógeno y helio. El hidrógeno es muy reactivo porque su único electrón b se elimina fácilmente. Al mismo tiempo, la configuración del helio (1º) es muy estable, lo que determina su completa inactividad química.
Para los elementos de los subgrupos A, las capas electrónicas externas están llenas (siendo n igual al número del período); por lo tanto, las propiedades de estos elementos cambian notablemente a medida que aumenta Z. Así, en el segundo período, el litio (configuración 2s) - metal activo, perdiendo fácilmente su único electrón de valencia; El berilio (2s~) también es un metal, pero menos activo debido a que sus electrones externos están más estrechamente unidos al núcleo. Además, el boro (23"p) tiene un carácter metálico débilmente expresado, y todos los elementos posteriores del segundo período, en el que se construye la subcapa 2p, ya son no metales. La configuración de ocho electrones de la capa electrónica externa del neón (2s~p~), un gas inerte, es muy duradero.
Propiedades químicas de los elementos del segundo período. se explican por el deseo de sus átomos de adquirir la configuración electrónica del gas inerte más cercano (configuración de helio para elementos que van del litio al carbono o configuración de neón para elementos del carbono al flúor). Esta es la razón por la que, por ejemplo, el oxígeno no puede presentar un estado de oxidación superior a su número de grupo: le resulta más fácil alcanzar la configuración de neón adquiriendo electrones adicionales. La misma naturaleza de los cambios en las propiedades se manifiesta en los elementos del tercer período y en los elementos s y p de todos los períodos posteriores. Al mismo tiempo, el debilitamiento de la fuerza del enlace entre los electrones externos y el núcleo en los subgrupos A a medida que aumenta Z se manifiesta en las propiedades de los elementos correspondientes. Por lo tanto, para los elementos s hay un aumento notable en la actividad química a medida que aumenta Z, y para los elementos p hay un aumento en las propiedades metálicas.
En los átomos de los elementos d de transición, se completan capas previamente incompletas con un valor de número cuántico principal y uno menos que el número de período. Con algunas excepciones, la configuración de las capas electrónicas externas de los átomos de los elementos de transición es ns. Por lo tanto, todos los elementos d son metales, y es por eso que los cambios en las propiedades de los elementos 1 a medida que Z aumenta no son tan dramáticos como vimos para los elementos s y p. En estados de oxidación superiores, los elementos d muestran cierta similitud con los elementos p de los grupos correspondientes de la tabla periódica.
Las peculiaridades de las propiedades de los elementos de las tríadas (subgrupo VIII b) se explican por el hecho de que las subcapas d están a punto de completarse. Esta es la razón por la que los metales de hierro, cobalto, níquel y platino generalmente no tienden a formar compuestos. grados superiores oxidación. Las únicas excepciones son el rutenio y el osmio, que dan los óxidos RuO4 y OsO4. Para elementos de los subgrupos B I y II, el subnivel d está realmente completo. Por tanto, presentan estados de oxidación iguales al número de grupo.
En los átomos de lantánidos y actínidos (todos ellos son metales), las capas electrónicas previamente incompletas se completan con un valor del número cuántico principal y dos unidades menor que el número de período. En los átomos de estos elementos, la configuración de la capa electrónica externa (ns2) permanece sin cambios. Al mismo tiempo, los electrones f en realidad no tienen ningún efecto sobre las propiedades químicas. Por eso los lantánidos son tan similares.
Para los actínidos la situación es mucho más complicada. En el rango de cargas nucleares Z = 90 - 95 electrones bd y 5/ pueden participar en interacciones químicas. De esto se deduce que los actínidos presentan una gama mucho más amplia de estados de oxidación. Por ejemplo, para el neptunio, el plutonio y el americio, se conocen compuestos en los que estos elementos aparecen en el estado de siete valencias. Sólo para los elementos que comienzan con curio (Z = 96) el estado trivalente se vuelve estable. Por tanto, las propiedades de los actínidos difieren significativamente de las propiedades de los lantánidos y, por tanto, las dos familias no pueden considerarse similares.
La familia de actínidos termina con el elemento Z = 103 (lawrencio). Una evaluación de las propiedades químicas del kurchatovium (Z = 104) y el nilsborium (Z = 105) muestra que estos elementos deberían ser análogos del hafnio y el tantalio, respectivamente. Por lo tanto, los científicos creen que después de la familia de los actínidos en los átomos, comienza el llenado sistemático de la subcapa 6d.
Se desconoce el número final de elementos que abarca la tabla periódica. El problema de su límite superior es quizás el principal misterio de la tabla periódica. El elemento más pesado que se ha descubierto en la naturaleza es el plutonio (Z = 94). Se ha alcanzado el límite de la fusión nuclear artificial: elemento con número atómico 107. Queda pregunta abierta: ¿será posible obtener elementos con números de serie grandes, cuáles y cuántos? Esto todavía no puede responderse con certeza.
1. ¿Qué estudia la informática?
Tecnologías informáticas
la información es intangible
proceso.
oler
sonido
habla humana
gusto
fotos
cifrado
transferencia de información
almacenamiento de datos
clasificación de listas
búsqueda de base de datos
6. ¿Qué es la codificación?
herramienta de búsqueda de información
tergiversación
cambiando el tipo de información
Prueba sobre el tema: "Información y procesos de información"
1. ¿Qué estudia la informática?
cualquier proceso y fenómeno relacionado con la información.
programación de computadoras
relación entre fenómenos naturales
Tecnologías informáticas
métodos matemáticos para resolver problemas
2. Marque todas las afirmaciones correctas.
la información es intangible
La información es un reflejo del mundo real.
la información caracteriza la diversidad
al recibir información, la incertidumbre del conocimiento disminuye
Hay una definición estricta de información.
3. Marque los tipos de información que la computadora aún no puede hacer.
proceso.
oler
sonido
habla humana
gusto
fotos
4. Seleccionar procesos que puedan denominarse procesamiento de información.
cifrado
transferencia de información
almacenamiento de datos
clasificación de listas
búsqueda de base de datos
5. Marque todas las afirmaciones correctas.
La información sólo puede existir junto con el transportista.
El almacenamiento de información es uno de los procesos de información.
Para extraer información de un mensaje, una persona utiliza el conocimiento.
El procesamiento de la información es un cambio en su contenido.
Al grabar información, las propiedades de los medios cambian.
6. ¿Qué es la codificación?
herramienta de búsqueda de información
registrar información en otro sistema de signos
tergiversación
cambiando el tipo de información
cambio en la cantidad de información
selección de elementos requeridos
cambiando el orden de los elementos
eliminando elementos innecesarios
para transmitir información?
principios?
_______________________________________________________________
resolviendo algunos problemas?
_______________________________________________________________
¿a ti mismo?
_______________________________________________________________
sistemas?
_______________________________________________________________
7. ¿Qué frase puede servir como definición de clasificación?
selección de elementos requeridos
organizar los elementos de la lista en un orden determinado
orden alfabético de líneas
cambiando el orden de los elementos
eliminando elementos innecesarios
8. ¿Cómo se llama el cambio en las propiedades de los medios que se utiliza?
para transmitir información?
_______________________________________________________________
9. ¿Cómo se llama el conocimiento que representa hechos, leyes,
principios?
_______________________________________________________________
10. ¿Cómo se llama el conocimiento que representa los algoritmos?
resolviendo algunos problemas?
_______________________________________________________________
11. ¿Cómo se llaman las ideas que las personas tienen sobre la naturaleza, la sociedad y ellos mismos?
¿a ti mismo?
_______________________________________________________________
12. Marque todas las afirmaciones correctas.
La información recibida depende del conocimiento del destinatario.
la información recibida depende sólo del mensaje recibido
obtener información siempre aumenta el conocimiento
El conocimiento aumenta sólo cuando la información recibida se conoce parcialmente.
La misma información se puede presentar en diferentes formas.
13. ¿Cómo se llama la información registrada (codificada) en
alguna forma, en particular en información informática
sistemas?
_______________________________________________________________
Respuesta:
1
2
3
4
5
6
7
a, b, d
a B C D
a, d
agregar
a, c, d
b, d
8
9
10
11
12
13
señal
declarativo
procesal
conocimiento
agregar
- En contacto con 0
- Google+ 0
- DE ACUERDO 0
- Facebook 0