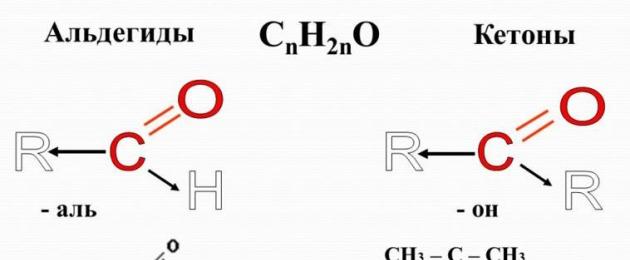
Альдегиды
– органические вещества, молекулы которых содержат карбонильную группу С=O
, соединенную с атомом водорода и углеводородным радикалом.
Альдегиды
– органические вещества, молекулы которых содержат карбонильную группу С=O
, соединенную с атомом водорода и углеводородным радикалом.
Общая формула альдегидов имеет вид:

В простейшем альдегиде – формальдегиде роль углеводородного радикала играет другой атом водорода:

Карбонильную группу, связанную с атомом водорода, часто называют альдегидной:
Кетоны – органические вещества, в молекулах которых карбонильная группа связана с двумя углеводородными радикалами. Очевидно, общая формула кетонов имеет вид:

Карбонильную группу кетонов называют кетогруппой
.
В простейшем кетоне – ацетоне – карбонильная группа связана с двумя метильными радикалами:

Номенклатура и изомерия альдегидов и кетонов
В зависимости от строения углеводородного радикала, связного с альдегидной группой, различают предельные, непредельные, ароматические, гетероциклические и другие альдегиды:

В соответствии с номенклатурой ИЮПАК названия предельных альдегидов образуются от названия алкана с тем же числом атомов углерода в молекуле с помощью суффикса -аль. Например:

Нумерацию атомов углерода главной цепи начинают с атома углерода альдегидной группы. Поэтому альдегидная группа всегда располагается при первом атоме углерода, и указывать ее положение нет необходимости.
Наряду с систематической номенклатурой используют и тривиальные названия широко применяемых альдегидов. Эти названия, как правило, образованы от названий карбоновых кислот, соответствующих альдегидам.
Для названия кетонов по систематической номенклатуре кетогруппу обозначают суффиксом -он и цифрой, которая указывает номер атома углерода карбонильной группы (нумерацию следует начинать от ближайшего к кетогруппе конца цепи). Например:
Для альдегидов характерен только один вид структурной изомерии - изомерия углеродного скелета, которая возможна с бутаналя, а для кетонов также и изомерия положения карбонильной группы. Кроме этого, для них характерна и межклассовая изомерия (пропаналь и пропанон).

Физические свойства альдегидов
В молекуле альдегида или кетона вследствие большей электороотрицательности атома кислорода по сравнению с углеродным атомом связь С=O сильно поляризована за счет смещения электронной плотности π -связи к кислороду:

Альдегиды и кетоны - полярные вещества с избыточной электронной плотностью на атоме кислорода. Низшие члены ряда альдегидов и кетонов (формальдегид, уксусный альдегид, ацетон) растворимы в воде неограниченно. Их температуры кипения ниже, чем у соответствующих спиртов. Это связано с тем, что в молекулах альдегидов и кетонов в отличие от спиртов нет подвижных атомов водорода и они не образуют ассоциатов за счет водородных связей. Низшие альдегиды имеют резкий запах; у альдегидов, содержащих от четырех до шести атомов углерода в цепи, неприятный запах; высшие альдегиды и кетоны обладают цветочными запахами и применяются в парфюмерии.

Химические свойства альдегидов и кетонов
Наличие альдегидной группы в молекуле определяет характерные свойства альдегидов.
1. Реакции восстановления .
Присоединение водорода к молекулам альдегидов происходит по двойной связи в карбонильной группе. Продуктом гидрирования альдегидов являются первичные спирты, кетонов - вторичные спирты. Так, при гидрировании уксусного альдегида на никелевом катализаторе образуется этиловый спирт, при гидрировании ацетона - пропанол-2.

Гидрирование альдегидов - реакция восстановления, при которой понижается степень окисления атома углерода, входящего в карбонильную группу.
2. Реакции окисления . Альдегиды способны не только восстанавливаться, но и окисляться . При окислении альдегиды образуют карбоновые кислоты.
Окисление кислородом воздуха . Например, из пропионового альдегида (пропаналя) образуется пропионовая кислота:

Окисление слабыми окислителями (аммиачный раствор оксида серебра).

Если поверхность сосуда, в котором проводится реакция, была предварительно обезжирена, то образующееся в ходе реакции серебро покрывает ее тонкой ровной пленкой. Получается замечательное серебряное зеркало. Поэтому эту реакцию называют реакцией «серебряного зеркала». Ее широко используют для изготовления зеркал, серебрения украшений и елочных игрушек.
3. Реакция полимеризации:
n СH 2 =O → (-CH 2 -O-) n параформ n=8-12
Получение альдегидов и кетонов

Применение альдегидов и кетонов
Формальдегид
(метаналь, муравьиный альдегид) H 2 C=O:
а) для получение фенолформальдегидных смол;
б) получение мочевино-формальдегидных (карбамидных) смол;
в) полиоксиметиленовые полимеры;
г) синтез лекарственных средств (уротропин);
д) дезинфицирующее средство;
е) консервант биологических препаратов (благодаря способности свертывать белок).
Уксусный альдегид
(этаналь, ацетальдегид) СН 3 СН=О:
а) производство уксусной кислоты;
б) органический синтез.
Ацетон
СН 3 -СО-СН 3:
а) растворитель лаков, красок, ацетатов целлюлозы;
б) сырье для синтеза различных органических веществ.
Уксусный альдегид имеет химическую формулу CH3COH. На вид он бесцветный, прозрачный, с резким запахом, может кипеть уже при комнатной температуре 20°C, с легкостью растворяется в воде и органических соединениях. Так как наука не стоит на месте, то сейчас получить уксусный альдегид из этилового спирта довольно просто.
Природа двух основных веществ

Ацетальдегид (этаналь) распространен в природе, встречается в продуктах и в большинстве растений. А также этаналь является составляющей автомобильных выхлопов и дыма от сигарет, поэтому он относится к категории сильных ядовитых веществ. Его можно синтезировать искусственно разными способами. Самый популярный метод – получить уксусный альдегид из этилового спирта. В качестве катализатора используют оксид меди (или серебра). В результате реакции получаются альдегид, водород и вода.
Этиловый спирт (этанол) представляет собой обычный всем известный пищевой C2H5OH. Он широко применяется в изготовлении алкогольных напитков, в медицине для дезинфекции, при производстве бытовой химии, духов, средств гигиены и прочего.
Этиловый спирт в природе не встречается, его производят с помощью химических реакций. Основные способы получения вещества следующие:

- Брожение: определенные фрукты или овощи подвергают действию дрожжевого грибка.
- Изготовление в промышленных условиях (применение серной кислоты).
Второй способ дает более высокую концентрацию этанола. С помощью первого варианта получится достичь только около 16% этого вещества.
Способы получения ацетальдегида из этанола
Процесс получения ацетальдегида из этилового спирта происходит по следующей формуле: C2H5OH + CuO = CH3CHO + Cu + H2O
В данном случае используют этанол и оксид меди, под воздействием высокой температуры происходит реакция окисления и получается уксусный альдегид.
Существует также другой метод получения альдегида – дегидрирование спирта. Он появился еще около 60 лет назад и пользуется популярностью до сих пор. Дегидрирование имеет множество положительных качеств:

- нет выделений ядовитых токсинов, отравляющих атмосферу;
- комфортные и безопасные условия реакции;
- в процессе реакции выделяется водород, который тоже можно использовать;
- не нужно тратиться на дополнительные составляющие – достаточно одного этилового спирта.
Получение альдегида данным методом происходит так: этанол нагревают до четырехсот градусов и каталитическим способом из него выходит водород. Формула процесса выглядит так: C2H5OH ͢ CH3CHO + H2.
Отщепление водорода происходит благодаря высокой температуре и низкому давлению. Как только температура упадет, а давление возрастет, H2 вернется и ацетальдегид снова станет спиртом.
При использовании метода дегидратации применяют также медный или цинковый катализатор. Медь в данном случае - очень активное вещество, способное терять активность во время реакции. Поэтому делают смесь из меди, оксидов кобальта и хрома, а затем наносят ее на асбест. Это дает возможность провести реакцию при температуре 270–300°C. В этом случае трансформация этанола достигает от 34 до 50%.
Определение оптимального метода

Если сравнивать метод окисления спирта с методом дегидратации, то второй обладает явным преимуществом, так как при нем образуется намного меньше токсических веществ и одновременно фиксируется наличие в контактных газах высокой концентрации этаналя. Эти газы при дегидратации содержат лишь ацетальдегид и водород, а при окислении имеют в составе разбавленный азотом этанол. Поэтому получить ацетальдегид из контактных газов легче и потерь его будет намного меньше, чем при окислительном процессе.

Еще одним важным качеством метода дегидратации является то, что полученное вещество применяют для производства уксусной кислоты. Для этого берут сульфат ртути и воду. Получается реакция по следующей схеме: CH3CHO + HgSO4 + H2O = CH3COOH + H2SO4 + Hg.
Для завершения реакции добавляют сульфат железа, который окисляет ртуть. Чтобы выделить уксусную кислоту, полученный раствор фильтруют и добавляют щелочной раствор.
Если нет готового HgSO4 (неорганическое соединение из соли металла и серной кислоты), то его готовят самостоятельно. Необходимо в 4 части серной кислоты добавить 1 часть оксида ртути.
Дополнительный способ

Существует еще один способ получения уксусного альдегида. Его используют для определения качества полученного спирта. Для его реализации потребуются: фуксинсернистая кислота, этиловый спирт и хромовая смесь (K2Cr2O7 + H2SO4).
В сухую склянку вливают хромовую смесь (2 мл), кладут кипятильный камень и добавляют этиловый спирт (2 мл). Пробирку накрывают трубкой для отвода газов и вставляют другой конец в емкость с фуксинсернистой кислотой. Смесь нагревают, в результате она меняет свой цвет на зеленый. В процессе реакции этанол окисляется и превращается в ацетальдегид, который в виде паров идет по трубке и, попадая в пробирку с фуксинсернистой кислотой, окрашивает ее в малиновый цвет.
УКСУСНЫЙ АЛЬДЕГИД (ацетальдегид, этаналь ) - алифатический альдегид, CH 3 CHO; метаболит, образующийся при спиртовом брожении, окислении этилового спирта, в т. ч. в организме человека, и в других обменных реакциях. У. а. используют при получении различных лекарственных средств (см.), уксусной кислоты (см.), надуксусной к-ты CH 3 COOOH, уксусного ангидрида (CH 3 CO) 2 O, этилацетата, а также в производстве синтетических смол и др. На соответствующих производствах представляет собой профессиональную вредность.
У. а. представляет собой бесцветную жидкость с резким запахом, t° пл -123,5°, t° кип 20,2°, его относительная плотность при 20° 0,783, коэффициент преломления при 20° 1,3316, концентрационные пределы взрываемости (КПВ) 3,97 - 57%. С водой, этиловым спиртом, эфиром и другими органическими растворителями У. а. смешивается в любых соотношениях.
У. а. вступает во все реакции, характерные для альдегидов (см.), в частности он окисляется до уксусной к-ты, претерпевает альдольную и кротоновую конденсации, образует уксусно-этиловый эфир по реакции Тищенко и характерные для альдегидов производные по карбонильной группе. В присутствии кислот У. а. полимеризуется до циклического кристаллического тетрамера метальдегида или жидкого паральдегида. В промышленном масштабе У. а. получают гидратацией ацетилена (см.) в присутствии катализаторов - солей ртути, окислением этилового спирта (см.) и наиболее экономичным способом - окислением этилена (см. Углеводороды) в присутствии палладиевого катализатора.
Качественное обнаружение У. а. основано на появлении синего окрашивания в результате взаимодействия У. а. с нитропруссидом натрия в присутствии аминов. Количественное определение состоит в получении какого-либо производного У. а. по карбонильной группе и его весового, объемного (см. Титриметрический анализ) или колориметрического определения (см. Колориметрия).
Образование У. а. как промежуточного продукта обмена веществ происходит как в растительных, так и в животных организмах. Первой стадией превращения этилового спирта в организме человека и животных является его окисление до У. а. в присутствии алкоголь-дегидрогеназы (см.). У. а. образуется также при декарбоксилировании (см.) пирувата (см. Пировиноградная кислота) при спиртовом брожении и при расщеплении треонина (см.) под действием треонин-альдолазы (КФ 4.1.2.5). В организме человека У. а. окисляется до уксусной к-ты гл. обр. в печени под действием НАД-зависимой альдегидоксидазы (КФ 1.2.3. 1), ацетальдегидооксидазы и ксантокиназы. У. а. участвует в биосинтезе треонина из глицина (см.). В наркол. практике применение те ту рама (см.) основано на способности этого препарата специфически блокировать ацетальдегид-оксидазу, что приводит к накоплению в крови У. а. и, как следствие, к сильной вегетативной реакции - расширению периферических сосудов, сердцебиению, головной боли, удушью, тошноте.
Уксусный альдегид как профессиональная вредность
При хрон. воздействии на человека невысоких концентраций паров У. а. отмечают преходящее раздражение слизистых оболочек верхних дыхательных путей и конъюнктивы. Пары У. а. во вдыхаемом воздухе в высоких концентрациях вызывают учащение пульса, повышенную потливость; признаки резкого раздражающего действия паров У. а. в этих случаях усиливаются (особенно ночью) и могут сочетаться с удушьем, сухим болезненным кашлем, головной болью. Последствием такого отравления бывают бронхит и пневмония.
Попадание на кожу жидкого У. а. может вызывать ее гиперемию и появление инфильтратов.
Первая помощь и неотложная терапия
При отравлении парами У. а. пострадавшего необходимо вывести на свежий воздух, обеспечить ингаляцию водяного пара с нашатырным спиртом, при показаниях - ингаляции увлажненного кислорода, сердечные средства, стимуляторы дыхания (лобелин, цитотон), настойка валерианы, препараты брома. При резком раздражении слизистых оболочек дыхательных путей - щелочные или масляные ингаляции. При болезненном кашле - кодеин, этил-морфина гидрохлорид (дионин), горчичники, банки. При раздражении конъюнктивы - обильное промывание глаз водой или изотоническим р-ром хлорида натрия. При отравлении через рот - немедленное промывание желудка водой с добавлением р-ра аммиака (нашатырного спирта), 3% р-ром гидрокарбоната натрия. Дальнейшее лечение - симптоматическое. При попадании У. а. на кожу - немедленное обмывание пораженного участка водой, но лучше 5% р-ром нашатырного спирта.
Пострадавший должен быть отстранен от работы с вредными веществами до выздоровления (см. Профессиональные болезни).
Меры профилактики интоксикаций У. а. заключаются в герметизации оборудования, безотказной работе вентиляции (см.), механизации и автоматизации работ по розливу и транспортировке У. а. Хранить У. а. необходимо в герметически закупоренных сосудах. На производствах и в лабораториях, связанных с контактом с У. а., должны неукоснительно соблюдаться меры личной гигиены, пользование специальной одеждой и обувью, защитными очками, универсальными респираторами.
Предельно допустимая концентрация паров У. а. в воздухе рабочей зоны 5 мг/м 3 .
Библиогр.: Вредные вещества в промышленности, под ред. Н. В. Лазарева и Э. Н. Левиной, т. 1, Л., 1976; Лебедев Н. Н. Химия и технология основного органического и нефтехимического синтеза, М., 1981; Уайт А. и др. Основы биохимии, пер. с англ., т. 1-3, М., 1981,
А. Н. Климов, Д. В. Иоффе; Н. Г. Будковская (гиг.).,
Уксусный альдегид относится к органическим соединениям и входит в класс альдегидов. Какими свойствами обладает это вещество, и как выглядит формула уксусного альдегида?
Общая характеристика
Уксусный альдегид имеет несколько названий: ацетальдегид, этаналь, метилформальдегид. Это соединение является альдегидом уксусной кислоты и этанола. Его структурная формула выглядит следующим образом: CH 3 -CHO.

Рис. 1. Химическая формула уксусного альдегида.
Особенностью этого альдегида является то, что он встречается как в природе, так и производится искусственным путем. В промышленности объем производства этого вещества может составлять до 1 миллиона тонн в год.
Этаналь встречается в пищевых продуктах, таких как кофе, хлеб, а также это вещество синтезируют растения в процессе метаболизма.
Уксусный альдегид представляет собой жидкость без цвета, но отличающуюся резким запахом. Растворим в воде, спирте и эфире. Является ядовитым.

Рис. 2. Уксусный альдегид.
Жидкость закипает при достаточно низкой температуре – 20,2 градуса по Цельсию. Из-за этого возникают проблемы с ее хранением и транспортировкой. Поэтому хранят вещество в виде паральдегида, а ацетальдегид из него получают в случае необходимости путем нагревания с серной кислотой (либо с любой другой минеральной кислотой). Паральдегид – это циклический тример уксусной кислоты.
Способы получения
Получить уксусный альдегид можно несколькими способами. Самый распространенный вариант – окисление этилена или, как еще называют этот способ, процесс Вакера:
2CH 2 =CH 2 +O 2 —2CH 3 CHO
Окислителем в данной реакции выступает хлорид палладия.
Также уксусный альдегид можно получить пр взаимодействии ацетилена с солями ртути. Данная реакция носит имя русского ученого и называется реакцией Кучерова. В результате химического процесса образуется енол, который изомеризуется в альдегид
C 2 H 2 +H 2 O=CH 3 CHO

Рис. 3. М. Г. Кучеров портрет.
ОПРЕДЕЛЕНИЕ
Альдегиды – органические вещества, относящиеся к классу карбонильных соединений, содержащих в своем составе функциональную группу –СН = О, которая называется карбонильной.
Общая формула предельных альдегидов и кетонов C n H 2 n O. В названии альдегидов присутствует суффикс –аль.
Простейшие представители альдегидов – формальдегид (муравьиный альдегид) –СН 2 = О, ацетальдегид (уксусный альдегид) – СН 3 -СН = О. Существуют циклические альдегиды, например, циклогексан-карбальдегид; ароматические альдегиды имеют тривиальные названия – бензальдегид, ванилин.
Атом углерода в карбонильной группе находится в состоянии sp 2 -гибридизации и образует 3σ-связи (две связи С-Н и одну связь С-О). π-связь образована р-электронами атомов углерода и кислорода. Двойная связь С = О является сочетанием σ- и π-связей. Электронная плотность смещена в сторону атома кислорода.
Для альдегидов характерна изомерия углеродного скелета, а также межклассовая изомерия с кетонами:
СН 3 -СН 2 -СН 2 -СН = О (бутаналь);
СН 3 -СН(СН 3)-СН = О (2-метилпентаналь);
СН 3 -С(СН 2 -СН 3) = О (метилэтилкетон).
Химические свойства альдегидов
В молекулах альдегидов имеется несколько реакционных центров: электрофильный центр (карбонильный атом углерода), участвующий в реакциях нуклеофильного присоединения; основный центр – атом кислорода с неподеленными электронными парами; α-СН кислотный центр, отвечающий за реакции конденсации; связь С-Н, разрывающаяся в реакциях окисления.
1. Реакции присоединения:
— воды с образованием гем-диолов
R-CH = O + H 2 O ↔ R-CH(OH)-OH;
— спиртов с образованием полуацеталей
CH 3 -CH = O + C 2 H 5 OH ↔CH 3 -CH(OH)-O-C 2 H 5 ;
— тиолов с образованием дитиоацеталей (в кислой среде)
CH 3 -CH = O + C 2 H 5 SH ↔ CH 3 -CH(SC 2 H 5)-SC 2 H 5 + H 2 O;
— гидросульфита натрия с образованием α-гидроксисульфонатов натрия
C 2 H 5 -CH = O + NaHSO 3 ↔ C 2 H 5 -CH(OH)-SO 3 Na;
— аминов с образованием N-замещенных иминов (основания Шиффа)
C 6 H 5 CH = O + H 2 NC 6 H 5 ↔ C 6 H 5 CH = NC 6 H 5 + H 2 O;
— гидразинов с образованием гидразонов
CH 3 -CH = O + 2 HN-NH 2 ↔ CH 3 -CH = N-NH 2 + H 2 O;
— циановодородной кислоты с образованием нитрилов
CH 3 -CH = O + HCN ↔ CH 3 -CH(N)-OH;
— восстановление. При взаимодействии альдегидов с водородом получаются первичные спирты:
R-CH = O + H 2 → R-CH 2 -OH;
2. Окисление
— реакция «серебряного зеркала» — окисление альдегидов аммиачным раствором оксида серебра
R-CH = O + Ag 2 O → R-CO-OH + 2Ag↓;
— окисление альдегидов гидроксидом меди (II), в результате которого выпадает осадок оксида меди (I) красного цвета
CH 3 -CH = O + 2Cu(OH) 2 → CH 3 -COOH + Cu 2 O↓ + 2H 2 O;
Эти реакции являются качественными реакциями на альдегиды.
Физические свойства альдегидов
Первый представитель гомологического ряда альдегидов – формальдегид (муравьиный альдегид) – газообразное вещество (н.у.), альдегиды неразветвленного строения и состава С 2 -С 12 – жидкости, С 13 и длиннее – твердые вещества. Чем больше атомов углерода входит в состав неразветвленного альдегида, тем выше его температура кипения. С увеличением молекулярной массы альдегидов увеличиваются значения величин их вязкости, плотности и показателя преломления. Формальдегид и ацетальдегид способны смешиваться с водой в неограниченных количествах, однако, с ростом углеводородной цепи эта способность альдегидов снижается. Низшие альдегиды обладают резким запахом.
Получение альдегидов
Основные способы получения альдегидов:
— гидроформилирование алкенов. Эта реакция заключается в присоединении СО и водорода к алкену в присутствии карбонилов некоторых металлов VIII группы, например, октакарбонилдикобальта (Cо 2 (СО) 8) Реакция проводится при нагревании до 130С и давлении 300 атм
СН 3 -СН = СН 2 + СО +Н 2 →СН 3 -СН 2 -СН 2 -СН = О + (СН 3) 2 СНСН = О;
— гидратация алкинов. Взаимодействие алкинов с водой происходит в присутствии солей ртути (II) и в кислой среде:
НС≡СН + Н 2 О → СН 3 -СН = О;
— окисление первичных спиртов (реакция протекает при нагревании)
СН 3 -СН 2 -ОН + CuO → CH 3 -CH = O + Cu + H 2 O.
Применение альдегидов
Альдегиды нашли широкое применение в качестве сырья для синтеза различных продуктов. Так, из формальдегида (крупнотоннажное производство) получают различные смолы (фенол-формальдегидные и т.д.), лекарственные препараты (уротропин); ацетальдегид — сырье для синтеза уксусной кислоты, этанола, различных производных пиридина и т.д. Многие альдегиды (масляный, коричный и др.) используют в качестве ингредиентов в парфюмерии.
Примеры решения задач
ПРИМЕР 1
| Задание | Бромированием С n H 2 n +2 получили 9,5 г монобромида, который при обработке разбавленным раствором NaOH превратился в кислородсодержащее соединение. Пары его с воздухом пропущены над раскаленной медной сеткой. При обработке образовавшегося при этом нового газообразного вещества избытком аммиачного раствора Ag 2 O выделилось 43,2 г осадка. Какой углеводород был взят и в каком количестве, если выход на стадии бромирования 50%, остальные реакции протекают количественно. |
| Решение |
Запишем уравнения всех протекающих реакций:
C n H 2n+2 + Br 2 = C n H 2n+1 Br + HBr; C n H 2n+1 Br + NaOH = C n H 2n+1 OH + NaBr; C n H 2n+1 OH → R-CH = O; R-CH = O + Ag 2 O → R-CO-OH + 2Ag↓. Осадок выделившийся в последней реакции – это серебро, следовательно, можно найти количество вещества выделившегося серебра: M(Ag) = 108 г/моль; v(Ag) = m/M = 43,2/108 = 0,4 моль. По условию задачи, после пропускания вещества полученного в реакции 2 над раскаленной металлической сеткой образовался газ, а единственный газ –альдегид – это метаналь, следовательно, исходное вещество – это метан. CH 4 + Br 2 = CH 3 Br + HBr. Количество вещества бромметана: v(CH 3 Br) = m/M = 9,5/95 = 0,1 моль. Тогда, количество вещества метана, необходимое для 50% выхода бромметана – 0,2 моль. М(CH 4) = 16 г/моль. Следовательно масса и объем метана: m(CH 4) = 0,2×16 = 3,2 г; V(CH 4) = 0,2×22,4 = 4,48 л. |
| Ответ | Масса метана — масса 3,2 г, объем метана-4,48 л |
ПРИМЕР 2
| Задание | Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения: бутен-1 → 1-бромбутан + NaOH → А – Н 2 → В + OH → С + HCl → D. |
| Решение |
Для получения 1-бромбутана из бутена-1 необходимо провести реакцию гидробромирования в присутствии пероксидных соединений R 2 O 2
(реакция протекает против правила Марковникова):
CH 3 -CH 2 -CH = CH 2 + HBr → CH 3 -CH 2 -CH 2 -CH 2 Br. При взаимодействии с водным раствором щелочи 1-бромбутан подвергается гидролизу с образованием бутанола-1 (А): CH 3 -CH 2 -CH 2 -CH 2 Br + NaOH → CH 3 -CH 2 -CH 2 -CH 2 OH + NaBr. Бутанол-1 при дегидрировании образует альдегид – бутаналь (В): CH 3 -CH 2 -CH 2 -CH 2 OH → CH 3 -CH 2 -CH 2 -CH = О. Аммиачный раствор оксида серебра окисляет бутаналь до аммонийной соли – бутирата аммония (С): CH 3 -CH 2 -CH 2 -CH = О + OH →CH 3 -CH 2 -CH 2 -COONH 4 + 3NH 3 + 2Ag↓ +H 2 O. Бутират аммония при взаимодействии с соляной кислотой образует масляную (бутановую) кислоту (D): CH 3 -CH 2 -CH 2 -COONH 4 + HCl → CH 3 -CH 2 -CH 2 -COOH + NH 4 Cl. |