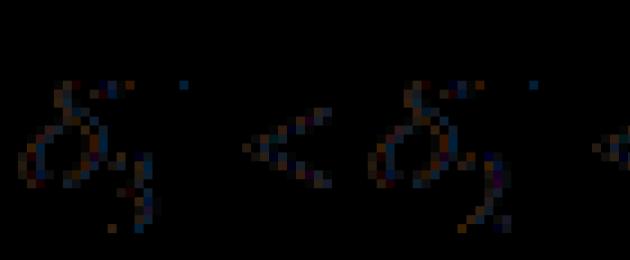Una molecola di composto organico è un insieme di atomi collegati in un ordine specifico, solitamente da legami covalenti. In questo caso, gli atomi legati possono differire in grandezza elettronegatività... Le quantità elettronegatività in larga misura determinano caratteristiche così importanti del legame come polarità e forza (energia di formazione). A loro volta, la polarità e la forza dei legami in una molecola, in larga misura, determinano la capacità di una molecola di entrare in determinate reazioni chimiche.
elettronegativitàl'atomo di carbonio dipende dallo stato della sua ibridazione. Ciò è dovuto alla condivisione S - orbitali in un orbitale ibrido: è più piccolo per sp 3 - e altro per sp 2 - e sp -atomi ibridi.
Tutti gli atomi che costituiscono una molecola sono interconnessi e sperimentano un'influenza reciproca. Tale influenza si trasmette principalmente attraverso il sistema dei legami covalenti, utilizzando il cosiddetto effetti elettronici.
Effetti elettronici chiamato spostamento della densità elettronica nella molecola sotto l'influenza dei sostituenti ./>
Gli atomi legati polarmente portano cariche parziali, indicate dalla lettera greca delta ( D ). L'atomo "tira via" la densità elettronicaS -connessione nella sua direzione, acquisisce una carica negativa D -. Quando si considera una coppia di atomi legati da un legame covalente, viene chiamato l'atomo più elettronegativo accettore di elettroni... Il suo partner in S -i legami avranno di conseguenza un uguale deficit di densità elettronica, cioè parziale positivo caricare D + sarà chiamato donatore di elettroni.
Compensazione della densità elettronica lungo il circuitoS -legami chiamati effetto induttivo e denotato IO.
L'effetto induttivo viene trasmesso lungo il circuito con smorzamento. La direzione dello spostamento della densità elettronica di tuttiS -i collegamenti sono indicati da frecce diritte.
A seconda che la densità elettronica si allontani dall'atomo di carbonio considerato o si avvicini ad esso, l'effetto induttivo è chiamato negativo (- io ) o positivo (+ I). Il segno e la grandezza dell'effetto induttivo sono determinati dalle differenze in elettronegatività tra l'atomo di carbonio in questione e il gruppo che lo causa.
Sostituenti attrattori di elettroni, ad es. atomo o gruppo di atomi che spostano la densità elettronicaS -legami da un atomo di carbonio a se stessi, mostra effetto induttivo negativo (- I-effetto).
Elettrodonatoresostituenti, cioè un atomo o un gruppo di atomi che spostano la densità elettronica verso l'atomo di carbonio lontano da se stesso, mostra effetto induttivo positivo(+ effetto I).
L'effetto I si manifesta con radicali idrocarburici alifatici, ad es. radicali alchilici (metile, etile, ecc.). La maggior parte dei gruppi funzionali esibisce - io -effetto: alogeni, gruppo amminico, gruppi ossidrile, carbonilico, carbossilico.
L'effetto induttivo si manifesta anche nel caso in cui gli atomi di carbonio legati differiscano nello stato di ibridazione.
Quando l'effetto induttivo del gruppo metallico viene trasferito al doppio legame, prima di tutto, la sua influenza è sperimentata dal mobileP - connessione.
Effetto di un sostituente sulla distribuzione della densità elettronica trasmessa suP -le connessioni sono chiamate effetto mesomerico (M). L'effetto mesomerico può anche essere negativo e positivo. Nelle formule strutturali, è rappresentato come una freccia curva che inizia al centro della densità elettronica e termina nel punto in cui viene spostata la densità elettronica.
La presenza di effetti elettronici porta ad una ridistribuzione della densità elettronica nella molecola e alla comparsa di cariche parziali sui singoli atomi. Questo determina la reattività della molecola.
Secondo i concetti moderni, la natura e il meccanismo dell'influenza reciproca degli atomi sono determinati dalla natura della distribuzione della densità elettronica nella molecola e dalla polarizzabilità dei legami covalenti.
La miscelazione elettronica nei composti organici è divisa in due tipi: effetto induttivo - miscelazione della densità elettronica lungo la catena di legami ed effetto mesomerico - spostamento lungo il sistema di legami .
Effetto induttivo. Considerando i tipi di legami chimici, abbiamo notato che tra atomi con la stessa elettronegatività, una coppia di elettroni di legame appartiene ugualmente ad entrambi i partecipanti al legame (legame covalente non polare). Ad esempio, i legami nelle molecole di metano e butano sono non polari, la densità elettronica in essi è distribuita simmetricamente e la molecola non ha momento di dipolo. Se nella molecola del butano un atomo di idrogeno viene sostituito da alogeno - cloro, la densità elettronica del legame covalente C-Cl si mescolerà a un atomo di cloro più elettronegativo (legame polare covalente):
La coppia di elettroni del legame a appartiene sia al carbonio che al cloro, ma è in qualche modo mescolata con il cloro, quindi il cloro acquisisce una carica parzialmente negativa (δ -), e l'atomo di carbonio del legame С - Сl - un uguale parzialmente positivo carica (δ +).
Una diminuzione della densità elettronica su C 1 porta al fatto che quest'ultimo, esibendo proprietà accettore, sposta gli elettroni del legame S dall'atomo di carbonio vicino. C'è una polarizzazione del legame C 2 –C 1 e si forma anche una parziale carica positiva su C 2, che a sua volta porta alla polarizzazione del legame C 2 –C 3 e alla comparsa di una parziale carica positiva su C 3, ecc. In questo caso, una carica positiva frazionaria sugli atomi di carbonio nella catena da С 1 a С diminuisce: δ +> δ '+> δ' '+> δ' '' +
La polarizzazione di un legame carbonio-alogeno provoca la polarizzazione della molecola nel suo insieme e, di conseguenza, la comparsa di un momento dipolare.
Effetto induttivo (induttivo)- il trasferimento dell'influenza elettronica del sostituente lungo la catena dei legami , che si verifica a causa della diversa elettronegatività degli atomi.
L'effetto induttivo è indicato dalla lettera io, e la miscelazione della densità elettronica è rappresentata usando una freccia lungo un semplice legame , la cui punta indica la direzione dello spostamento.
Nella direzione dell'influenza elettronica dei sostituenti, c'è un positivo + io e negativo -IO effetto induttivo.
Un effetto induttivo negativo si manifesta con sostituenti che attraggono gli elettroni dell'o-bond, ad esempio: –NO 3 –C≡N, –СООН, –Hal, –ОН,
L'effetto induttivo negativo, di regola, aumenta con l'aumentare dell'elettronegatività degli atomi. È più pronunciato per un sostituente con un triplo legame, poiché contiene un atomo di carbonio ibridizzato sp più elettronegativo. A sua volta, l'atomo di carbonio in sp 3 -ibridazione, come meno elettronegativo, nella composizione del sostituente mostra + io rispetto agli atomi di carbonio in sp e sp 2 -ibridazione:
Un effetto induttivo positivo si manifesta con sostituenti che respingono gli elettroni del legame , molto spesso si tratta di gruppi alchilici (Alk). Le proprietà di donatori di elettroni dei sostituenti alchilici aumentano con la lunghezza della catena idrocarburica (–C 4 H 9> –CH 3) e aumentano nella serie dai radicali primari a quelli terziari ((CH 3) 3 C–> (CH 3) 2 CH–> CH 3 CH 2 -> CH 3 -). Quest'ultimo è spiegato dal fatto che l'effetto induttivo è attenuato lungo il circuito.
Riassumendo quanto sopra, soffermiamoci brevemente sulle principali proprietà dell'effetto induttivo;
1. L'effetto induttivo si manifesta solo in presenza di atomi con diversa elettronegatività nella molecola.
2. L'effetto induttivo si propaga solo attraverso gli o-bond in una direzione.
3. L'effetto induttivo decade rapidamente lungo il circuito. La sua azione massima è di quattro legami .
4. Lo spostamento induttivo è determinato dalla presenza di un momento dipolare: μ ≠ 0.
Effetto mesomerico (effetto di coniugazione). Prima di considerare il trasferimento dell'influenza elettronica dei sostituenti lungo il sistema di legami , definiamo i concetti di sistema coniugato e coniugazione.
Un sistema coniugato è un sistema in cui c'è un'alternanza di legami semplici e multipli, o la vicinanza di un atomo con un p-orbitale libero o una coppia non condivisa di p-elettroni. Sono disponibili sistemi accoppiati a circuito aperto e chiuso:
Ciascuna delle catene date di legami coniugati è anche chiamata catena di coniugazione (dal latino - sovrapposizione, sovrapposizione). C'è una coniugazione in loro - un'ulteriore sovrapposizione di orbitali e p aventi assi di simmetria paralleli (complanari). A causa della coniugazione, si verifica una ridistribuzione (delocalizzazione) della densità di elettroni π e la formazione di un singolo sistema di elettroni π.
Diversi tipi di coniugazione si distinguono dal tipo di orbitali sovrapposti: π, -coniugazione (sovrapposizione di due -orbitali), p, -coniugazione (sovrapposizione di p- e π-orbitali):
Riso. 2.9. Sistemi coniugati di 1,3-butadiene, cloruro di vinile e catione allile
La coniugazione è un processo energeticamente benefico che si verifica con il rilascio di energia. I sistemi accoppiati sono caratterizzati da una maggiore stabilità termodinamica.
Avendo dato la definizione di coniugazione e sistemi coniugati, consideriamo gli effetti elettronici che si osservano quando vari tipi di sostituenti vengono introdotti in tali sistemi.
Effetto di coniugazione o effetto mesomerico(M) - il processo di trasferimento dell'influenza elettronica di un sostituente lungo il sistema coniugato di legami . La miscelazione della densità elettronica nei sistemi coniugati è possibile solo quando nel sistema sono inclusi i sostituenti donatori di elettroni o accettori di elettroni.
Ad esempio, c'è coniugazione in una molecola di benzene, ma non ci sono sostituenti, quindi non c'è effetto mesomerico. Il gruppo idrossi nella molecola del fenolo è incluso nel sistema coniugato e mostra un effetto mesomerico, mentre nella molecola dell'alcol benzilico il gruppo –OH è isolato dal sistema coniugato da due legami e non mostra un effetto mesomerico.
L'effetto mesomerico è indicato dalla lettera M e lo spostamento della densità elettronica nel sistema coniugato è indicato da una freccia curva. Secondo l'azione di direzione del sostituente, l'effetto mesomerico è diviso in positivo (+ M) e negativo (–M).
Un effetto mesomerico positivo si manifesta con sostituenti (atomi o gruppi atomici donatori di elettroni) che forniscono elettroni a un sistema coniugato, cioè avente coppie solitarie di elettroni o una carica negativa:
Massimo + M per atomi con carica negativa. I sostituenti contenenti coppie solitarie di elettroni hanno più + M, minore, all'interno del periodo, l'elettronegatività degli atomi contenenti coppie solitarie di elettroni.
I sostituenti che spostano su se stessi la densità elettronica del sistema coniugato mostrano un effetto mesomerico negativo:
Il massimo -M è mostrato dai sostituenti che portano una carica positiva. Nei gruppi insaturi, l'effetto M aumenta con un aumento della differenza di elettronegatività di più atomi di legame.
Consideriamo diversi esempi della manifestazione dell'effetto mesomerico:
L'effetto mesomerico, rispetto a quello induttivo, provoca uno spostamento più forte della densità elettronica e praticamente non si attenua.
Manifestazione congiunta degli effetti induttivi e mesomerici del sostituente
Gli effetti mesomerici e induttivi di un sostituente possono o non possono coincidere nella direzione. Ad esempio, nella molecola dell'acroleina, il gruppo aldeidico presenta -IO e -M, e il gruppo ossidrile nella molecola del fenolo ha -IO, ma + M-effetto,
Come si può vedere dall'esempio riportato, nella molecola del fenolo, la miscelazione elettronica opposta porta al fatto che questi due effetti sembrano "estinguersi" a vicenda. E nella molecola dell'acroleina, gli effetti induttivo e mesomerico si rafforzano a vicenda. L'effetto mesomerico del sostituente è solitamente maggiore di quello induttivo, poiché i legami n sono polarizzati più facilmente dei legami .
La polarizzazione causata dall'effetto mesomerico ha un carattere alternato: sotto l'influenza del sostituente, non solo le nuvole di elettroni , ma anche le nuvole di legami si mescoleranno. Questo fenomeno si osserva nei sistemi con circuito di accoppiamento aperto e chiuso:
Sebbene il gruppo amminico mostri -IO-effetto, provoca una diminuzione della densità elettronica su tutti gli atomi di carbonio del ciclo aromatico, ma a causa di + M-effetto di una coppia di elettroni di un atomo di azoto, che è maggiore -IO in generale si osserva un aumento della densità elettronica agli atomi di carbonio dell'anello benzenico, specialmente nelle posizioni 2. 4. 6. Si verifica polarizzazione alternata.
Nelle molecole a catena coniugata aperta vengono solitamente indicate cariche parziali, che sono concentrate alle estremità del sistema coniugato:
Effetto di sovraconiugazione (iperconiugazione). Insieme a π, π- e p, -coniugazione, esiste un tipo speciale di coniugazione: iperconiugazione (sovraconiugazione) o σ, π-coniugazione.
Effetto di sovraconiugazione- l'interazione che avviene quando la nuvola elettronica degli orbitali o del legame C – H si sovrappone agli orbitali del legame multiplo. Questo tipo di sovrapposizione delle nuvole di elettroni è , -coniugazione, che è presente sia nella serie alifatica che in quella aromatica dei composti. La miscelazione degli elettroni in questo caso è rappresentata usando una freccia curva. Qualsiasi legame del gruppo metilico del propene può partecipare alla coniugazione , .
Riso. 2.10. Schema di sovrapposizione degli orbitali del legame С – con l'orbitale del legame multiplo nella molecola del propene
L'entità dell'effetto dell'iperconiugazione è tanto maggiore quanto più atomi di idrogeno nel carbonio si legano al sistema insaturo. Il concetto di superconiugazione spiega l'aumentata reattività, la mobilità degli atomi di α-idrogeno nelle molecole di aldeidi, chetoni, acidi e loro derivati. A volte l'iperconiugazione prende il nome dagli scienziati che l'hanno scoperta, l'effetto Nathan-Becker.
ISOMERIA DEI COMPOSTI ORGANICI. STRUTTURA SPAZIALE DELLE MOLECOLE
Il termine isomeria (dal greco isos - lo stesso, meros - parte) fu introdotto per la prima volta nel 1830, quando divennero note sostanze che hanno la stessa composizione qualitativa e quantitativa, ma hanno proprietà fisiche e chimiche diverse.
L'isomerismo è un fenomeno che consiste nell'esistenza di composti che hanno la stessa formula molecolare, ma differiscono nell'ordine di legame degli atomi in una molecola o nella disposizione degli atomi nello spazio e, di conseguenza, differiscono nelle proprietà fisiche e chimiche
Tali composti sono chiamati isomeri. Esistono due tipi principali di isomeria: strutturale (isomerismo strutturale) e spaziale (stereoisomerismo).
Gli atomi e i gruppi atomici nelle molecole dei composti organici si influenzano a vicenda e non solo gli atomi direttamente legati l'uno all'altro. Questa influenza viene in qualche modo trasmessa attraverso la molecola. Il trasferimento dell'influenza degli atomi nelle molecole a causa della polarizzazione dei legami è chiamato effetti elettronici ... Esistono due tipi di effetti elettronici: effetti induttivi e mesomerici.
Effetto induttivo- questo è il trasferimento dell'influenza dei sostituenti lungo la catena dei legami a causa della loro polarizzazione. L'effetto induttivo è indicato dal simbolo I. Consideriamolo usando l'esempio di 1-clorobutano:
Il legame C-Cl è polare a causa della maggiore elettronegatività del cloro. Sull'atomo di carbonio si forma una parziale carica positiva (δ +). La coppia di elettroni del successivo legame σ viene spostata verso l'atomo di carbonio carente di elettroni, cioè polarizzato. A causa di ciò, si verifica anche una parziale carica positiva (δ + ') sul successivo atomo di carbonio, ecc. Quindi cloro induce polarizzazione non solo del legame σ "intrinseco", ma anche di quelli successivi nella catena. Nota che ogni successiva carica parziale positiva è minore della precedente (δ +> δ + '> δ +' '> δ +' ''), cioè l'effetto induttivo viene trasmesso lungo il circuito con smorzamento. Ciò può essere spiegato dalla bassa polarizzabilità dei legami . È generalmente accettato che l'effetto induttivo si estenda a 3-4 legami . Nell'esempio dato, l'atomo di cloro sposta la densità elettronica lungo la catena di legame a me stesso... Questo effetto è chiamato effetto induttivo negativo ed è indicato come –I Cl.
La maggior parte dei sostituenti mostra un effetto induttivo negativo, perché la loro struttura contiene atomi più elettronegativi dell'idrogeno (si presume che l'effetto induttivo dell'idrogeno sia nullo). Ad esempio: -F, -Cl, -Br, -I, -OH, -NH 2, -NO 2,
-COOH,> C = O.
Se il sostituente sposta la densità elettronica lungo la catena di legami σ Spingere, ha un effetto induttivo positivo (+ I). Ad esempio:
L'ossigeno con una carica negativa totale ha un effetto induttivo positivo.
Nella molecola del propene, il carbonio del gruppo metilico è ibridizzato sp 3 e gli atomi di carbonio al doppio legame sp 2 sono ibridati, cioè più elettronegativo. Pertanto, il gruppo metilico sposta la densità elettronica lontano da se stesso, esibendo un effetto induttivo positivo (+ I CH 3).
Quindi, l'effetto induttivo può manifestarsi in qualsiasi molecola in cui sono presenti atomi di diversa elettronegatività.
Effetto mesomericoÈ il trasferimento dell'influenza elettronica dei sostituenti nei sistemi coniugati attraverso la polarizzazione dei legami . L'effetto mesomerico viene trasmesso senza attenuazione, perché I legami sono facilmente polarizzati. Nota: solo quei sostituenti che sono essi stessi parte del sistema coniugato hanno un effetto mesomerico. Ad esempio:
L'effetto mesomerico può essere positivo (+ M) o negativo (-M).
Nella molecola del cloruro di vinile, la coppia di elettroni solitari del cloro partecipa alla p, -coniugazione, cioè il contributo del cloro al sistema coniugato è maggiore di quello di ciascuno degli atomi di carbonio. Pertanto, il cloro mostra un effetto mesomerico positivo.
Una molecola di aldeide acrilica è
Sistema π.π-coniugato. L'atomo di ossigeno cede un elettrone alla coniugazione - lo stesso di ogni atomo di carbonio, ma l'elettronegatività dell'ossigeno è superiore a quella del carbonio, quindi l'ossigeno sposta la densità elettronica del sistema coniugato verso se stesso, il gruppo aldeidico nel suo insieme mostra un effetto mesomerico negativo.
Quindi, i sostituenti che donano due elettroni alla coniugazione hanno un effetto mesomerico positivo. Questi includono:
a) sostituenti con carica completamente negativa, ad esempio –O -;
b) sostituenti, nella cui struttura sono presenti atomi con coppie di elettroni solitari sull'orbitale p z, ad esempio: -NH 2, -OH,
-F, -Cl, -Br-, -I, -OR (-OCH 3, -OC 2 H 5).
I sostituenti che spostano verso se stessi la densità elettronica lungo il sistema coniugato mostrano un effetto mesomerico negativo. Questi includono sostituenti nella cui struttura sono presenti doppi legami, ad esempio:
Il sostituente può esibire contemporaneamente effetti induttivi e mesomerici. In alcuni casi, la direzione di questi effetti è la stessa (ad esempio -I e -M), in altri - agiscono in direzioni opposte (ad esempio -I e + M). Come si può, in questi casi, determinare l'effetto generale di un sostituente sul resto della molecola (in altre parole, come determinare se un dato sostituente è elettron donatore o elettron attrattore)? I sostituenti che aumentano la densità elettronica nel resto della molecola sono chiamati donatori di elettroni e i sostituenti che riducono la densità elettronica nel resto della molecola sono chiamati accettori di elettroni.
Per determinare l'effetto complessivo di un sostituente, è necessario confrontare i suoi effetti elettronici in grandezza. Se prevale l'effetto positivo, il sostituente è donatore di elettroni. Se prevale l'effetto negativo, il sostituente assorbe elettroni. Va notato che, di regola, l'effetto mesomerico è più pronunciato di quello induttivo (a causa della maggiore capacità dei legami di polarizzare). Tuttavia, ci sono eccezioni a questa regola: l'effetto induttivo degli alogeni è più pronunciato di quello mesomerico.
Consideriamo esempi specifici:
In questo composto, il gruppo amminico è un sostituente donatore di elettroni, poiché il suo effetto mesomerico positivo è più pronunciato di quello induttivo negativo.
In questo composto, il gruppo amminico è uno spotter attrattore di elettroni, poiché mostra solo un effetto induttivo negativo.
Nella molecola del fenolo il gruppo ossidrile è un sostituente elettron-donatore per la predominanza dell'effetto mesomerico positivo su quello induttivo negativo.
Nella molecola dell'alcol benzilico, il gruppo ossidrile non partecipa alla coniugazione e mostra solo un effetto induttivo negativo. Pertanto, è un sostituente attrattore di elettroni.
Questi esempi mostrano che è impossibile considerare l'influenza di qualsiasi sostituente in generale, ma è necessario considerare la sua influenza in una specifica molecola.
Solo gli alogeni sono sempre sostituenti elettron-attrattori, poiché il loro effetto induttivo negativo è più pronunciato dell'effetto mesomerico positivo. Ad esempio:
Torniamo ora alle reazioni di sostituzione elettrofila nei derivati del benzene. Quindi, abbiamo scoperto che il sostituente già presente nell'anello influenza il corso delle reazioni di sostituzione elettrofila. Come si esprime questa influenza?
Il sostituente influenza la velocità di reazione S E e la posizione del secondo sostituente introdotto nell'anello... Consideriamo entrambi questi aspetti dell'influenza.
Influenza sulla velocità di reazione... Maggiore è la densità elettronica nell'anello, più facili sono le reazioni di sostituzione elettrofila. È chiaro che i sostituenti elettron-donatori facilitano le reazioni SE (sono attivatori del ciclo) e i sostituenti elettron-attrattori le rendono più difficili (disattivano il ciclo). Pertanto, le reazioni di sostituzione elettrofila nei derivati del benzene contenenti sostituenti elettron-attrattori vengono effettuate in condizioni più severe.
Confrontiamo l'attività di fenolo, toluene, benzene, clorobenzene e nitrobenzene nella reazione di nitrazione.
Poiché fenolo e toluene contengono sostituenti donatori di elettroni, sono più attivi nelle reazioni SE del benzene. Al contrario, clorobenzene e nitrobenzene sono meno attivi in queste reazioni rispetto al benzene, perché contengono sostituenti elettron-attrattori. Il fenolo è più attivo del toluene a causa dell'effetto mesomerico positivo del gruppo OH. Il cloro non è un sostituente attrattore di elettroni così forte come il gruppo nitro, perché il gruppo nitro mostra sia effetti induttivi negativi che mesomerici negativi. Quindi, in questa serie, l'attività nelle reazioni di sostituzione elettrofila diminuisce da fenolo a nitrobenzene. È stato stabilito sperimentalmente che se la velocità della reazione di nitrazione del benzene è considerata pari a 1, allora questa serie sarà simile a questa:
Il secondo aspetto dell'influenza di un sostituente in un anello aromatico sul corso delle reazioni di sostituzione elettrofila è il cosiddetto azione di orientamento dei sostituti... Tutti i sostituenti possono essere suddivisi in due gruppi: orto-, para-orientanti (sostituenti di 1° tipo) e meta-orientanti (sostituenti di 2° tipo).
A sostituti del 1° tipo comprendono: -OH, -O -, -NH 2, gruppi alchilici (-CH 3, -C 2 H 5, ecc.) e alogeni. Puoi vedere che tutti questi sostituenti mostrano un effetto induttivo positivo e/o un effetto mesomerico positivo. Tutti, ad eccezione degli alogeni, aumentano la densità elettronica nell'anello, specialmente nelle posizioni orto e para. Pertanto, l'elettrofilo è diretto a queste posizioni. Diamo un'occhiata al fenolo come esempio:
A causa dell'effetto mesomerico positivo del gruppo ossidrile, la densità elettronica viene ridistribuita sul sistema coniugato ed è particolarmente aumentata nelle posizioni orto e para.
Quando il fenolo viene bromurato, si forma una miscela di orto- e para-bromofenolo:
Se si esegue la bromurazione in un solvente polare (acqua di bromo) e si utilizza un eccesso di bromo, la reazione procede contemporaneamente in tre posizioni:
Sostituti di 2° tipo sono: -NH 3+, -COOH, -CHO (gruppo aldeidico), -NO 2, -SO 3 H. Tutti questi sostituenti abbassano la densità elettronica nell'anello aromatico, ma a causa della sua ridistribuzione nelle meta-posizioni, non è abbassato così forte come in orto e para. Consideriamo questo usando l'acido benzoico come esempio:
Il gruppo carbossilico mostra effetti induttivi e mesomerici negativi. A causa della ridistribuzione sul sistema coniugato nelle meta-posizioni, la densità elettronica rimane più alta che nelle orto- e para-, quindi l'elettrofilo attaccherà le meta-posizioni.
Mutua influenza degli atomi nelle molecole delle sostanze organiche (Teoria degli spostamenti elettronici di K. Ingold)
Atomi e gruppi di atomi in una molecola di materia organica hanno un effetto significativo l'uno sull'altro. Questa influenza si basa sulla ridistribuzione della densità elettronica sotto l'influenza delle forze elettrostatiche che agiscono all'interno della molecola.
La presenza di influenza reciproca è stata segnalata da A.M. Butlerov nella teoria della struttura delle sostanze organiche. Tuttavia, una teoria rigorosa degli spostamenti degli elettroni fu sviluppata solo nel 1926-1933 dal chimico inglese Christopher Ingold.
Nelle molecole delle sostanze organiche, ci sono due possibilità per la ridistribuzione della densità elettronica:
- 1. Spostamento della densità elettronica lungo i legami - causato dalla differenza nelle elettronegatività degli atomi (o gruppi di atomi) inclusi nella molecola. L'influenza reciproca trasmessa lungo la catena di -connessioni è chiamata effetto di induzione (effetto I) (effetto polare). L'effetto di induzione è sempre riferito ad uno specifico atomo o gruppo di atomi e, a seconda della direzione dello spostamento della densità elettronica sotto l'azione dell'atomo in questione, si distinguono due tipi di effetti di induzione:
- un) effetto di induzione positivo (+ effetto I) Spingere (atomi e gruppi donatori di elettroni):
Per determinare la gravità dell'effetto +I, ci sono una serie di regole:
a) L'effetto +I di un sostituente è tanto più forte quanto minore è la sua elettronegatività:
b) A causa della, seppur piccola, polarità del legame C - H, i gruppi alchilici mostrano un effetto + I:
b) effetto di induzione negativo (effetto -I): l'atomo o il gruppo considerato sposta la densità elettronica lungo la catena dei -legami a te stesso (atomi e gruppi che prelevano elettroni):
La gravità dell'effetto -I è determinata dalle seguenti regole:
a) l'effetto I è tanto più forte quanto maggiore è l'elettronegatività dell'elemento:
b) I sostituenti insaturi provocano l'effetto -I, che aumenta all'aumentare del grado di insaturazione:
Ciò è dovuto a un cambiamento nell'elettronegatività degli atomi di carbonio con un cambiamento nel grado della loro ibridazione.
A causa della rigidità delle connessioni, l'effetto di induzione, quando si sposta lungo la catena, si estingue rapidamente. La sua influenza è più evidente sul primo e sul secondo atomo della catena; la sua influenza sugli atomi successivi è trascurabile.
2. Spostamento della densità elettronica lungo i legami coniugati. La coniugazione è un tipo di interazione elettronica che avviene nelle molecole, nella cui struttura si alternano legami semplici e multipli. A causa della coniugazione, in tali sistemi esiste un'unica nuvola elettronica. Questo effetto è chiamato effetto di coniugazione (effetto C) o effetto mesomerico (effetto M). Contrariamente all'effetto di induzione, l'effetto mesomerico si trasmette lungo la catena dei legami coniugati senza indebolirsi, coprendo l'intera molecola. Oltre all'induzione, l'effetto mesomerico può essere positivo e negativo: + M-effetto e -M-effetto. I sostituenti che hanno un elemento fortemente elettronegativo nella loro composizione hanno un effetto mesomerico negativo. I sostituenti contenenti un atomo con una coppia di elettroni liberi hanno un effetto mesomerico positivo. Nel caso in cui un sostituente contenga un atomo fortemente elettronegativo con una coppia solitaria, c'è una competizione tra gli effetti -M e + M (alogeni).
Una variazione dell'effetto mesomerico è l'effetto di iperconiugazione (iperconiugazione, effetto Nathan-Becker, -coniugazione). La superconiugazione è dovuta alla sovrapposizione degli -orbitali dei legami dei gruppi alchilici con il sistema degli -elettroni.
Chimica organica- una sezione di chimica, che studia i composti del carbonio, la loro struttura, proprietà, interconversioni.
Il nome stesso della disciplina - "chimica organica" - è sorto molto tempo fa. La ragione risiede nel fatto che la maggior parte dei composti del carbonio incontrati dai ricercatori nella fase iniziale della formazione della scienza chimica erano di origine vegetale o animale. Tuttavia, in via eccezionale, alcuni composti del carbonio sono classificati come inorganici. Quindi, ad esempio, gli ossidi di carbonio, l'acido carbonico, i carbonati, gli idrocarbonati, l'acido cianidrico e alcuni altri sono considerati sostanze inorganiche.
Attualmente si conoscono poco meno di 30 milioni di varie sostanze organiche e questo elenco è in costante crescita. Un numero così elevato di composti organici è principalmente associato alle seguenti proprietà specifiche del carbonio:
1) gli atomi di carbonio possono collegarsi tra loro in catene di lunghezza arbitraria;
2) è possibile non solo la connessione sequenziale (lineare) di atomi di carbonio tra loro, ma anche ramificata e persino ciclica;
3) sono possibili diversi tipi di legami tra atomi di carbonio, ovvero singoli, doppi e tripli. In questo caso la valenza del carbonio nei composti organici è sempre pari a quattro.
Inoltre, un'ampia varietà di composti organici è anche facilitata dal fatto che gli atomi di carbonio sono in grado di formare legami con gli atomi di molti altri elementi chimici, ad esempio idrogeno, ossigeno, azoto, fosforo, zolfo e alogeni. In questo caso, l'idrogeno, l'ossigeno e l'azoto sono i più comuni.
Va notato che per molto tempo la chimica organica è stata una "foresta oscura" per gli scienziati. Per qualche tempo, anche nella scienza era popolare la teoria del vitalismo, secondo la quale le sostanze organiche non possono essere ottenute con un metodo "artificiale", ad es. materia vivente esterna. Tuttavia, la teoria del vitalismo non durò molto a lungo, a causa del fatto che furono scoperte una ad una sostanze, la cui sintesi è possibile al di fuori degli organismi viventi.
I ricercatori erano perplessi dal fatto che molte sostanze organiche hanno la stessa composizione qualitativa e quantitativa, ma spesso hanno proprietà fisiche e chimiche completamente diverse. Quindi, ad esempio, il dimetiletere e l'alcol etilico hanno esattamente la stessa composizione elementare, tuttavia, il dimetiletere in condizioni normali è un gas e l'alcol etilico è un liquido. Inoltre, il dimetiletere non reagisce con il sodio, ma l'alcol etilico interagisce con esso, rilasciando idrogeno gassoso.
I ricercatori del 19° secolo hanno avanzato molte ipotesi su come sia ancora organizzata la materia organica. Assunzioni essenzialmente importanti sono state avanzate dallo scienziato tedesco FA Kekule, che è stato il primo a proporre l'idea che gli atomi di diversi elementi chimici abbiano valori di valenza specifici e che gli atomi di carbonio nei composti organici siano tetravalenti e siano in grado di combinarsi tra loro, formare catene. Successivamente, sulla base delle ipotesi di Kekule, lo scienziato russo Alexander Mikhailovich Butlerov sviluppò una teoria della struttura dei composti organici, che non ha perso la sua rilevanza nel nostro tempo. Considera le principali disposizioni di questa teoria:
1) tutti gli atomi nelle molecole delle sostanze organiche sono collegati tra loro in una certa sequenza secondo la loro valenza. Gli atomi di carbonio hanno una valenza costante di quattro e possono formare catene di strutture diverse tra loro;
2) le proprietà fisiche e chimiche di qualsiasi sostanza organica dipendono non solo dalla composizione delle sue molecole, ma anche dall'ordine in cui gli atomi di questa molecola sono uniti tra loro;
3) i singoli atomi, così come i gruppi di atomi in una molecola, si influenzano a vicenda. Questa reciproca influenza si riflette nelle proprietà fisiche e chimiche dei composti;
4) esaminando le proprietà fisiche e chimiche di un composto organico, è possibile stabilirne la struttura. È vero anche il contrario: conoscendo la struttura della molecola di una particolare sostanza, puoi prevederne le proprietà.
Proprio come la legge periodica di Mendelev divenne il fondamento scientifico della chimica inorganica, la teoria della struttura delle sostanze organiche di A.M. Butlerova in realtà divenne il punto di partenza nella formazione della chimica organica come scienza. Va notato che dopo la creazione della teoria della struttura di Butlerov, la chimica organica ha iniziato il suo sviluppo a un ritmo molto rapido.
Isomeria e omologia
Secondo la seconda tesi della teoria di Butlerov, le proprietà delle sostanze organiche dipendono non solo dalla composizione qualitativa e quantitativa delle molecole, ma anche dall'ordine in cui gli atomi di queste molecole sono uniti tra loro.
A questo proposito, tra le sostanze organiche è diffuso un fenomeno come l'isomerismo.
L'isomerismo è un fenomeno quando diverse sostanze hanno esattamente la stessa composizione di molecole, ad es. la stessa formula molecolare.
Molto spesso, gli isomeri differiscono notevolmente nelle proprietà fisiche e chimiche. Ad esempio:
Tipi di isomeria
Isomeria strutturale
a) Isomeria dello scheletro carbonioso
b) Isomeria di posizione:
connessione multipla
deputati:
gruppi funzionali:
c) Isomeria interclasse:
L'isomerismo interclasse si verifica quando i composti isomerici appartengono a diverse classi di composti organici.
Isomeria spaziale
L'isomerismo spaziale è un fenomeno quando diverse sostanze con lo stesso ordine di attaccamento degli atomi tra loro differiscono l'una dall'altra per una posizione fissa-diversa di atomi o gruppi di atomi nello spazio.
Esistono due tipi di isomeria spaziale: geometrica e ottica. Non ci sono compiti per l'isomerismo ottico nell'esame, quindi considereremo solo l'isomerismo geometrico.
Se nella molecola di un qualsiasi composto è presente un doppio legame C = C o un ciclo, talvolta in tali casi il fenomeno di un legame geometrico o cis-trans-isomeria.
Ad esempio, questo tipo di isomeria è possibile per il butene-2. Il suo significato è che il doppio legame tra gli atomi di carbonio ha effettivamente una struttura planare e i sostituenti di questi atomi di carbonio possono essere posizionati in modo fisso sopra o sotto questo piano:

Quando gli stessi sostituenti sono sullo stesso lato del piano, dicono che questo è cis-isomero, e quando diverso - trance-isomero.
On sotto forma di formule di struttura cis- e trance-isomeri (ad esempio, butene-2) sono rappresentati come segue:
Si noti che l'isomerismo geometrico è impossibile se almeno un atomo di carbonio sul doppio legame ha due sostituenti identici. Per esempio, cis-trans l'isomerismo non è possibile per il propene:
 Il propene non ha cis-trans-isomeri, poiché in corrispondenza di uno degli atomi di carbonio in corrispondenza del doppio legame ci sono due "sostituenti" identici (atomi di idrogeno)
Il propene non ha cis-trans-isomeri, poiché in corrispondenza di uno degli atomi di carbonio in corrispondenza del doppio legame ci sono due "sostituenti" identici (atomi di idrogeno) Come puoi vedere dall'illustrazione sopra, se scambiamo le posizioni del radicale metile e dell'atomo di idrogeno situato sul secondo atomo di carbonio, sui lati opposti del piano, otteniamo la stessa molecola che abbiamo appena guardato dall'altra parte .
Influenza di atomi e gruppi di atomi l'uno sull'altro in molecole di composti organici
Il concetto di struttura chimica come sequenza di atomi collegati tra loro è stato notevolmente ampliato con l'avvento della teoria elettronica. Dal punto di vista di questa teoria, è possibile spiegare come atomi e gruppi di atomi in una molecola si influenzano a vicenda.
Ci sono due possibili modi di influenzare alcune parti della molecola su altre:
1) Effetto induttivo
2) Effetto mesomerico
Effetto induttivo
Per dimostrare questo fenomeno, prendiamo ad esempio la molecola di 1-cloropropano (CH 3 CH 2 CH 2 Cl). Il legame tra gli atomi di carbonio e di cloro è polare perché il cloro ha un'elettronegatività molto più alta del carbonio. Come risultato dello spostamento della densità elettronica dall'atomo di carbonio all'atomo di cloro, si forma una parziale carica positiva (δ +) sull'atomo di carbonio e una parziale carica negativa (δ-) sull'atomo di cloro:
Lo spostamento della densità elettronica da un atomo all'altro è spesso indicato da una freccia che punta verso un atomo più elettronegativo:
Tuttavia, un punto interessante è che, oltre allo spostamento della densità elettronica dal primo atomo di carbonio all'atomo di cloro, c'è anche uno spostamento, ma in misura leggermente minore, dal secondo atomo di carbonio al primo, come così come dal terzo al secondo:
Tale spostamento nella densità elettronica lungo la catena dei legami è chiamato effetto induttivo ( io). Questo effetto si estingue con la distanza dal gruppo influente e non si manifesta praticamente dopo 3 legami .
Nel caso in cui un atomo o un gruppo di atomi abbia una maggiore elettronegatività rispetto agli atomi di carbonio, si dice che tali sostituenti hanno un effetto induttivo negativo (- io). Pertanto, nell'esempio precedente, l'atomo di cloro ha un effetto induttivo negativo. Oltre al cloro, i seguenti sostituenti hanno un effetto induttivo negativo:
–F, –Cl, –Br, –I, –OH, –NH 2, –CN, –NO 2, –COH, –COOH
Se l'elettronegatività di un atomo o di un gruppo di atomi è inferiore all'elettronegatività di un atomo di carbonio, si verifica effettivamente il trasferimento della densità elettronica da tali sostituenti agli atomi di carbonio. In questo caso, si dice che il sostituente ha un effetto induttivo positivo (+ io) (è un donatore di elettroni).
Quindi, deputati con + io-effetto sono i radicali idrocarburici saturi. In questo caso, la gravità di + io-effetto aumenta con l'allungamento del radicale idrocarburico:
–C 3, –C 2 H 5, –C 3 H 7, –C 4 H 9
Va notato che gli atomi di carbonio in diversi stati di valenza hanno anche diversa elettronegatività. Gli atomi di carbonio ibridi sp sono più elettronegativi degli atomi di carbonio ibridi sp2, che, a loro volta, sono più elettronegativi degli atomi di carbonio ibridati sp3.
Effetto mesomerico (M), o effetto di coniugazione, è l'influenza di un sostituente trasmessa attraverso un sistema di legami coniugati.
Il segno dell'effetto mesomerico è determinato secondo lo stesso principio del segno dell'effetto induttivo. Se un sostituente aumenta la densità elettronica in un sistema coniugato, ha un effetto mesomerico positivo (+ m) ed è donatore di elettroni. Doppi legami carbonio-carbonio, sostituenti contenenti una coppia di elettroni non condivisa: -NH 2, -OH, alogeni hanno un effetto mesomerico positivo.
L'effetto mesomerico negativo (- m) sono posseduti da sostituenti che ritirano la densità elettronica dal sistema coniugato, mentre la densità elettronica nel sistema diminuisce.
I seguenti gruppi hanno un effetto mesomerico negativo:
–NO 2, –COOH, –SO 3 H, -COH,> C = O
A causa della ridistribuzione della densità elettronica dovuta agli effetti mesomerici e induttivi nella molecola, su alcuni atomi compaiono cariche parziali positive o negative, che si riflettono nelle proprietà chimiche della sostanza.
Graficamente, l'effetto mesomerico è mostrato da una freccia curva che inizia al centro della densità elettronica e termina dove la densità elettronica è spostata. Quindi, ad esempio, in una molecola di cloruro di vinile, l'effetto mesomerico si verifica quando la coppia di elettroni solitari dell'atomo di cloro è coniugata con gli elettroni del legame tra gli atomi di carbonio. Pertanto, come risultato di ciò, sull'atomo di cloro appare una carica positiva parziale e la nuvola di elettroni con mobilità, sotto l'influenza della coppia di elettroni, viene spostata verso l'atomo di carbonio estremo, su cui si verifica una carica negativa parziale di conseguenza:
Se una molecola ha legami singoli e doppi alternati, si dice che la molecola contiene un sistema di elettroni π coniugati. Una proprietà interessante di un tale sistema è che l'effetto mesomerico non si attenua in esso.
- In contatto con 0
- Google+ 0
- ok 0
- Facebook 0