Alkaner:
Alkaner är mättade kolväten, i vilkas molekyler alla atomer är förbundna med enkelbindningar. Formel -
Fysikaliska egenskaper:
- Smält- och kokpunkter ökar med molekylvikten och längden på kolstommen
- Under normala förhållanden är ogrenade alkaner från CH4 till C4H10 gaser; från C5H12 till C13H28 - vätskor; efter C14H30 - fasta ämnen.
- Smält- och kokpunkten minskar från mindre grenad till mer grenad. Så, till exempel, vid 20 °C är n-pentan en vätska och neopentan är en gas.
Kemiska egenskaper:
· Halogenering
detta är en av substitutionsreaktionerna. Den minst hydrerade kolatomen halogeneras först (tertiär atom, sedan sekundära, primära atomer halogeneras sist). Halogeneringen av alkaner sker i steg - inte mer än en väteatom ersätts i ett steg:
- CH 4 + Cl 2 → CH 3 Cl + HCl (klormetan)
- CH 3 Cl + Cl 2 → CH 2 Cl 2 + HCl (diklormetan)
- CH 2 Cl 2 + Cl 2 → CHCl 3 + HCl (triklormetan)
- CHCI3 + Cl2 → CCI4 + HCl (koltetraklorid).
Under påverkan av ljus bryts en klormolekyl ner till radikaler, sedan angriper de alkanmolekyler, tar bort en väteatom från dem, som ett resultat av vilka metylradikaler CH 3 bildas, som kolliderar med klormolekyler, förstör dem och bildar nya radikaler.
· Förbränning
Den huvudsakliga kemiska egenskapen hos mättade kolväten, som bestämmer deras användning som bränsle, är förbränningsreaktionen. Exempel:
CH4 + 2O2 → CO2 + 2H2O+ F
Vid syrebrist, istället för koldioxid kolmonoxid eller kol erhålls (beroende på syrekoncentrationen).
I allmänhet kan förbränningsreaktionen av alkaner skrivas som följer:
MED n H 2 n+2 +(1,5n+0,5)O2 = n CO 2 + ( n+1) H2O
· Sönderfall
Nedbrytningsreaktioner sker endast under inverkan av höga temperaturer. En ökning av temperaturen leder till att kolbindningar spricker och att fria radikaler bildas.
Exempel:
CH4 -> C + 2H2 (t > 1000 °C)
C2H6 → 2C + 3H2
Alkenes:
Alkener är omättade kolväten som i molekylen, förutom enkelbindningar, innehåller en kol-kol dubbelbindning Formel - C n H 2n
Att ett kolväte tillhör klassen alkener återspeglas av det generiska suffixet –en i dess namn.
Fysikaliska egenskaper:
- Smält- och kokpunkten för alkener (förenklat) ökar med molekylvikten och längden på kolstommen.
- Under normala förhållanden är alkener från C2H4 till C4H8 gaser; från C5H10 till C17H34 - vätskor, efter C18H36 - fasta ämnen. Alkener är olösliga i vatten, men är mycket lösliga i organiska lösningsmedel.
Kemiska egenskaper:
· Uttorkningär processen att avskilja en vattenmolekyl från en molekyl av en organisk förening.
· Polymerisationär en kemisk process för att kombinera många initiala molekyler av ett ämne med låg molekylvikt till stora polymermolekyler.
Polymerär en högmolekylär förening vars molekyler består av många identiska strukturella enheter.
Alkadiener:
Alkadiener är omättade kolväten som innehåller i molekylen, förutom enkelbindningar, dubbla kol-kolbindningar.
. Diener är strukturella isomerer av alkyner.Fysikaliska egenskaper:
Butadien är en gas (kokpunkt −4,5 °C), isopren är en vätska som kokar vid 34 °C, dimetylbutadien är en vätska som kokar vid 70 °C. Isopren och andra dienkolväten kan polymeriseras till gummi. Naturgummi i renat tillstånd är en polymer med den allmänna formeln (C5H8)n och erhålls från mjölksaften från vissa tropiska växter.
Gummi är mycket lösligt i bensen, bensin och koldisulfid. Vid låga temperaturer blir den skör och klibbig när den värms upp. För att förbättra de mekaniska och kemiska egenskaperna hos gummi omvandlas det till gummi genom vulkanisering. För att få gummiprodukter formas de först av en blandning av gummi med svavel, samt fyllmedel: sot, krita, lera och några organiska föreningar tjänar till att påskynda vulkaniseringen. Sedan värms produkterna upp - varmvulkning. Under vulkanisering binder svavel kemiskt till gummit. Dessutom innehåller vulkaniserat gummi svavel i fritt tillstånd i form av små partiklar.
Dienkolväten polymeriserar lätt. Polymerisationsreaktionen av dienkolväten ligger till grund för syntesen av gummi. De genomgår additionsreaktioner (hydrering, halogenering, hydrohalogenering):
H2C=CH-CH=CH2 + H2-> H3 C-CH=CH-CH3
Alkyner:
Alkyner är omättade kolväten vars molekyler innehåller, förutom enkelbindningar, en trippel kol-kolbindning Formel-C n H 2n-2
Fysikaliska egenskaper:
Alkyner liknar motsvarande alkener i sina fysikaliska egenskaper. Lägre (upp till C 4) är färglösa och luktfria gaser som har högre kokpunkter än deras analoger i alkener.
Alkyner är dåligt lösliga i vatten, men bättre i organiska lösningsmedel.
Kemiska egenskaper:
Halogeneringsreaktioner
Alkyner kan lägga till en eller två halogenmolekyler för att bilda motsvarande halogenderivat:
Hydrering
I närvaro av kvicksilversalter tillsätter alkyner vatten för att bilda acetaldehyd (för acetylen) eller keton (för andra alkyner)
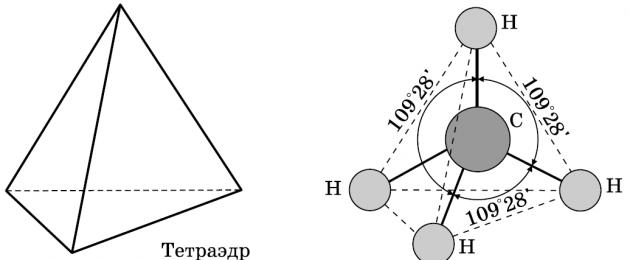
Struktur av alkaner
Alkaner är kolväten i vars molekyler atomerna är förbundna med enkelbindningar och som motsvarar den allmänna formeln CnH2n+2. I alkanmolekyler finns alla kolatomer i tillståndet sp3-hybridisering.
Detta betyder att alla fyra hybridorbitaler av kolatomen är identiska i form, energi och är riktade i liksidiga vinklar. triangulär pyramid - tetraeder. Vinklarna mellan orbitalerna är 109° 28′. Nästan fri rotation är möjlig runt en enda kol-kolbindning, och alkanmolekyler kan anta en mängd olika former med vinklar vid kolatomerna nära tetraedriska (109° 28′), till exempel i n-pentanmolekylen.

Det är särskilt värt att påminna om bindningarna i alkanmolekyler. Alla bindningar i molekylerna av mättade kolväten är enkla. Överlappningen sker längs axeln som förbinder atomkärnorna, dvs σ bindningar. Kol-kolbindningar är opolära och dåligt polariserbara. Längden på C-C-bindningen i alkaner är 0,154 nm (1,54 10 10 m). CH-bindningar är något kortare. Elektrondensiteten är något förskjuten mot den mer elektronegativa kolatomen, dvs CH-bindningen är svagt polär.
Homolog serie av metan
Homologer- ämnen som liknar struktur och egenskaper och skiljer sig i en eller flera CH-grupper 2 .


Mättade kolväten utgör den homologa serien av metan.
Isomerism och nomenklatur av alkaner
Alkaner kännetecknas av den sk strukturell isomerism. Strukturella isomerer skiljer sig från varandra i strukturen av kolskelettet. Den enklaste alkanen, som kännetecknas av strukturella isomerer, är butan.

Låt oss överväga mer i detalj den grundläggande nomenklaturen för alkaner IUPAC.
1. Val av huvudkrets. Bildandet av namnet på ett kolväte börjar med definitionen av huvudkedjan - den längsta kedjan av kolatomer i molekylen, som så att säga är dess grund.
2. Numrering av huvudkedjeatomer. Atomerna i huvudkedjan är tilldelade nummer. Numreringen av atomerna i huvudkedjan börjar från den ände som substituenten är närmast (strukturerna A, B). Om substituenterna är belägna på lika avstånd från slutet av kedjan, börjar numreringen från den ände där det finns fler av dem (struktur B). Om olika substituenter är belägna på lika avstånd från kedjans ändar, börjar numreringen från den ände som den äldre är närmast (struktur D). Ancienniteten för kolvätesubstituenter bestäms av den ordning i vilken bokstaven som deras namn börjar visas i alfabetet: metyl (-CH 3), sedan propyl (-CH 2 -CH 2 -CH 3), etyl (-CH 2 -CH3) etc.
Observera att namnet på substituenten bildas genom att ersätta suffixet -an med suffixet -yl i namnet på motsvarande alkan.
3. Bildandet av namnet. I början av namnet anges siffror - numren på kolatomerna där substituenterna är belägna. Om det finns flera substituenter vid en given atom, så upprepas motsvarande nummer i namnet två gånger åtskilda av ett kommatecken (2,2-). Efter numret indikerar ett bindestreck antalet substituenter (di - två, tre - tre, tetra - fyra, penta - fem) och namnet på substituenten (metyl, etyl, propyl). Sedan, utan mellanslag eller bindestreck, namnet på huvudkedjan. Huvudkedjan kallas ett kolväte - en medlem av den homologa serien av metan (metan, etan, propan, etc.).




Namnen på ämnen vars strukturformler anges ovan är följande:
Struktur A: 2-metylpropan;
Struktur B: 3-etylhexan;
Struktur B: 2,2,4-trimetylpentan;
Struktur D: 2-metyl-4-etylhexan.
Frånvaro av mättade kolväten i molekyler polära bindningar leder till dem dåligt lösligt i vatten, interagerar inte med laddade partiklar (joner). De mest karakteristiska reaktionerna för alkaner är de som involverar fria radikaler.
Fysikaliska egenskaper hos alkaner
De första fyra representanterna för den homologa serien av metan är gaser. Den enklaste av dem är metan - en färglös, smaklös och luktfri gas (lukten av "gas", när du luktar den måste du ringa 04, bestäms av lukten av merkaptaner - svavelhaltiga föreningar speciellt tillsatta till metan som används i hushålls- och industrigasapparater så att personer som befinner sig bredvid dem kunde upptäcka läckan genom lukt).
Kolväten av sammansättning från MED 5 N 12 innan MED 15 N 32 - vätskor; tyngre kolväten är fasta ämnen. Kok- och smältpunkterna för alkaner ökar gradvis med ökande kolkedjelängd. Alla kolväten är dåligt lösliga i vatten, flytande kolväten är vanliga organiska lösningsmedel.


Kemiska egenskaper hos alkaner
Substitutionsreaktioner.
De mest karakteristiska reaktionerna för alkaner är substitution av fria radikaler under vilken en väteatom ersätts med en halogenatom eller någon grupp.
Låt oss presentera de karakteristiska ekvationerna halogeneringsreaktioner:
Vid överskott av halogen kan kloreringen gå längre, upp till fullständig ersättning av alla väteatomer med klor:

De resulterande ämnena används i stor utsträckning som lösningsmedel och utgångsmaterial i organiska synteser.
Dehydreringsreaktion(väteabstraktion).
När alkaner passeras över en katalysator (Pt, Ni, Al 2 O 3, Cr 2 O 3) vid hög temperatur(400-600 °C) elimineras vätemolekylen och bildandet alken:
Reaktioner åtföljda av förstörelsen av kolkedjan. Alla mättade kolväten brinner med bildning av koldioxid och vatten. Gasformiga kolväten blandade med luft i vissa proportioner kan explodera.
1. Förbränning av mättade kolvätenär en exoterm reaktion från fria radikaler, vilket är mycket viktigt när man använder alkaner som bränsle:
I allmänhet kan förbränningsreaktionen av alkaner skrivas som följer:
2. Termisk spjälkning av kolväten.
Processen fortskrider enligt mekanism för fria radikaler. En ökning av temperaturen leder till homolytisk klyvning av kol-kolbindningen och bildandet av fria radikaler.
Dessa radikaler interagerar med varandra och byter ut en väteatom för att bilda en molekyl alkan och alkenmolekyl:
Termiska nedbrytningsreaktioner ligger bakom den industriella processen - kolvätekrackning. Denna process är det viktigaste steget i oljeraffineringen.
3. Pyrolys. När metan värms upp till en temperatur av 1000 °C, metan pyrolys- nedbrytning till enkla ämnen:
Vid upphettning till en temperatur av 1500 °C bildas acetylen:
4. Isomerisering. När linjära kolväten värms upp med en isomeriseringskatalysator (aluminiumklorid), ämnen med grenat kolskelett:

5. Aromatisering. Alkaner med sex eller fler kolatomer i kedjan cykliserar i närvaro av en katalysator för att bilda bensen och dess derivat:

Alkaner går in i reaktioner som fortskrider enligt mekanismen för fria radikaler, eftersom alla kolatomer i alkanmolekyler är i ett tillstånd av sp 3-hybridisering. Molekylerna av dessa ämnen är byggda med hjälp av kovalenta opolär C-C(kol - kol) bindningar och svagt polära C-H (kol - väte) bindningar. De innehåller inte områden med ökad eller minskad elektrontäthet, eller lätt polariserbara bindningar, dvs sådana bindningar där elektrondensiteten kan förskjutas under påverkan av yttre faktorer (elektrostatiska jonfält). Följaktligen kommer alkaner inte att reagera med laddade partiklar, eftersom bindningarna i alkanmolekyler inte bryts av den heterolytiska mekanismen.
Mättade kolväten är föreningar som är molekyler som består av kolatomer i ett tillstånd av sp 3 hybridisering. De är anslutna till varandra uteslutande genom kovalenta sigmabindningar. Namnet "mättade" eller "mättade" kolväten kommer från det faktum att dessa föreningar inte har förmågan att fästa några atomer. De är extrema, helt mättade. Undantaget är cykloalkaner.
Vad är alkaner?
Alkaner är mättade kolväten, och deras kolkedja är öppen och består av kolatomer anslutna till varandra med hjälp av enkelbindningar. Den innehåller inte andra (det vill säga dubbelbindningar som alkener eller trippelbindningar som alkyler). Alkaner kallas också paraffiner. De fick detta namn eftersom välkända paraffiner är en blandning av övervägande dessa mättade kolväten C 18 - C 35 med speciell inerthet.
Allmän information om alkaner och deras radikaler
Deras formel: C n P 2 n +2, här är n större än eller lika med 1. Den molära massan beräknas med formeln: M = 14n + 2. Funktion: Ädelsen i deras namn är "-an". Resterna av deras molekyler, som bildas som ett resultat av att väteatomer ersätts med andra atomer, kallas alifatiska radikaler eller alkyler. De betecknas med bokstaven R. Den allmänna formeln för envärda alifatiska radikaler: C n P 2 n +1, här är n större än eller lika med 1. Molmassan för alifatiska radikaler beräknas med formeln: M = 14n + 1. Ett karakteristiskt drag för alifatiska radikaler: ändelser i namnen "- silt." Alkanmolekyler har sina egna strukturella egenskaper:
- C-C-bindningen kännetecknas av en längd av 0,154 nm;
- CH-bindningen kännetecknas av en längd av 0,109 nm;
- bindningsvinkeln (vinkeln mellan kol-kolbindningar) är 109 grader och 28 minuter.

De börjar homolog serie alkaner: metan, etan, propan, butan och så vidare.
Fysikaliska egenskaper hos alkaner
Alkaner är ämnen som är färglösa och olösliga i vatten. Temperaturen vid vilken alkaner börjar smälta och temperaturen vid vilken de kokar ökar i enlighet med ökningen molekylvikt och längden på kolvätekedjan. Från mindre grenade till mer grenade alkaner minskar kokpunkten och smältpunkten. Gasformiga alkaner kan brinna med en ljusblå eller färglös låga och producera ganska mycket värme. CH 4 -C 4 H 10 är gaser som inte heller har någon lukt. C 5 H 12 - C 15 H 32 är vätskor som har en specifik lukt. C 15 H 32 och så vidare är fasta ämnen som också är luktfria.
Kemiska egenskaper hos alkaner
Dessa föreningar är kemiskt inaktiva, vilket kan förklaras av styrkan hos svårbrytbara sigmabindningar - C-C och C-H. Det är också värt att överväga det S-S anslutningarär opolära och CH är lågpolära. Dessa är lågpolariserade typer av bindningar som tillhör sigma-typen och följaktligen kommer de med största sannolikhet att brytas av en homolytisk mekanism, som ett resultat av vilket radikaler kommer att bildas. Således, Kemiska egenskaper alkaner är huvudsakligen begränsade till radikala substitutionsreaktioner.

Nitreringsreaktioner
Alkaner reagerar endast med salpetersyra med en koncentration av 10% eller med fyrvärd kväveoxid i en gasformig miljö vid en temperatur av 140°C. Nitreringsreaktionen av alkaner kallas Konovalov-reaktionen. Som ett resultat bildas nitroföreningar och vatten: CH 4 + salpetersyra (utspädd) = CH 3 - NO 2 (nitrometan) + vatten.
Förbränningsreaktioner
Mättade kolväten används mycket ofta som bränsle, vilket motiveras av deras förmåga att förbränna: C n P 2n+2 + ((3n+1)/2) O 2 = (n+1) H 2 O + n CO 2.
Oxidationsreaktioner
Alkanernas kemiska egenskaper inkluderar även deras förmåga att oxidera. Beroende på vilka förhållanden som följer med reaktionen och hur de ändras, kan olika slutprodukter erhållas från samma ämne. Mild oxidation av metan med syre i närvaro av en katalysator som accelererar reaktionen och en temperatur på cirka 200 ° C kan resultera i följande ämnen:
1) 2CH4 (oxidation med syre) = 2CH3OH (alkohol - metanol).
2) CH 4 (oxidation med syre) = CH 2 O (aldehyd - metanal eller formaldehyd) + H 2 O.
3) 2CH 4 (oxidation med syre) = 2HCOOH (karboxylsyra - metan eller myrsyra) + 2H 2 O.

Oxidationen av alkaner kan också utföras i ett gasformigt eller flytande medium med luft. Sådana reaktioner leder till bildning av högre fettalkoholer och motsvarande syror.
Förhållande till värme
Vid temperaturer som inte överstiger +150-250°C, alltid i närvaro av en katalysator, inträffar en strukturell omarrangering av organiska ämnen, som består av en förändring i ordningsföljden för anslutningen av atomer. Denna process kallas isomerisering, och de ämnen som blir resultatet av reaktionen kallas isomerer. Från normal butan erhålls alltså dess isomer - isobutan. Vid temperaturer på 300-600°C och närvaron av en katalysator bryts C-H-bindningar med bildandet av vätemolekyler (dehydreringsreaktioner), vätemolekyler med stängning av kolkedjan i en cykel (cykliserings- eller aromatiseringsreaktioner av alkaner) :
1) 2CH4 = C2H4 (eten) + 2H2.
2) 2CH4 = C2H2 (etyn) + 3H2.
3) C7H16 (normal heptan) = C6H5 - CH3 (toluen) + 4 H2.

Halogeneringsreaktioner
Sådana reaktioner involverar införandet av halogener (deras atomer) i molekylen av ett organiskt ämne, vilket resulterar i bildandet av en C-halogenbindning. När alkaner reagerar med halogener bildas halogenderivat. Denna reaktion har specifika egenskaper. Det fortsätter enligt en radikal mekanism, och för att initiera det är det nödvändigt att utsätta blandningen av halogener och alkaner för ultraviolett strålning eller helt enkelt värma den. Alkanernas egenskaper tillåter halogeneringsreaktionen att fortgå tills fullständig ersättning med halogenatomer uppnås. Det vill säga, kloreringen av metan kommer inte att sluta i ett steg och produktionen av metylklorid. Reaktionen kommer att gå längre, alla möjliga substitutionsprodukter kommer att bildas, som börjar med klormetan och slutar med koltetraklorid. Exponering av andra alkaner för klor under dessa förhållanden kommer att resultera i bildning av olika produkter som ett resultat av substitution av väte vid olika kolatomer. Temperaturen vid vilken reaktionen sker bestämmer förhållandet mellan slutprodukterna och hastigheten för deras bildning. Ju längre kolvätekedjan i alkanen är, desto lättare blir reaktionen. Under halogeneringen kommer den minst hydrerade (tertiära) kolatomen att ersättas först. Den primära kommer att reagera efter alla de andra. Halogeneringsreaktionen kommer att ske i steg. I det första steget ersätts endast en väteatom. Med lösningar av halogener (klor och bromvatten) alkaner interagerar inte.

Sulfokloreringsreaktioner
De kemiska egenskaperna hos alkaner kompletteras också av sulfokloreringsreaktionen (kallad Reed-reaktionen). När de utsätts för ultraviolett strålning kan alkaner reagera med en blandning av klor och svaveldioxid. Som ett resultat bildas väteklorid, liksom en alkylradikal, som tillför svaveldioxid. Resultatet är en komplex förening som blir stabil på grund av infångningen av en kloratom och förstörelsen av dess nästa molekyl: R-H + SO 2 + Cl 2 + ultraviolett strålning = R-SO 2 Cl + HCl. Sulfonylkloriderna som bildas som ett resultat av reaktionen används i stor utsträckning vid framställning av ytaktiva ämnen.
Mättade kolväten, eller paraffiner, är de bioföreningar i vars molekyler kolatomerna är förbundna med en enkel (enkel)bindning, och alla andra valensenheter är mättade med väteatomer.
Alkaner: fysikaliska egenskaper
Utvinningen av väte från en alkanmolekyl, eller dehydrering, i närvaro av katalysatorer och vid upphettning (upp till 460 °C) gör att man kan erhålla de nödvändiga alkenerna. Metoder har utvecklats för oxidation av alkaner vid låga temperaturer i närvaro av katalysatorer (magnesiumsalter). Detta gör att du specifikt kan påverka reaktionsförloppet och få de nödvändiga oxidationsprodukterna i processen för kemisk syntes. Till exempel producerar oxidationen av högre alkaner olika högre alkoholer eller högre fettsyror.
Spjälkning av alkaner sker även under andra förhållanden (förbränning, sprickbildning). Mättade kolväten brinner med en blå låga och frigör enorma mängder värme. Dessa egenskaper gör det möjligt att använda dem som ett högkaloribränsle både i vardagen och i industrin.
Sida 1
Kemiska egenskaper hos alkaner.
Alla bindningar i alkaner är lågpolära, varför de kännetecknas av radikala reaktioner. Frånvaron av pi-bindningar gör additionsreaktioner omöjliga. Alkaner kännetecknas av substitution, eliminering och förbränningsreaktioner.
|
Typ och namn på reaktion |
Exempel |
|
1. Substitutionsreaktioner | |
|
A) med halogener(Med klorCl 2 -i ljuset, Br 2 - vid uppvärmning) reaktionen lyder Markovniks regel (Markovnikovs regler ) - främst en halogenersätter väte iminst hydrerad ny kolatom. Reaktion sker i etapper - i ett skede ersatt inte mer än en väteatom. Jod reagerar svårast, och dessutom slutförs reaktionen inte, eftersom till exempel, när metan reagerar med jod, bildas vätejodid, som reagerar med metyljodid för att bilda metan och jod (reversibel reaktion): |
CH 4 + Cl 2 → CH 3 Cl + HCl (klormetan) CH 3 Cl + Cl 2 → CH 2 Cl 2 + HCl (diklormetan) CH 2 Cl 2 + Cl 2 → CHCl 3 + HCl (triklormetan) CHCI3 + Cl2 → CCI4 + HCl (koltetraklorid). |
B) Nitrering (Konovalov-reaktion)Alkaner reagerar med 10% salpetersyra eller kväveoxid N 2O4 i gasfas vid en temperatur av 140° och lågt tryck med bildning av nitroderivat. Reaktionen lyder också Markovnikovs regel. HANDLA OM dyn av väteatomerna ersätts med en NO-rest 2 (nitrogrupp) och vatten frigörs | |
|
2. Elimineringsreaktioner | |
|
A) dehydrering– eliminering av väte. Reaktionsförhållanden: katalysator – platina och temperatur. |
CH3 - CH3 → CH2 = CH2 + H2
|
|
B) sprickbildning processen för termisk sönderdelning av kolväten, som är baserad på reaktionerna för att splittra kolkedjan i stora molekyler för att bilda föreningar med en kortare kedja. Vid en temperatur på 450–700 o C-alkaner sönderdelas på grund av bindningsklyvning S–S (starkare kopplingar S–H bevaras vid denna temperatur) och alkaner och alkener med ett mindre antal kolatomer bildas |
C6H14C2H6 + C4H8 |
|
B) fullständig termisk sönderdelning |
CH4C + 2H2 |
|
3. Oxidationsreaktioner | |
|
A) förbränningsreaktion Vid antändning (t = 600 o C) reagerar alkaner med syre, och de oxideras till koldioxid och vatten. |
C n H 2n+2 + O 2 ––>CO 2 + H 2 O + Q CH 4 + 2O 2 ––>CO 2 + 2H 2 O + Q |
|
B) Katalytisk oxidation-vid en relativt låg temperatur och med användning av katalysatorer åtföljs den av att endast en del av C–C-bindningarna brister ungefär i mitten av molekylen och C–H och används för att erhålla värdefulla produkter: karboxylsyror, ketoner , aldehyder, alkoholer. |
Till exempel, med ofullständig oxidation av butan (klyvning av C 2 – C 3-bindningen), erhålls ättiksyra |
|
4. Isomeriseringsreaktioner är inte typiska för alla alkaner. Uppmärksamhet uppmärksammas på möjligheten att omvandla vissa isomerer till andra och närvaron av katalysatorer. |
C4H10C4H10 |
|
5.. Alkaner med en huvudkedja på 6 eller fler kolatomer också reageradehydrocyklisering men bildar alltid en 6-ledad ring (cyklohexan och dess derivat). Under reaktionsförhållanden genomgår denna cykel ytterligare dehydrering och förvandlas till den energimässigt mer stabila bensenringen av ett aromatiskt kolväte (aren). |
 |
Metoder för att erhålla alkaner.
Alkaner erhålls i stora mängder från naturgas och olja.
Från enkla ämnen i en elektrisk urladdning:
Hydrolys av aluminiumkarbid
Uppvärmning av monohaloalkaner med natriummetall (Wurtz-reaktion)
Om haloalkanerna är olika blir resultatet en blandning av tre produkter:
Dekarboxylering. Fusion av natriumacetat med alkali. Alkanen som produceras på detta sätt kommer att ha en kolatom mindre.
Hydrolys av Grignard-reagens:
Alkaner med en symmetrisk struktur kan erhållas genom elektrolys av salter av karboxylsyror. (Kolb reaktion)
Sida 1
- I kontakt med 0
- Google+ 0
- OK 0
- Facebook 0