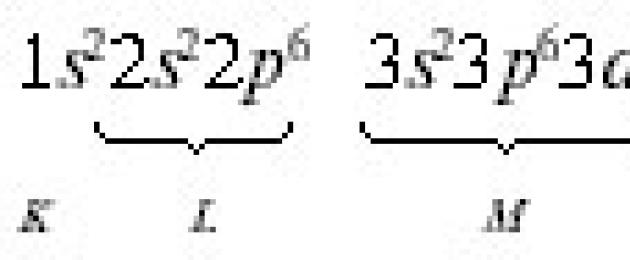La distribución de electrones en un átomo se realiza de acuerdo con 3 disposiciones de la mecánica cuántica: el principio de Pauli; el principio de energía mínima; La regla de Hund.
Según el principio de Pauli Un átomo no puede tener dos electrones con los mismos valores de los cuatro números cuánticos. El principio de Pauli determina el número máximo de electrones en un orbital, nivel y subnivel. Dado que AO se caracteriza por tres números cuánticos norte, l, ml, los electrones de un orbital dado sólo pueden diferir en su número cuántico de espín EM. Pero EM solo puede tener dos valores +½ y -½.
En consecuencia, un orbital no puede contener más de dos electrones con espines opuestos. El número máximo de electrones en un nivel de energía se define como 2 norte 2 , y en el subnivel, como 2 (2 yo+1). El número máximo de electrones ubicados en diferentes niveles y subniveles se da en la tabla. 2.1.
Número máximo de electrones en niveles y subniveles cuánticos.
| Nivel de energía | Subnivel de energía | Posibles valores del número cuántico magnético. ml | Número de sociedades anónimas en | Número máximo de electrones por | ||
| subnivel | nivel | subnivel | nivel | |||
| k (norte= 1) | s (yo= 0) | |||||
| l (norte= 2) | s (yo= 0) pag (yo= 1) | -1, 0, 1 | ||||
| METRO (norte= 3) | s (yo= 0) pag (yo= 1) d (yo= 2) | -1, 0, 1 -2, -1, 0, 1, 2 | ||||
| norte (norte= 4) | s (yo= 0) pag (yo= 1) d (yo= 2) F (yo= 3) | -1, 0, 1 -2, -1, 0, 1, 2 -3, -2, -1, 0, 1, 2, 3 |
La secuencia de llenado de orbitales con electrones se lleva a cabo de acuerdo con principio de energía mínima, por lo cual los electrones llenan los orbitales en orden creciente del nivel de energía de los orbitales. Se determina el orden de los orbitales en energía. La regla de Klechkovsky : el aumento de energía y, en consecuencia, el llenado de los orbitales se produce en orden creciente de la suma (n + l), y con una suma igual (n + l), en orden creciente de n.
El orden de distribución de electrones entre los niveles y subniveles de energía en la capa de un átomo. se llama Configuración electrónica. Al escribir una configuración electrónica, el número de nivel (número cuántico principal) se indica con los números 1, 2, 3, 4..., el subnivel (número cuántico orbital) con letras. s,p,d,f. El número de electrones en un subnivel se indica mediante un número escrito en la parte superior del símbolo del subnivel. Por ejemplo, la configuración electrónica de un átomo de azufre es 16 S 1 s 2 2s 2 2pag 6 3s 2 3pag 4, y vanadio 23 V 1 s 2 2s 2 2pag 6 3s 2 3pag 6 3d°/i> 3 4 s 2 .
Las propiedades químicas de los átomos están determinadas principalmente por la estructura de los niveles de energía externos, que se denominan valencia. Niveles de energía completamente completados en interacción química no participes. Por lo tanto, en aras de la brevedad al registrar la configuración electrónica de un átomo, a menudo se los denota con el símbolo del gas noble que los precede. Entonces, para el azufre: 3 s 2 3pag 4; para vanadio: 3 d 3 4s 2. Al mismo tiempo, la notación abreviada resalta claramente los electrones de valencia que determinan Propiedades químicasátomos del elemento.
Dependiendo de qué subnivel del átomo se llena en último lugar, todos los elementos químicos se dividen en 4 familias electrónicas: s-, p-, d-, f- elementos. Los elementos cuyos átomos son los últimos en llenar el subnivel s del nivel exterior se llaman elementos s.. Ud. s- los elementos de valencia son s-electrones del nivel energético exterior.
Ud. elementos p, el subnivel p del nivel exterior se llena en último lugar. Sus electrones de valencia se encuentran en pag- Y s- subcapas de la capa exterior. Ud. elementos d, el subnivel d del nivel preexterno se llena en último lugar y valencia son s- electrones del exterior y d- electrones de los niveles de energía preexternos. Ud. elementos f, el último en llenarse es el subnivel f del tercer nivel de energía exterior.
La configuración electrónica de un átomo también se puede representar mediante diagramas de la disposición de los electrones en células cuánticas, que son una representación gráfica del orbital atómico. Cada celda cuántica no puede contener más de dos electrones con espines opuestos. El orden de colocación de los electrones dentro de un subnivel está determinado por la regla de Hund: Dentro de un subnivel, los electrones se colocan de manera que su espín total sea máximo. En otras palabras, los orbitales de un subnivel determinado se llenan primero con un electrón con los mismos espines y luego con un segundo electrón con espines opuestos.
Giro total R- electrones del tercer nivel de energía del átomo de azufre S EM= ½ - ½ + ½ + ½ = 1; d-electrones del átomo de vanadio -
S EM= ½ + ½ + ½ = 3/2.
A menudo, no se representa gráficamente toda la fórmula electrónica, sino solo aquellos subniveles en los que se encuentran los electrones de valencia, por ejemplo,
16 T…3 s 2 3pag 4; 23V…3 d 3 4s 2 .
Al representar gráficamente la configuración electrónica de un átomo en un estado excitado, los orbitales de valencia vacantes se representan junto con los llenos. Por ejemplo, en el átomo de fósforo en el tercer nivel de energía hay uno s-AO, tres R-AO y cinco d-AO. La configuración electrónica del átomo de fósforo en el estado fundamental tiene la forma
15 r... 3 s 2 3pag 3 .
La valencia del fósforo, determinada por el número de electrones no apareados, es igual a 3. Cuando un átomo pasa a un estado excitado, los electrones del estado 3 se aparean. s y uno de los electrones con s-el subnivel puede ir a d-subnivel:
P*… 3 t 2 3pag 3 3d 1
En este caso, la valencia del fósforo cambia de tres (PCl 3) en el estado fundamental a cinco (PCl 5) en el estado excitado.
COMPOSICIÓN Y ELECTRÓNICA
ESTRUCTURA ATOMICA
INSTRUCCIONES METODOLÓGICAS Y TAREAS DE CONTROL
AL PROGRAMA DE FORMACIÓN PARA ESTUDIANTES
CLASES ESPECIALIZADAS
ESCUELAS DE EDUCACIÓN COMÚN
Continuación. Ver el comienzo en № 4, 6/2005
Pautas
17. Teniendo en cuenta los patrones descritos, considere el estado y la distribución de los electrones en los niveles de energía y orbitales de los átomos de potasio ( z= 19) y escandio ( z = 21).
Solución
1) El elemento que precede al potasio en PSCE es el argón ( z= 18) tiene la siguiente distribución de electrones:
a) por niveles atómicos:
b) según los orbitales del átomo:
Fórmula electrónica del átomo de argón:
![]()
Fórmula gráfica electrónica del átomo de argón:
Al distribuir electrones en el átomo K de acuerdo con la regla de Klechkovsky, se da preferencia al orbital 4 s(suma de números cuánticos norte + yo igual a: 4 + 0 = 4) en comparación con el orbital 3 d(suma de números cuánticos norte + yo igual a: 3 + 2 = 5) como el orbital que tiene el valor mínimo norte + l. En consecuencia, para el átomo de potasio, la distribución de electrones sobre orbitales (fórmula gráfica electrónica) tiene la forma (ver párrafo 16 instrucciones metodológicas):
El potasio pertenece a s-elementos con la siguiente fórmula electrónica (configuración) del átomo:
![]()
La distribución del nivel de energía de los electrones para el átomo de K se muestra a continuación:

2) El elemento que precede al escandio en PSCE es el calcio ( z= 20) tiene la siguiente distribución de electrones:
a) por niveles atómicos:

b) según los orbitales del átomo:
Fórmula electrónica del átomo de calcio:

De los orbitales 3 d (norte + yo es igual a: 3 + 2 = 5) y 4 pag (norte + yo es igual a: 4 + 1 = 5) al distribuir electrones en un átomo de escandio entre orbitales, se debe dar preferencia a 3 d-orbital por tener el valor mínimo norte= 3 para las mismas sumas de números cuánticos ( norte + yo) igual a cinco. Por tanto, el escandio pertenece a d-elementos, y su átomo se caracteriza por la siguiente distribución de electrones entre orbitales:
Fórmula electrónica del átomo de escandio:

La distribución del nivel de energía de los electrones para el átomo de Sc se muestra a continuación:

18. Completa el dibujo para mostrar la apariencia de uno. s-orbitales y tres R-orbitales orientados a lo largo de los ejes.

Tabla 5
Distribución de electrones
por niveles y subniveles cuánticos
| Caparazón | Energía nivel norte |
Energía subnivel yo |
Magnético número metro |
Número orbitales |
Límite número electrones |
||||
|---|---|---|---|---|---|---|---|---|---|
| k | 1 | 0(s) | 0 | 1 | 2 | ||||
| l | 2 | 0(s) 1 (pag.) |
+1, 0, –1 |
|
|
||||
| METRO | 3 | 0(s) 1 (pag.) 2(d) |
0
1, 0, –1 |
|
|
||||
| norte | 4 | 0(s) 1 (pag.) 2(d) 3(f) |
0 +1, 0, –1 +2, +1, 0, –1, –2 +3, +2, +1, 0, –1, –2, –3 |
|
|
20. Para conocer la secuencia de llenado de los niveles de energía de los átomos, consulte la tabla. 6.
21. El número de elementos en un período de la tabla de D. I. Mendeleev está determinado por las fórmulas:
a) para períodos impares:
ln = (norte + 1) 2 /2,
b) para períodos pares:
ln = (norte + 2) 2 /2,
Dónde ln– número de elementos en el período, norte– número de período.
Definir el número de elementos en cada período del PSHE de D.I. Mendeleev.
Explicar:
a) el patrón numérico resultante desde el punto de vista del estado de los electrones en los átomos y su distribución entre niveles de energía;
b) división de grupos de elementos en subgrupos principales y secundarios;
c) la predeterminación del número de subgrupos principales y secundarios en el PSHE de D.I. Mendeleev desde el punto de vista de la teoría de la estructura atómica.
Controlar en el futuro, sus conclusiones sobre el Apéndice 1 (P-21).
22. La estricta periodicidad de la disposición de los elementos en el PSHE de D. I. Mendeleev se explica completamente por el llenado secuencial de los niveles de energía de los átomos (ver párrafo 20 arriba). Fortalecimiento de posiciones ley periódica El descubrimiento del elemento número 72 contribuyó a los patrones de cambios en la estructura electrónica de los átomos de los elementos, predichos por primera vez por N. Bohr. Los químicos buscaron el elemento entonces no descubierto entre minerales que contienen tierras raras, basándose en la premisa incorrecta de que 15 elementos deberían clasificarse como lantánidos.
Por analogía con los elementos de transición, el número de lantánidos (elementos 58 a 71) debe ser igual a la diferencia entre el número máximo de electrones por norte Y METRO niveles de energía
(32 – 18 = 14), es decir, igual al número máximo de electrones por F-subnivel (véase el párrafo 19 supra). Elemento con z= 72 (hafnio Hf) es un análogo del circonio Zr y se ha encontrado en minerales de circonio.
23. Próximo conclusión importante del análisis de la tabla. 6 en el párrafo 20 es la conclusión sobre la periodicidad del llenado de los niveles de energía externos de los átomos con electrones, que determina la periodicidad de los cambios en las propiedades químicas de los elementos y sus compuestos.
Tabla 6
Configuraciones electrónicas de átomos.
primeros 20 elementos de la tabla periódica
| Atómico número |
Oboz- significado |
Capa | k | l | METRO | norte |
| norte | 1 | 2 | 3 | 4 | ||
| yo | 0 | 0, 1 | 0, 1, 2 | 0, 1, 2, 3 | ||
| Subnivel | 1s | 2s, 2pag | 3s, 3pag, 3d | 4s, 4pag, 4d, 4F | ||
| Número de electrones en un subnivel dado | ||||||
| 1 2 |
h Él |
1 2 |
||||
| 3 4 5 6 7 8 9 10 |
li Ser B C norte oh F Nordeste |
2 2 2 2 2 2 2 2 |
1, 0 2, 0 2, 1 2, 2 2, 3 2, 4 2, 5 2, 6 |
|||
| 11 12 13 14 15 16 17 18 |
N / A magnesio Alabama Si PAG S CL Arkansas |
2 2 2 2 2 2 2 2 |
2, 6 2, 6 2, 6 2, 6 2, 6 2, 6 2, 6 2, 6 |
1, 0, 0 2, 0, 0 2, 1, 0 2, 2, 0 2, 3, 0 2, 4, 0 2, 5, 0 2, 6, 0 |
||
| 19 20 |
k California |
2 2 |
2, 6 2, 6 |
2, 6, 0 2, 6, 0 |
1, 0, 0, 0 2, 0, 0, 0 |
|
Así, el segundo período de la tabla de D.I. Mendeleev consta de ocho elementos con los siguientes subniveles:
|
Durante la transición del litio al neón, la carga del núcleo atómico aumenta gradualmente de z= 3 a z= 10, lo que significa que las fuerzas de atracción de los electrones hacia el núcleo aumentan y, como resultado, los radios de los átomos de estos elementos disminuyen. Por tanto, la capacidad de un átomo para donar electrones (una propiedad típicamente metálica), pronunciada en el átomo de litio, se debilita gradualmente al pasar del litio al flúor. Este último es un no metal típico, es decir, un elemento más capaz que otros de adquirir electrones.
A partir del elemento al lado del neón (Na, z= 11) las estructuras electrónicas de los átomos se repiten y, por lo tanto, las configuraciones electrónicas de sus capas electrónicas externas se designan de manera similar ( norte– número de período):
ns 1 (Li,Na), ns 2 (Be, Mg), ns 2 notario público. 1 (B,Al), ns 2 notario público. 2 (C,Si) etc.
En el cuarto período de la tabla de D.I. Mendeleev aparecen elementos de transición que pertenecen a subgrupos secundarios.
24. Los elementos que pertenecen al mismo subgrupo tienen una disposición similar de electrones en los niveles electrónicos externos de los átomos. Por ejemplo, todos los átomos de halógeno (el subgrupo principal del grupo VII) tienen la configuración electrónica ns 2 notario público. 5, y los átomos de elementos de un subgrupo lateral del mismo grupo se caracterizan por una configuración electrónica ( norte– 1)s 2 (norte– 1)pag 6 (norte– 1)d 5 ns 2 .
¿Cuál es la esencia de las similitudes y diferencias entre átomos de elementos que pertenecen a diferentes subgrupos del mismo grupo de la tabla de D.I. Mendeleev? En el futuro, consulte sus conclusiones con el Apéndice 1 (P-24).
25. El valor numérico de la valencia de un átomo, determinado por el número de enlaces químicos covalentes formados por él, refleja la posición del elemento en el PSCE de D.I. Mendeleev. En muchos casos, la valencia de un átomo elemental en un compuesto es numéricamente igual al número de grupo en el PSHE de D.I. Mendeleev. Sin embargo, hay excepciones para esta regla. Por ejemplo, el átomo de fósforo en el exterior (tercero, METRO) el nivel de energía contiene tres electrones desapareados (3 R-orbitales) y células de valencia libres d-orbitales. En consecuencia, el átomo de fósforo se caracteriza por el llamado excitación electrón, asociado con el emparejamiento de un par de electrones y la transición de uno de los electrones desapareados resultantes a 3 d-orbital. Para el estado excitado del átomo de fósforo, la formación de cinco enlaces covalentes, y para el principal, solo tres.

Para el átomo de nitrógeno, el estado excitado es atípico, ya que en este átomo en el nivel de energía externa el número y estado de los electrones es el mismo que en el átomo de fósforo, pero no hay celdas vacantes y solo faltan tres electrones para el átomo. finalización y estabilidad de este nivel.
¿Por qué entonces la valencia máxima del átomo de nitrógeno en los compuestos (es decir, la capacidad de formar pares de electrones comunes) no es III, sino IV?
26. Repetir párrafos. 16, 17 desarrollo metodológico, podemos explicar el orden en el que los electrones llenan los niveles de energía en los átomos de los elementos del 4to. período largo PSHE D.I.Mendeleev. La serie par de este período comienza con elementos de los subgrupos principales: 39 K y 40 Ca, que son metales típicos con valencia constante, y ya con el elemento número 21 ( z= 21, Sc) entonces hay elementos de subgrupos laterales llamados d- elementos o transitorios. Intente explicar la esencia de estos nombres y dé ejemplos relevantes. En el futuro, verifique la exactitud de sus conclusiones con el Apéndice 1 (P-26).
27.
El símbolo químico del hidrógeno H en el PSHE de D.I. Mendeleev también se encuentra en el subgrupo principal
Grupo I, y al subgrupo principal del Grupo VII. ¿Por qué es esto aceptable? Compruebe en el futuro la exactitud de sus conclusiones en el Apéndice 1 (P-27).
Tabla periódica de elementos de Mendeleev.
tabla periódica de elementos químicos (mesa de mendeleev) - clasificación elementos químicos, estableciendo la dependencia de diversas propiedades de los elementos de la carga del núcleo atómico.
Grupos
Un grupo o familia es una de las columnas. tabla periódica. Los grupos, por regla general, se caracterizan por tendencias periódicas expresadas de manera más significativa que los períodos o bloques.
De acuerdo con sistema internacional A los grupos de nombres se les asignan números del 1 al 18 en dirección de izquierda a derecha, desde metales alcalinos hasta gases nobles.
Periodos
El período es una fila de la tabla periódica. Dentro de un período, los elementos muestran ciertos patrones en los tres aspectos mencionados anteriormente (radio atómico, energía de ionización y electronegatividad), así como en la energía de afinidad electrónica.
Bloques
Debido a la importancia de la capa electrónica externa de un átomo, las diferentes regiones de la tabla periódica a veces se describen como bloques, nombrados según la capa en la que se encuentra el último electrón. El bloque S incluye los dos primeros grupos, es decir, alcalino y metales alcalinotérreos, así como hidrógeno y helio; El bloque p consta de los últimos seis grupos (del 13 al 18 según el estándar de denominación IUPAC, o del IIIA al VIIIA según el sistema americano) e incluye, entre otros elementos, todos los metaloides. El bloque D son los grupos del 3 al 12 (IUPAC), también son del IIIB al IIB en americano, que incluye todos los metales de transición. El bloque F, normalmente excluido de la tabla, está formado por lantánidos y actínidos.
La tabla periódica de D.I. Mendeleev se convirtió en el hito más importante en el desarrollo de la ciencia atómico-molecular. Gracias a ella todo salió bien. concepto moderno sobre un elemento químico, se aclararon ideas sobre sustancias y compuestos simples.
Composición y características del núcleo atómico.
Núcleo atómico- la parte central del átomo, en la que se concentra la mayor parte de su masa (más del 99,9%). El núcleo está cargado positivamente; la carga del núcleo está determinada por el elemento químico al que pertenece el átomo.
El núcleo atómico está formado por nucleones: protones cargados positivamente y neutrones neutros, que están conectados entre sí mediante interacciones fuertes.
El núcleo atómico, considerado como una clase de partículas con un determinado número de protones y neutrones, suele denominarse nucleido.
El número de protones en un núcleo se llama número de carga; este número es igual al número atómico del elemento al que pertenece el átomo en la tabla de Mendeleev (Tabla Periódica de Elementos). El número de protones en el núcleo determina la estructura de la capa electrónica de un átomo neutro y, por tanto, las propiedades químicas del elemento correspondiente. El número de neutrones en un núcleo se llama número isotópico. Núcleos con el mismo número de protones y diferentes numeros Los neutrones se llaman isótopos. Los núcleos que tienen el mismo número de neutrones pero distinto número de protones se llaman isótonos.
El número total de nucleones en un núcleo se llama número másico () y es aproximadamente igual a la masa promedio de un átomo que se muestra en la tabla periódica. Los nucleidos con el mismo número másico pero diferente composición protón-neutrón suelen denominarse isobaras.
Peso
Debido a la diferencia en el número de neutrones, los isótopos de un elemento tienen masas diferentes, lo cual es una característica importante del núcleo. En física nuclear, la masa de los núcleos suele medirse en unidades de masa atómica ( A. comer.), por uno a. em tomar 1/12 de la masa del nucleido 12 C [sn 2]. Cabe señalar que la masa estándar que suele darse para un nucleido es la masa de un átomo neutro. Para determinar la masa del núcleo, es necesario restar la suma de las masas de todos los electrones de la masa del átomo (se obtendrá un valor más preciso si también se tiene en cuenta la energía de enlace de los electrones con el núcleo) .
Además, en física nuclear se suele utilizar el equivalente energético de la masa. Según la relación de Einstein, cada valor de masa corresponde a la energía total:
¿Dónde está la velocidad de la luz en el vacío?
La relación entre a. e.m. y su energía equivalente en julios:
y como 1 electronvoltio = 1,602176·10 −19 J, entonces la energía equivalente es a. em en MeV es igual a
Radio
El análisis de la desintegración de núcleos pesados aclaró la estimación de Rutherford [sn 3] y relacionó el radio del núcleo con el número de masa mediante una relación simple:
donde es una constante.
Dado que el radio del núcleo no es puramente característica geométrica y está asociado principalmente con el radio de acción de las fuerzas nucleares, el valor depende del proceso durante cuyo análisis se obtuvo el valor, el valor promedio de m, por lo tanto, el radio del núcleo en metros.
Cargar
El número de protones en un núcleo determina directamente su carga eléctrica, los isótopos tienen la misma cantidad de protones, pero diferente cantidad de neutrones. .
Las cargas de los núcleos atómicos fueron determinadas por primera vez por Henry Moseley en 1913. El científico interpretó sus observaciones experimentales por la dependencia de la longitud de onda de los rayos X de una determinada constante, que varía en uno de un elemento a otro e igual a uno para el hidrógeno:
![]() , Dónde
, Dónde
Y - permanente.
Energía de enlace nuclear.
La energía de enlace del núcleo es igual a la energía mínima que se debe gastar para división completa núcleos en partículas individuales. De la ley de conservación de la energía se deduce que la energía de enlace es igual a la energía que se libera durante la formación de un núcleo a partir de partículas individuales.
La energía de enlace de cualquier núcleo se puede determinar midiendo con precisión su masa. Actualmente, los físicos han aprendido a medir las masas de partículas (electrones, protones, neutrones, núcleos, etc.) con una precisión muy alta. Estas mediciones muestran que masa de cualquier núcleo METRO I siempre es menor que la suma de las masas de sus protones y neutrones constituyentes.:
Esta energía se libera durante la formación de un núcleo en forma de radiación γ-cuantos.
Fuerzas nucleares.
Fuerzas nucleares son de acción corta efectivo. Aparecen sólo a distancias muy pequeñas entre nucleones en el núcleo del orden de 10 –15 m. La longitud (1,5 – 2,2) 10 –15 m se llama gama de fuerzas nucleares.
Las fuerzas nucleares descubren cargar independencia : La atracción entre dos nucleones es la misma independientemente del estado de carga de los nucleones: protón o neutrón. La independencia de carga de las fuerzas nucleares es visible al comparar las energías vinculantes. núcleos de espejo . Así se llaman los granos.,en el que el mismo numero total nucleones,pero el número de protones en uno es igual al número de neutrones en el otro.
Las fuerzas nucleares han propiedad de saturación , que se manifiesta en, que un nucleón en un núcleo interactúa sólo con un número limitado de nucleones vecinos. Por eso se observa dependencia lineal Energías de unión de los núcleos a partir de sus números másicos. A. En la partícula α, que es una formación muy estable, se logra una saturación casi completa de las fuerzas nucleares.
Las fuerzas nucleares dependen de orientaciones de giro nucleones interactuando. Esto lo confirma la diferente naturaleza de la dispersión de neutrones por las moléculas de orto y parahidrógeno. En una molécula de ortohidrógeno, los espines de ambos protones son paralelos entre sí, mientras que en una molécula de parahidrógeno son antiparalelos. Los experimentos han demostrado que la dispersión de neutrones en el parahidrógeno es 30 veces mayor que la dispersión en el ortohidrógeno. Las fuerzas nucleares no son centrales.
Entonces, enumeremos propiedades generales de las fuerzas nucleares :
· pequeño radio de acción de las fuerzas nucleares ( R~ 1 fm);
· gran potencial nuclear Ud.~50 MeV;
· dependencia de las fuerzas nucleares de los espines de las partículas que interactúan;
· naturaleza tensor de la interacción de nucleones;
· las fuerzas nucleares dependen de la orientación mutua del espín y de los momentos orbitales del nucleón (fuerzas espín-orbitales);
· la interacción nuclear tiene la propiedad de saturación;
· cargar la independencia de las fuerzas nucleares;
· naturaleza de intercambio de la interacción nuclear;
atracción entre nucleones a grandes distancias ( r> 1 fm), se reemplaza por repulsión en pequeñas ( r < 0,5 Фм).
6.6. Características de la estructura electrónica de átomos de cromo, cobre y algunos otros elementos.
Si ha examinado detenidamente el Apéndice 4, probablemente haya notado que, para los átomos de algunos elementos, la secuencia de llenado de orbitales con electrones está alterada. A veces estas violaciones se llaman "excepciones", pero no es así: ¡no hay excepciones a las leyes de la Naturaleza!
El primer elemento con este trastorno es el cromo. Echemos un vistazo más de cerca a su estructura electrónica (figura 6.16). A). El átomo de cromo tiene 4 s-No hay dos subniveles, como cabría esperar, sino un solo electrón. pero a las 3 d-el subnivel tiene cinco electrones, pero este subnivel se llena después de 4 s-subnivel (ver Fig. 6.4). Para entender por qué sucede esto, veamos qué son las nubes de electrones 3 d-subnivel de este átomo.
Cada uno de cinco 3 d-las nubes en este caso están formadas por un electrón. Como ya sabe por el § 4 de este capítulo, la nube electrónica total de estos cinco electrones tiene forma esférica o, como dicen, esféricamente simétrica. Según la naturaleza de la distribución de la densidad electrónica en diferentes direcciones, es similar a 1 s-EO. La energía del subnivel cuyos electrones forman dicha nube resulta ser menor que en el caso de una nube menos simétrica. En este caso, la energía orbital es 3 d-subnivel es igual a energía 4 s-orbitales. Cuando se rompe la simetría, por ejemplo, cuando aparece un sexto electrón, la energía de los orbitales es 3 d-el subnivel vuelve a ser mayor que la energía 4 s-orbitales. Por tanto, el átomo de manganeso vuelve a tener un segundo electrón en 4 s-AO.
La nube general de cualquier subnivel, llena de electrones hasta la mitad o por completo, tiene simetría esférica. La disminución de energía en estos casos es de carácter general y no depende de si algún subnivel está medio o completamente lleno de electrones. Y si es así, entonces debemos buscar la siguiente violación en el átomo en cuya capa electrónica el noveno “llega” en último lugar. d-electrón. De hecho, el átomo de cobre tiene 3 d-el subnivel tiene 10 electrones y 4 s- sólo un subnivel (Fig. 6.16 b).
La disminución de la energía de los orbitales de un subnivel lleno o medio lleno provoca una serie de fenómenos químicos importantes, algunos de los cuales conocerá usted.
6.7. Electrones, orbitales y subniveles externos y de valencia.
En química, las propiedades de los átomos aislados, por regla general, no se estudian, ya que casi todos los átomos, cuando se incluyen en diversas sustancias, forman enlaces químicos. Los enlaces químicos se forman mediante la interacción de las capas electrónicas de los átomos. Para todos los átomos (excepto el hidrógeno), no todos los electrones participan en la formación de enlaces químicos: el boro tiene tres de cinco electrones, el carbono cuatro de seis y, por ejemplo, el bario tiene dos de cincuenta y seis. Estos electrones "activos" se llaman electrones de valencia.
Los electrones de valencia a veces se confunden con externo electrones, pero esto no es lo mismo.
Las nubes electrónicas de electrones externos tienen un radio máximo (y un valor máximo del número cuántico principal).

Son los electrones externos los que participan en primer lugar en la formación de enlaces, aunque sólo sea porque cuando los átomos se acercan entre sí, las nubes de electrones formadas por estos electrones entran en contacto en primer lugar. Pero junto con ellos, algunos electrones también pueden participar en la formación de un enlace. preexterno(penúltima) capa, pero sólo si tienen una energía no muy diferente de la energía de los electrones externos. Ambos electrones de un átomo son electrones de valencia. (En los lantánidos y actínidos, incluso algunos electrones “externos” son de valencia)
La energía de los electrones de valencia es mucho mayor que la energía de otros electrones del átomo, y los electrones de valencia difieren mucho menos en energía entre sí.
Los electrones externos son siempre electrones de valencia sólo si el átomo puede formar enlaces químicos. Por tanto, ambos electrones del átomo de helio son externos, pero no pueden llamarse valencia, ya que el átomo de helio no forma ningún enlace químico en absoluto.
Los electrones de valencia ocupan orbitales de valencia, que a su vez forman subniveles de valencia.

Como ejemplo, consideremos un átomo de hierro, cuya configuración electrónica se muestra en la figura. 6.17. De los electrones de un átomo de hierro, el número cuántico principal máximo ( norte= 4) tiene solo dos 4 s-electrón. En consecuencia, son los electrones externos de este átomo. Los orbitales externos del átomo de hierro son todos orbitales con norte= 4, y los subniveles exteriores son todos los subniveles formados por estos orbitales, es decir, 4 s-,
4pag-, 4d- y 4 F-EPU.
Los electrones externos son siempre electrones de valencia, por lo tanto 4 s-los electrones del átomo de hierro son electrones de valencia. Y si es así, entonces 3 d-los electrones con energía ligeramente superior también serán electrones de valencia. En el nivel externo del átomo de hierro, además del 4 lleno s-AO aun quedan 4 libres pag-, 4d- y 4 F-AO. Todos ellos son externos, pero sólo 4 de ellos son de valencia. R-AO, ya que la energía del resto de orbitales es mucho mayor, y la aparición de electrones en estos orbitales no es beneficiosa para el átomo de hierro.
Entonces, el átomo de hierro
nivel electrónico externo – cuarto,
subniveles externos – 4 s-, 4pag-, 4d- y 4 F-EPU,
orbitales exteriores – 4 s-, 4pag-, 4d- y 4 F-AO,
electrones externos – dos 4 s-electrón (4 s 2),
capa electrónica exterior – cuarta,
nube de electrones externa – 4 s-EO
subniveles de valencia – 4 s-, 4pag-, y 3 d-EPU,
orbitales de valencia – 4 s-, 4pag-, y 3 d-AO,
electrones de valencia – dos 4 s-electrón (4 s 2) y seis 3 d-electrones (3 d 6).
Los subniveles de valencia pueden llenarse parcial o completamente con electrones, o pueden permanecer completamente libres. A medida que aumenta la carga nuclear, los valores de energía de todos los subniveles disminuyen, pero debido a la interacción de los electrones entre sí, la energía de diferentes subniveles disminuye a diferentes "velocidades". Energía completamente llena d- Y F-los subniveles disminuyen tanto que dejan de ser valencia.
Como ejemplo, consideremos los átomos de titanio y arsénico (figura 6.18).

En el caso del átomo de titanio 3 d-EPU está sólo parcialmente lleno de electrones y su energía es mayor que la energía 4. s-EPU, y 3 d-los electrones son valencia. El átomo de arsénico tiene 3 d-EPU está completamente lleno de electrones y su energía es significativamente menor que la energía de 4 s-EPU, y por lo tanto 3 d-los electrones no son valencia.
En los ejemplos dados, analizamos configuración electrónica de valenciaátomos de titanio y arsénico.
La configuración electrónica de valencia de un átomo se representa como fórmula del electrón de valencia, o en la forma diagrama de energía de los subniveles de valencia.
ELECTRONES DE VALENCIA, ELECTRONES EXTERNOS, EPU DE VALENCIA, AO DE VALENCIA, CONFIGURACIÓN DEL ELECTRÓN DE VALENCIA DE UN ÁTOMO, FÓRMULA DEL ELECTRÓN DE VALENCIA, DIAGRAMA DE SUBNIVELES DE VALENCIA.
1. En los diagramas de energía que has elaborado y en las fórmulas electrónicas completas de los átomos Na, Mg, Al, Si, P, S, Cl, Ar, indica los electrones externos y de valencia. Escribe las fórmulas electrónicas de valencia de estos átomos. En los diagramas de energía, resalte las partes correspondientes a los diagramas de energía de los subniveles de valencia.
2. ¿Qué tienen en común las configuraciones electrónicas de los átomos: a) Li y Na, B y Al, O y S, Ne y Ar; b) Zn y Mg, Sc y Al, Cr y S, Ti y Si; c) H y He, Li y O, K y Kr, Sc y Ga. Cuales son sus diferencias
3. ¿Cuántos subniveles de valencia hay en la capa electrónica de un átomo de cada elemento: a) hidrógeno, helio y litio, b) nitrógeno, sodio y azufre, c) potasio, cobalto y germanio?
4. ¿Cuántos orbitales de valencia están completamente llenos en el átomo de a) boro, b) flúor, c) sodio?
5. ¿Cuántos orbitales con un electrón desapareado tiene un átomo: a) boro, b) flúor, c) hierro?
6. ¿Cuántos orbitales exteriores libres tiene el átomo de manganeso? ¿Cuántas valencias libres?
7.Para la siguiente lección, prepare una tira de papel de 20 mm de ancho, divídala en celdas (20 × 20 mm) y aplique una serie natural de elementos (desde hidrógeno hasta meitnerio) a esta tira.
8.En cada celda, coloque el símbolo del elemento, su número atómico y la fórmula del electrón de valencia, como se muestra en la Fig. 6.19 (use el Apéndice 4).

6.8. Sistematización de átomos según la estructura de sus capas electrónicas.
La sistematización de elementos químicos se basa en la serie natural de elementos.
Y principio de similitud de capas de electrones sus átomos.
Ya estás familiarizado con la serie natural de elementos químicos. Ahora conozcamos el principio de similitud de carcasas electrónicas.
Considerando las fórmulas electrónicas de valencia de los átomos en el ERE, es fácil descubrir que para algunos átomos difieren sólo en los valores del número cuántico principal. Por ejemplo, 1 s 1 para hidrógeno, 2 s 1 para litio, 3 s 1 para sodio, etc. O 2 s 2 2pag 5 para flúor, 3 s 2 3pag 5 para cloro, 4 s 2 4pag 5 para bromo, etc. Esto significa que las regiones exteriores de las nubes de electrones de valencia de tales átomos son muy similares en forma y difieren solo en tamaño (y, por supuesto, en la densidad de electrones). Y si es así, entonces las nubes de electrones de dichos átomos y las correspondientes configuraciones de valencia pueden denominarse similar. Para átomos de diferentes elementos con configuraciones electrónicas similares podemos escribir fórmulas electrónicas de valencia generales: ns 1 en el primer caso y ns 2 notario público. 5 en el segundo. A medida que avanza por la serie natural de elementos, puede encontrar otros grupos de átomos con configuraciones de valencia similares.
De este modo, En la serie natural de elementos se encuentran regularmente átomos con configuraciones electrónicas de valencia similares..
Este es el principio de similitud de las carcasas electrónicas.
Intentemos identificar el tipo de esta regularidad. Para hacer esto, usaremos la serie natural de elementos que hiciste.

El ERE comienza con el hidrógeno, cuya fórmula electrónica de valencia es 1 s 1 . En busca de configuraciones de valencia similares, cortamos la serie natural de elementos delante de elementos con una fórmula electrónica de valencia común. ns 1 (es decir, antes del litio, antes del sodio, etc.). Recibimos los llamados "períodos" de los elementos. Agreguemos los "períodos" resultantes para que se conviertan en filas de la tabla (ver Fig. 6.20). Como resultado, sólo los átomos de las dos primeras columnas de la tabla tendrán configuraciones electrónicas similares.
Intentemos lograr similitudes en las configuraciones electrónicas de valencia en otras columnas de la tabla. Para hacer esto, recortamos de los períodos 6 y 7 los elementos con los números 58 – 71 y 90 –103 (llenan 4 F- y 5 F-subniveles) y colóquelos debajo de la mesa. Moveremos los símbolos de los elementos restantes horizontalmente como se muestra en la figura. Después de esto, los átomos de los elementos ubicados en la misma columna de la tabla tendrán configuraciones de valencia similares, que pueden expresarse mediante fórmulas electrónicas de valencia generales: ns 1 , ns 2 , ns 2 (norte–1)d 1 , ns 2 (norte–1)d 2 y así sucesivamente hasta ns 2 notario público. 6. Todas las desviaciones de las fórmulas generales de valencia se explican por las mismas razones que en el caso del cromo y el cobre (ver párrafo 6.6).
Como puede ver, utilizando el ERE y aplicando el principio de similitud de capas electrónicas, pudimos sistematizar elementos químicos. Este sistema de elementos químicos se llama natural, ya que se basa únicamente en las leyes de la Naturaleza. La tabla que recibimos (Fig. 6.21) es una de las formas de representar gráficamente un sistema natural de elementos y se llama Tabla de elementos químicos de período largo.

PRINCIPIO DE SIMILITUD DE CÁSCARAS ELECTRÓNICAS, SISTEMA NATURAL DE ELEMENTOS QUÍMICOS (SISTEMA "PERIÓDICO"), TABLA DE ELEMENTOS QUÍMICOS.
6.9. Tabla de elementos químicos de largo período.
Echemos un vistazo más de cerca a la estructura de la tabla de elementos químicos de período largo.
Las filas de esta tabla, como ya sabes, se denominan "períodos" de elementos. Los períodos están numerados con números arábigos del 1 al 7. El primer período tiene sólo dos elementos. El segundo y tercer período, que contienen ocho elementos cada uno, se denominan corto períodos. Los períodos cuarto y quinto, que contienen 18 elementos cada uno, se llaman largo períodos. Los períodos sexto y séptimo, que contienen 32 elementos cada uno, se llaman extra largo períodos.
Las columnas de esta tabla se llaman grupos elementos. Los números de grupo se indican mediante números romanos con letras latinas A o B.
Los elementos de algunos grupos tienen sus propios nombres comunes (de grupo): elementos del grupo IA (Li, Na, K, Rb, Cs, Fr) - elementos alcalinos(o elementos de metales alcalinos); Elementos del grupo IIA (Ca, Sr, Ba y Ra) – elementos alcalinotérreos(o elementos metálicos alcalinotérreos)(la denominación "metales alcalinos" y metales alcalinotérreos" se refiere a sustancias simples formadas por los elementos correspondientes y no debe utilizarse como nombres de grupos de elementos); elementos del grupo VIA (O, S, Se, Te, Po) – calcógenos, elementos del grupo VIIA (F, Cl, Br, I, At) – halógenos, elementos del grupo VIII (He, Ne, Ar, Kr, Xe, Rn) – elementos de gases nobles.(El nombre tradicional "gases nobles" también se refiere a sustancias simples)
Los elementos con números de serie 58 – 71 (Ce – Lu) normalmente colocados en la parte inferior de la tabla se denominan lantánidos(“siguiente al lantano”) y elementos con números de serie 90 – 103 (Th – Lr) – actínidos("siguiendo la anémona de mar"). Existe una versión de la tabla de períodos largos, en la que los lantánidos y actínidos no se eliminan del ERE, sino que permanecen en sus lugares durante períodos ultralargos. Esta tabla a veces se llama período ultralargo.
La tabla de período largo se divide en cuatro bloquear(o secciones).
bloque s incluye elementos de los grupos IA y IIA con fórmulas electrónicas de valencia comunes ns 1 y ns 2
(elementos s).
bloque r incluye elementos del Grupo IIIA al VIIIA con fórmulas electrónicas de valencia comunes de ns 2 notario público. 1 a ns 2 notario público. 6 (elementos p).
bloque d incluye elementos del grupo IIIB al IIB con fórmulas electrónicas de valencia comunes de ns 2 (norte–1)d 1 a ns 2 (norte–1)d 10 (elementos d).
bloque f incluye lantánidos y actínidos ( elementos f).

Elementos s- Y pag-los bloques forman grupos A y elementos d-bloque – grupo B del sistema de elementos químicos. Todo F-Los elementos se incluyen formalmente en el grupo IIIB.
Los elementos del primer período (hidrógeno y helio) son s-elementos y se pueden ubicar en los grupos IA y IIA. Pero el helio se coloca más a menudo en el grupo VIIIA como el elemento con el que finaliza el período, que corresponde plenamente a sus propiedades (el helio, como todas las demás sustancias simples formadas por elementos de este grupo, es un gas noble). El hidrógeno a menudo se coloca en el grupo VIIA, ya que sus propiedades son mucho más cercanas a las de los halógenos que a las de los elementos alcalinos.
Cada uno de los períodos del sistema comienza con un elemento que tiene una configuración de valencia de átomos. ns 1, ya que es a partir de estos átomos que comienza la formación de la siguiente capa electrónica y termina con un elemento con una configuración de átomos de valencia ns 2 notario público. 6 (excepto el primer período). Esto facilita identificar en el diagrama de energía grupos de subniveles llenos de electrones en los átomos de cada período (figura 6.22). Haga este trabajo con todos los subniveles que se muestran en la copia que hizo de la Figura 6.4. Los subniveles resaltados en la Figura 6.22 (excepto los completamente llenos) d- Y F-subniveles) son la valencia de los átomos de todos los elementos de un período determinado.
Aparición en periodos s-, pag-, d- o F-los elementos corresponden completamente a la secuencia de llenado s-, pag-, d- o F-subniveles con electrones. Esta característica del sistema de elementos permite, conociendo el período y grupo al que pertenece un determinado elemento, anotar inmediatamente su fórmula electrónica de valencia.
TABLA DE LARGO PERIODO DE ELEMENTOS QUÍMICOS, BLOQUES, PERIODOS, GRUPOS, ELEMENTOS ALCALINOS, ELEMENTOS ALCALINOTERRESTRE, CALCOGENOS, HALÓGENOS, ELEMENTOS DE GASES NOBLES, LANTANOIDES, ACTINOIDES.
¿Escribir las fórmulas electrónicas de valencia general de los átomos de los elementos de a) los grupos IVA y IVB, b) los grupos IIIA y VIIB?
2. ¿Qué tienen en común las configuraciones electrónicas de los átomos de los elementos de los grupos A y B? ¿En qué se diferencian?
3. ¿Cuántos grupos de elementos se incluyen en a) s-Bloque B) R-Bloque C) d-¿bloquear?
4.Continúe la Figura 30 en la dirección de aumentar la energía de los subniveles y resalte grupos de subniveles llenos de electrones en los períodos 4, 5 y 6.
5. Enumere los subniveles de valencia de a) calcio, b) fósforo, c) titanio, d) cloro, e) átomos de sodio. 6. Indique en qué se diferencian los elementos s, p y d entre sí.
7. Explique por qué la pertenencia de un átomo a cualquier elemento está determinada por el número de protones en el núcleo y no por la masa de este átomo.
8. Para los átomos de litio, aluminio, estroncio, selenio, hierro y plomo, componga fórmulas electrónicas de valencia, completas y abreviadas y dibuje diagramas de energía de los subniveles de valencia. 9. ¿Qué átomos de elementos corresponden a las siguientes fórmulas electrónicas de valencia: 3 s 1 , 4s 1 3d 1 , 2s 2 2 pag 6 , 5s 2 5pag 2 , 5s 2 4d 2 ?
6.10. Tipos de fórmulas electrónicas del átomo. Algoritmo para su compilación.
Para diferentes propósitos, necesitamos conocer la configuración total o de valencia de un átomo. Cada una de estas configuraciones electrónicas se puede representar mediante una fórmula o un diagrama de energía. Eso es, configuración electrónica completa de un átomo es expresado fórmula electrónica completa de un átomo, o diagrama de energía completo de un átomo. A su momento, configuración electrónica de valencia de un átomo es expresado valencia(o como se suele llamar, " corto") fórmula electrónica del átomo, o diagrama de subniveles de valencia de un átomo(Figura 6.23).

Anteriormente, hicimos fórmulas electrónicas para átomos usando los números atómicos de los elementos. Al mismo tiempo, determinamos la secuencia de llenado de subniveles con electrones según el diagrama de energía: 1 s, 2s,
2pag, 3s, 3pag, 4s, 3d, 4pag, 5s, 4d, 5pag,
6s, 4F, 5d, 6pag, 7s etcétera. Y sólo escribiendo la fórmula electrónica completa podríamos escribir la fórmula de valencia.
Es más conveniente escribir la fórmula electrónica de valencia de un átomo, que se usa con mayor frecuencia, en función de la posición del elemento en el sistema de elementos químicos, utilizando coordenadas de grupo de períodos.
Echemos un vistazo más de cerca a cómo se hace esto para los elementos. s-, pag- Y d-bloques
Para elementos s-la formula electronica de valencia en bloque de un atomo consta de tres simbolos. En general, se puede escribir de la siguiente manera:
En primer lugar (en lugar de la celda grande) se coloca el número del período (igual al número cuántico principal de estos s-electrones), y en el tercero (en superíndice) - el número de grupo (igual al número de electrones de valencia). Tomando como ejemplo el átomo de magnesio (3er período, grupo IIA), obtenemos:
Para elementos pag-La fórmula electrónica de valencia en bloque de un átomo consta de seis símbolos:
![]()
Aquí, en lugar de las celdas grandes, también se coloca el número de período (igual al número cuántico principal de estas s- Y pag-electrones), y el número de grupo (igual al número de electrones de valencia) resulta ser igual a la suma de los superíndices. Para el átomo de oxígeno (2º período, grupo VIA) obtenemos:
2s 2 2pag 4 .
Fórmula electrónica de valencia de la mayoría de los elementos. d-block se puede escribir así:
Como en casos anteriores, aquí en lugar de la primera celda se coloca el número del período (igual al número cuántico principal de estos s-electrones). El número de la segunda celda resulta ser uno menos, ya que el número cuántico principal de estos d-electrones. El número de grupo aquí también es igual a la suma de los índices. Ejemplo: fórmula electrónica de valencia del titanio (cuarto período, grupo IVB): 4 s 2 3d 2 .
El número de grupo es igual a la suma de los índices de los elementos del grupo VIB, pero, como recordarás, en su valencia s-El subnivel tiene un solo electrón y la fórmula electrónica de valencia general es ns 1 (norte–1)d 5 . Por lo tanto, la fórmula electrónica de valencia, por ejemplo, del molibdeno (quinto período) es 5 s 1 4d 5 .
También es fácil componer la fórmula electrónica de valencia de cualquier elemento del grupo IB, por ejemplo, oro (sexto período)>–>6 s 1 5d 10, pero en este caso debes recordar que d- Los electrones de los átomos de los elementos de este grupo siguen siendo de valencia y algunos de ellos pueden participar en la formación de enlaces químicos.
La fórmula electrónica de valencia general de los átomos de los elementos del grupo IIB es ns 2 (norte – 1)d 10 . Por tanto, la fórmula electrónica de valencia, por ejemplo, de un átomo de zinc es 4 s 2 3d 10 .
Reglas generales También obedecen las fórmulas electrónicas de valencia de los elementos de la primera tríada (Fe, Co y Ni). El hierro, un elemento del grupo VIIIB, tiene una fórmula electrónica de valencia de 4 s 2 3d 6. El átomo de cobalto tiene uno. d-electrón más (4 s 2 3d 7), y para el átomo de níquel, en dos (4 s 2 3d 8).
Usando sólo estas reglas para escribir fórmulas electrónicas de valencia, es imposible componer fórmulas electrónicas para los átomos de algunos d-elementos (Nb, Ru, Rh, Pd, Ir, Pt), ya que en ellos, debido al deseo de capas de electrones altamente simétricas, el llenado de los subniveles de valencia con electrones tiene algunas características adicionales.
Conociendo la fórmula electrónica de valencia, puedes escribir la fórmula electrónica completa del átomo (ver más abajo).
A menudo, en lugar de engorrosas fórmulas electrónicas completas, escriben fórmulas electrónicas abreviadasátomos. Para compilarlos en la fórmula electrónica se aíslan todos los electrones del átomo excepto los de valencia, se colocan sus símbolos entre corchetes, y la parte de la fórmula electrónica correspondiente a la fórmula electrónica del átomo del último elemento de la período anterior (el elemento que forma un gas noble) se reemplaza por el símbolo de este átomo.
En la Tabla 14 se dan ejemplos de fórmulas electrónicas de diferentes tipos.
Tabla 14. Ejemplos de fórmulas electrónicas de átomos.
Fórmulas electrónicas |
|||
Abreviado |
Valencia |
||
1s 2 2s 2 2pag 3 |
2s 2 2pag 3 |
2s 2 2pag 3 |
|
1s 2 2s 2 2pag 6 3s 2 3pag 5 |
3s 2 3pag 5 |
3s 2 3pag 5 |
|
1s 2 2s 2 2pag 6 3s 2 3pag 6 4s 2 3d 5 |
4s 2 3d 5 |
4s 2 3d 5 |
|
1s 2 2s 2 2pag 6 3s 2 3pag 6 3d 10 4s 2 4pag 3 |
4s 2 4pag 3 |
4s 2 4pag 3 |
|
1s 2 2s 2 2pag 6 3s 2 3pag 6 3d 10 4s 2 4pag 6 |
4s 2 4pag 6 |
4s 2 4pag 6 |
|
Algoritmo para compilar fórmulas electrónicas de átomos (usando el ejemplo del átomo de yodo)
№ |
Operación |
Resultado |
|
Determina las coordenadas del átomo en la tabla de elementos. |
Periodo 5, grupo VIIA |
||
Escribe la fórmula del electrón de valencia. |
5s 2 5pag 5 |
||
Complete los símbolos de los electrones internos en el orden en que llenan los subniveles. |
1s 2 2s 2 2pag 6 3s 2 3pag 6 4s 2 3d 10 4pag 6 5s 2 4d 10 5pag 5 |
||
Teniendo en cuenta la disminución de la energía de las personas completamente llenas. d- Y F-subniveles, anota la fórmula electrónica completa. |
|
||
Etiqueta los electrones de valencia. |
1s 2 2s 2 2pag 6 3s 2 3pag 6 3d 10 4s 2 4pag 6 4d 10 5s 2 5pag 5 |
||
Identifique la configuración electrónica del átomo de gas noble anterior. |
|||
Escriba la fórmula electrónica abreviada combinando todo lo que está entre corchetes no valente electrones. |
5s 2 5pag 5 |
Notas
1. Para elementos del 2º y 3º periodo, la tercera operación (sin la cuarta) conduce inmediatamente a la fórmula electrónica completa.
2. (norte – 1)d 10 -Los electrones mantienen la valencia en los átomos de los elementos del grupo IB.
FÓRMULA ELECTRÓNICA COMPLETA, FÓRMULA ELECTRÓNICA DE VALENCIA, FÓRMULA ELECTRÓNICA ABREVIADA, ALGORITMO PARA COMPILAR FÓRMULAS ELECTRÓNICAS DE ÁTOMOS.
1. Formule la fórmula electrónica de valencia de un átomo del elemento a) el segundo período del tercer grupo A, b) el tercer período del segundo grupo A, c) el cuarto período del cuarto grupo A.
2.Elaborar fórmulas electrónicas abreviadas de los átomos de magnesio, fósforo, potasio, hierro, bromo y argón.
6.11. Tabla de periodo corto de elementos químicos.
A lo largo de los más de 100 años transcurridos desde el descubrimiento del sistema natural de elementos, se han propuesto varios cientos de tablas diferentes que reflejan gráficamente este sistema. De ellos, además de la tabla de período largo, la más extendida es la llamada tabla de elementos de período corto de D. I. Mendeleev. Se obtiene una tabla de período corto a partir de una tabla de período largo si los períodos 4, 5, 6 y 7 se cortan delante de los elementos del grupo IB, se separan y las filas resultantes se doblan de la misma manera que anteriormente. dobló los períodos. El resultado se muestra en la Figura 6.24.

Los lantánidos y actínidos también se colocan aquí debajo de la tabla principal.
EN grupos Esta tabla contiene elementos cuyos átomos mismo número de electrones de valencia independientemente de en qué orbitales se encuentren estos electrones. Así, los elementos cloro (un elemento típico que forma un no metal; 3 s 2 3pag 5) y manganeso (un elemento formador de metal; 4 s 2 3d 5), al no tener capas de electrones similares, caen aquí en el mismo séptimo grupo. La necesidad de distinguir dichos elementos nos obliga a distinguirlos en grupos. subgrupos: principal– análogos de los grupos A de la tabla de período largo y lado– análogos de los grupos B. En la Figura 34, los símbolos de los elementos de los subgrupos principales se desplazan hacia la izquierda y los símbolos de los elementos de los subgrupos secundarios se desplazan hacia la derecha.
Es cierto que esta disposición de los elementos en la tabla también tiene sus ventajas, porque es el número de electrones de valencia lo que determina principalmente las capacidades de valencia de un átomo.
La tabla de período largo refleja las leyes de la estructura electrónica de los átomos, las similitudes y patrones de cambios en las propiedades de sustancias y compuestos simples entre grupos de elementos, los cambios regulares en una serie de cantidades físicas que caracterizan a los átomos, sustancias simples y compuestos. en todo el sistema de elementos, y mucho más. La tabla de períodos cortos es menos conveniente a este respecto.
TABLA DE CORTO PERIODO, SUBGRUPOS PRINCIPALES, SUBGRUPOS LATERALES.
1. Convierta la tabla de período largo que construyó a partir de una serie natural de elementos en una tabla de período corto. Haz la conversión inversa.
2. ¿Es posible compilar una fórmula electrónica de valencia general para átomos de elementos de un grupo de la tabla de período corto? ¿Por qué?
6.12. Tamaños atómicos. Radios orbitales
.El átomo no tiene límites claros. ¿Cuál se considera el tamaño de un átomo aislado? El núcleo de un átomo está rodeado por una capa de electrones y la capa está formada por nubes de electrones. El tamaño del EO se caracteriza por un radio. r eo. Todas las nubes de la capa exterior tienen aproximadamente el mismo radio. Por tanto, el tamaño de un átomo se puede caracterizar por este radio. Se llama radio orbital del átomo(r 0).
Los valores de los radios orbitales de los átomos se dan en el Apéndice 5.
El radio del EO depende de la carga del núcleo y del orbital en el que se encuentra el electrón que forma esta nube. En consecuencia, el radio orbital de un átomo depende de estas mismas características.
Consideremos las capas electrónicas de los átomos de hidrógeno y helio. Tanto en el átomo de hidrógeno como en el átomo de helio, los electrones se encuentran en 1 s-AO, y sus nubes tendrían el mismo tamaño si las cargas de los núcleos de estos átomos fueran las mismas. Pero la carga en el núcleo de un átomo de helio es dos veces mayor que la carga en el núcleo de un átomo de hidrógeno. Según la ley de Coulomb, la fuerza de atracción que actúa sobre cada electrón de un átomo de helio es el doble de la fuerza de atracción de un electrón hacia el núcleo de un átomo de hidrógeno. Por tanto, el radio del átomo de helio debe ser mucho menor que el radio del átomo de hidrógeno. Esto es cierto: r 0 (él) / r 0(H) = 0,291 E/0,529 E 0,55.
El átomo de litio tiene un electrón externo en 2 s-AO, es decir, forma una nube de la segunda capa. Naturalmente, su radio debería ser mayor. En realidad: r 0 (Li) = 1,586 E.
Los átomos de los elementos restantes del segundo período tienen electrones externos (y 2 s, y 2 pag) están ubicados en la misma segunda capa de electrones, y la carga nuclear de estos átomos aumenta al aumentar el número atómico. Los electrones son atraídos más fuertemente hacia el núcleo y, naturalmente, los radios de los átomos disminuyen. Podríamos repetir estos argumentos para átomos de elementos de otros períodos, pero con una aclaración: el radio orbital disminuye monótonamente sólo cuando se llena cada uno de los subniveles.
Pero si ignoramos los detalles, la naturaleza general del cambio en los tamaños de los átomos en un sistema de elementos es la siguiente: con un aumento en el número ordinal en un período, los radios orbitales de los átomos disminuyen y en un grupo aumentar. El átomo más grande es un átomo de cesio y el más pequeño es un átomo de helio, pero de los átomos de elementos que forman compuestos químicos (el helio y el neón no los forman), el más pequeño es un átomo de flúor.
La mayoría de los átomos de los elementos de la serie natural después de los lantánidos tienen radios orbitales algo más pequeños de lo que se esperaría según las leyes generales. Esto se debe a que entre el lantano y el hafnio en el sistema de elementos hay 14 lantánidos y, por tanto, la carga del núcleo del átomo de hafnio es 14 mi más que lantano. Por lo tanto, los electrones externos de estos átomos son atraídos hacia el núcleo con más fuerza que en ausencia de lantánidos (este efecto a menudo se denomina “contracción de lantánidos”).
Tenga en cuenta que al pasar de átomos de elementos del grupo VIIIA a átomos de elementos del grupo IA, el radio orbital aumenta abruptamente. En consecuencia, nuestra elección de los primeros elementos de cada período (ver § 7) resultó ser correcta.
RADIO ORBITAL DE UN ÁTOMO, SU CAMBIO EN EL SISTEMA DE ELEMENTOS.
1. De acuerdo con los datos proporcionados en el Apéndice 5, dibuje en papel cuadriculado una gráfica de la dependencia del radio orbital de un átomo del número atómico del elemento para elementos con z de 1 a 40. La longitud del eje horizontal es de 200 mm, la longitud del eje vertical es de 100 mm.
2. ¿Cómo se puede caracterizar la apariencia de la línea discontinua resultante?
6.13. Energía de ionización atómica
Si le das energía adicional a un electrón en un átomo (cómo se puede hacer esto, aprenderás en un curso de física), entonces el electrón puede moverse a otro AO, es decir, el átomo terminará en estado excitado. Este estado es inestable y el electrón volverá casi inmediatamente a su estado original y se liberará el exceso de energía. Pero si la energía impartida al electrón es lo suficientemente grande, el electrón puede separarse completamente del átomo, mientras que el átomo ionizado, es decir, se convierte en un ion cargado positivamente ( catión). La energía necesaria para esto se llama energía de ionización atómica(mi Y).
Es bastante difícil extraer un electrón de un solo átomo y medir la energía necesaria para ello, por lo que prácticamente se determina y utiliza. energía de ionización molar(E y m).
La energía de ionización molar muestra cuál es la energía mínima necesaria para eliminar 1 mol de electrones de 1 mol de átomos (un electrón de cada átomo). Este valor suele medirse en kilojulios por mol. Los valores de la energía de ionización molar del primer electrón para la mayoría de los elementos se dan en el Apéndice 6.
¿Cómo depende la energía de ionización de un átomo de la posición del elemento en el sistema de elementos, es decir, cómo cambia en el grupo y período?
En su significado físico, la energía de ionización es igual al trabajo que se debe gastar para superar la fuerza de atracción entre un electrón y un átomo al mover un electrón de un átomo a una distancia infinita de él.
Dónde q– carga de electrones, q es la carga del catión que queda después de la eliminación de un electrón, y r o es el radio orbital del átomo.
Y q, Y q– las cantidades son constantes, y podemos concluir que el trabajo de quitar un electrón A, y con ello la energía de ionización mi y son inversamente proporcionales al radio orbital del átomo.
Al analizar los valores de los radios orbitales de los átomos de varios elementos y los valores de energía de ionización correspondientes que figuran en los Apéndices 5 y 6, puede asegurarse de que la relación entre estas cantidades es casi proporcional, pero difiere algo de ella. . La razón por la que nuestra conclusión no concuerda muy bien con los datos experimentales es que utilizamos un modelo muy burdo que no tuvo en cuenta muchos factores importantes. Pero incluso este modelo aproximado nos permitió sacar la conclusión correcta de que al aumentar el radio orbital la energía de ionización del átomo disminuye y, a la inversa, al disminuir el radio aumenta.
Dado que en un período con un número atómico creciente el radio orbital de los átomos disminuye, la energía de ionización aumenta. En un grupo, a medida que aumenta el número atómico, el radio orbital de los átomos, por regla general, aumenta y la energía de ionización disminuye. La mayor energía de ionización molar se encuentra en los átomos más pequeños, los átomos de helio (2372 kJ/mol), y de los átomos capaces de formar enlaces químicos, los átomos de flúor (1681 kJ/mol). El más pequeño es para los átomos más grandes, los átomos de cesio (376 kJ/mol). En un sistema de elementos, la dirección del aumento de la energía de ionización se puede mostrar esquemáticamente de la siguiente manera: 
En química, es importante que la energía de ionización caracterice la tendencia de un átomo a ceder “sus” electrones: cuanto mayor es la energía de ionización, menos inclinado está el átomo a ceder electrones, y viceversa.
ESTADO EXCITADO, IONIZACIÓN, CATION, ENERGÍA DE IONIZACIÓN, ENERGÍA DE IONIZACIÓN MOLAR, CAMBIO EN LA ENERGÍA DE IONIZACIÓN EN UN SISTEMA DE ELEMENTOS.
1. Utilizando los datos proporcionados en el Apéndice 6, determine cuánta energía se debe gastar para eliminar un electrón de todos los átomos de sodio con una masa total de 1 g.
2. Utilizando los datos proporcionados en el Apéndice 6, determine cuántas veces más energía se necesita para eliminar un electrón de todos los átomos de sodio que pesan 3 g que de todos los átomos de potasio de la misma masa. ¿Por qué esta relación difiere de la relación de las energías de ionización molar de los mismos átomos?
3. De acuerdo con los datos proporcionados en el Apéndice 6, trace la dependencia de la energía de ionización molar del número atómico para elementos con z del 1 al 40. Las dimensiones del gráfico son las mismas que en la tarea del párrafo anterior. Compruebe si este gráfico corresponde a la elección de “períodos” del sistema de elementos.
6.14. Energía de afinidad electrónica
.La segunda característica energética más importante de un átomo es energía de afinidad electrónica(mi Con).
En la práctica, como en el caso de la energía de ionización, se suele utilizar la cantidad molar correspondiente: energía de afinidad electrónica molar().
La energía de afinidad electrónica molar muestra la energía liberada cuando se agrega un mol de electrones a un mol de átomos neutros (un electrón por cada átomo). Al igual que la energía de ionización molar, esta cantidad también se mide en kilojulios por mol.
A primera vista, puede parecer que en este caso no se debe liberar energía, porque un átomo es una partícula neutra y no existen fuerzas de atracción electrostática entre un átomo neutro y un electrón cargado negativamente. Por el contrario, al acercarse a un átomo, un electrón, al parecer, debería ser repelido por los mismos electrones cargados negativamente que forman la capa de electrones. Actualmente, esto no es verdad. Recuerda si alguna vez has tenido que lidiar con cloro atómico. Por supuesto que no. Después de todo, sólo existe a temperaturas muy altas. Incluso el cloro molecular más estable prácticamente no se encuentra en la naturaleza; si es necesario, debe obtenerse mediante reacciones químicas. Y hay que lidiar constantemente con el cloruro de sodio (sal de mesa). Después de todo, los humanos consumen sal de mesa todos los días con los alimentos. Y en la naturaleza esto ocurre con bastante frecuencia. Pero la sal de mesa contiene iones cloruro, es decir, átomos de cloro a los que se les ha añadido un electrón “extra”. Una de las razones por las que los iones cloruro son tan comunes es que los átomos de cloro tienen tendencia a ganar electrones, es decir, cuando se forman iones cloruro a partir de átomos y electrones de cloro, se libera energía.
Ya conoce una de las razones de la liberación de energía: está asociada con un aumento en la simetría de la capa electrónica del átomo de cloro durante la transición a una carga única. anión. Al mismo tiempo, como recordarás, energía 3 pag-el subnivel disminuye. Hay otras razones más complejas.
Debido a que el valor de la energía de afinidad electrónica está influenciado por varios factores, la naturaleza del cambio en esta cantidad en un sistema de elementos es mucho más compleja que la naturaleza del cambio en la energía de ionización. Puede verificar esto analizando la tabla que figura en el Apéndice 7. Pero dado que el valor de esta cantidad está determinado, en primer lugar, por la misma interacción electrostática que los valores de la energía de ionización, luego su cambio en el sistema de elementos ( de acuerdo a al menos en los grupos A) es en general similar al cambio en la energía de ionización, es decir, la energía de afinidad electrónica en el grupo disminuye y en el período aumenta. Es máximo para los átomos de flúor (328 kJ/mol) y cloro (349 kJ/mol). La naturaleza del cambio en la energía de afinidad electrónica en un sistema de elementos se asemeja a la naturaleza del cambio en la energía de ionización, es decir, la dirección del aumento en la energía de afinidad electrónica se puede mostrar esquemáticamente de la siguiente manera:
2. En la misma escala a lo largo del eje horizontal que en tareas anteriores, construya una gráfica de la dependencia de la energía molar de la afinidad electrónica del número atómico para los átomos de elementos con z del 1 al 40 usando la aplicación 7.
3. Cual significado fisico¿Tienen energías de afinidad electrónica negativas?
4. ¿Por qué, de todos los átomos de los elementos del segundo período, solo el berilio, el nitrógeno y el neón tienen valores negativos de energía molar de afinidad electrónica?
6.15. La tendencia de los átomos a perder y ganar electrones.
Ya sabes que la tendencia de un átomo a ceder sus propios electrones y añadir los de otros depende de sus características energéticas (energía de ionización y energía de afinidad electrónica). ¿Qué átomos son más propensos a ceder sus electrones y cuáles a aceptar otros?
Para responder a esta pregunta, resumamos en la Tabla 15 todo lo que sabemos sobre el cambio en estas inclinaciones en el sistema de elementos.
Tabla 15. Cambios en la propensión de los átomos a ceder sus propios electrones y ganar electrones extraños.
Si partículas idénticas tienen los mismos números cuánticos, entonces su función de onda es simétrica con respecto a la permutación de partículas. De ello se deduce que dos fermiones idénticos incluidos en el mismo sistema no pueden estar en los mismos estados, porque para fermiones la función de onda debe ser antisimétrica. Resumiendo los datos experimentales, W. Pauli formó principio excepciones , por lo cual Los sistemas de fermiones ocurren en la naturaleza. solo en estados,descrito por funciones de onda antisimétricas(formulación mecánica cuántica del principio de Pauli).
De esta posición se sigue una formulación más simple del principio de Pauli, que fue introducido por él en Teoría cuántica(1925) incluso antes de la construcción de la mecánica cuántica: en un sistema de fermiones idénticos dos de ellos no pueden simultáneamente estar en el mismo estado . Tenga en cuenta que el número de bosones idénticos en el mismo estado no está limitado.
Recordemos que el estado de un electrón en un átomo está determinado únicamente por el conjunto cuatro números cuánticos :
· principal norte ;
· orbital yo ![]() , normalmente estos estados se designan 1 s, 2d, 3F;
, normalmente estos estados se designan 1 s, 2d, 3F;
magnético();
· espín magnético ().
La distribución de electrones en un átomo se produce según el principio de Pauli, que puede formularse para un átomo en su forma más simple: un mismo átomo no puede tener más de un electrón con el mismo conjunto de cuatro números cuánticos: norte, yo, , :
z (norte, yo, , ) = 0 o 1,
Dónde z (norte, yo, , ) - el número de electrones en un estado cuántico, descrito por un conjunto de cuatro números cuánticos: norte, yo... Así, el principio de Pauli establece que dos electrones ,unidos en el mismo átomo difieren en significado ,al menos ,un número cuántico .
El número máximo de electrones en estados descritos por un conjunto de tres números cuánticos. norte, yo Y metro, y que difiere sólo en la orientación de los espines de los electrones es igual a:
| , | (8.2.1) |
porque el número cuántico de espín sólo puede tomar dos valores: 1/2 y –1/2.
El número máximo de electrones en estados definidos por dos números cuánticos. norte Y yo:
| (8.2.2) |
En este caso, el vector del momento angular orbital del electrón puede tomar en el espacio (2 yo+ 1) diferentes orientaciones (Fig. 8.1).

El número máximo de electrones en estados determinados por el valor del número cuántico principal. norte, es igual a:
| (8.2.3) |
Colección de electrones en un átomo multielectrónico.,teniendo el mismo número cuántico principal n,llamado capa electrónica o capa .
En cada capa, los electrones se distribuyen según subcapas , correspondiente a este yo.
Región del espacio,en el que existe una alta probabilidad de detectar un electrón, llamado subcapa o orbital . Los principales tipos de orbitales se muestran en la Fig. 8.1.
Dado que el número cuántico orbital toma valores de 0 a , el número de subcapas es igual al número ordinal norte conchas. El número de electrones en una subcapa está determinado por los números cuánticos magnéticos y de espín magnético: el número máximo de electrones en una subcapa con un determinado yo es igual a 2(2 yo+ 1). Las designaciones de capas, así como la distribución de electrones entre capas y subcapas, se dan en la tabla. 1.
tabla 1
| Número cuántico principal norte |
|||||||||||||||
| Símbolo de concha |
|||||||||||||||
| Número máximo de electrones en la capa. |
|||||||||||||||
| Número cuántico orbital yo |
|||||||||||||||
| Símbolo de subcapa |
|||||||||||||||
| Número máximo electrones en subcapa |
|||||||||||||||
- En contacto con 0
- Google+ 0
- DE ACUERDO 0
- Facebook 0