DEFINICIÓN
Níquel- vigésimo octavo elemento Tabla periódica. Designación - Ni del latín "niccolum". Situada en el cuarto periodo, grupo VIIIB. Se refiere a los metales. La carga nuclear es 28.
Al igual que el cobalto, el níquel se presenta en la naturaleza principalmente en forma de compuestos con arsénico o azufre; tales, por ejemplo, son los minerales kupfernickel NiAs, el brillo de arsénico-níquel NiAsS, etc. El níquel es más común que el cobalto [alrededor del 0,01% (masa) de la corteza terrestre].
El níquel metálico tiene un color plateado con un tinte amarillento (Fig. 1), es muy duro, se pule bien y es atraído por un imán. Se caracteriza por una alta resistencia a la corrosión: estable en la atmósfera, en agua, en álcalis y en varios ácidos. Se disuelve activamente en Ácido nítrico. La resistencia química del níquel se debe a su tendencia a la pasivación, a la formación de películas de óxido en la superficie, que tienen un fuerte efecto protector.
Arroz. 1. Níquel. Apariencia.
Peso atómico y molecular del níquel.
DEFINICIÓN
Peso molecular relativo de una sustancia (M r) es un número que muestra cuántas veces la masa de una molécula dada es mayor que 1/12 de la masa de un átomo de carbono, y masa atómica relativa de un elemento (A r)- cuantas veces la masa promedio de los atomos elemento químico más de 1/12 de la masa de un átomo de carbono.
Dado que el níquel existe en estado libre en forma de moléculas monoatómicas de Ni, los valores de sus valores atómicos y peso molecular emparejar. Son iguales a 58.6934.
Isótopos de níquel
Se sabe que el níquel puede presentarse en la naturaleza en forma de cinco isótopos estables 58Ni, 60Ni, 61Ni, 62Ni y 64Ni. Sus números de masa son 58, 60, 61, 62 y 64, respectivamente. El núcleo del isótopo de níquel 58 Ni contiene veintiocho protones y treinta neutrones, y los isótopos restantes difieren de él solo en el número de neutrones.
Hay isótopos inestables artificiales de níquel con números de masa de 48 a 78, así como ocho meta estados estables, entre los cuales el isótopo más longevo es el 59 Ni con una vida media de 76 mil años.
iones de níquel
La fórmula electrónica que muestra la distribución orbital de los electrones de níquel es la siguiente:
1s 2 2s 2 2p 6 3s 2 3p 6 3d 8 4s 2 .
Como resultado interacción química el níquel dona sus electrones de valencia, es decir es su donante, y se convierte en un ion cargado positivamente:
Ni0-2e → Ni2+;
Ni 0 -3e → Ni 3+.
Molécula y átomo de níquel
En estado libre, el níquel existe en forma de moléculas monoatómicas de Ni. Aquí hay algunas propiedades que caracterizan el átomo y la molécula de níquel:
Aleaciones de níquel
La mayor parte del níquel se utiliza para producir diversas aleaciones con hierro, cobre, zinc y otros metales. La adición de níquel al acero aumenta su dureza y resistencia a la corrosión.
Las aleaciones a base de níquel se pueden dividir en termorresistentes (nimonic, inconel, hastella [más del 60% de níquel, 15-20% de cromo y otros metales]), magnéticas (permalloy) y aleaciones con propiedades especiales (monel metal, nickelin, constantan , invar, platino).
Ejemplos de resolución de problemas
EJEMPLO 1
| Ejercicio | Escriba las ecuaciones de reacción que se pueden utilizar para realizar las siguientes transformaciones: NiCl2 → Ni → NiSO4 → Ni(NO3)2 → Ni(OH)2 → NiCl2. Dibujar las ecuaciones de reacciones que ocurren en soluciones en formas iónicas y abreviadas. |
| Respuesta | Al colocar una solución de cloruro de níquel (II) que es más activa que el níquel metálico, es posible obtener níquel en su forma libre (reacción de sustitución): NiCl2 + Zn → Ni + ZnCl2; Ni 2+ + Zn 0 → Ni 0 + Zn 2+ . El níquel se disuelve en ácido sulfúrico diluido para formar sulfato de níquel (II): Ni + H 2 SO 4 (diluido) → NiSO 4 + H 2; Ni 0 + 2H + → Ni 2+ + H 2 . El nitrato de níquel (II) se puede obtener mediante la reacción de intercambio: NiSO4 + Ba(NO3)2 → Ni(NO3)2 + BaSO4 ↓; SO 4 2- + Ba 2+ → BaSO 4 ↓. Actuando sobre nitrato de níquel (II) con álcali, se puede obtener hidróxido de níquel (II): Ni(NO 3 ) 2 + 2NaOH → Ni(OH) 2 ↓+ 2NaNO 3 ; Ni 2+ + 2OH - \u003d Ni (OH) 2 ↓. El cloruro de níquel (II) a partir de hidróxido de níquel (II) se puede obtener mediante una reacción de neutralización con ácido clorhídrico: Ni(OH)2 + 2HCl → NiCl2 + 2H2O; OH - + H + \u003d H 2 O. |
EJEMPLO 2
| Ejercicio | ¿Qué masa de cloruro de níquel (II) se puede obtener calentando 17,7 g de níquel y 12 litros de cloro (n.o.)? ¿Qué volumen de solución 0,06 M se puede preparar a partir de esta masa de sal? |
| Solución | Escribamos la ecuación de reacción: Ni + Cl 2 \u003d NiCl 2. Encontremos el número de moles de níquel (masa molar - 59 g/mol) y cloro que han reaccionado usando los datos indicados en la condición del problema: n (Ni) = m (Ni) / M (Ni); n (Ni) \u003d 17.7 / 59 \u003d 0.3 mol. n (Cl 2) \u003d V (Cl 2) / V m; n (Cl 2) \u003d 12 / 22.4 \u003d 0.54 mol. Según la ecuación del problema n (Ni): n (Cl 2) = 1:1. Esto significa que hay exceso de cloro y todos los cálculos posteriores se deben realizar con níquel. Encontremos la cantidad de sustancia y la masa del cloruro de níquel (II) resultante (masa molar 130 g / mol): n (Ni): n (NiCl2) = 1:1; n (Ni) \u003d n (NiCl 2) \u003d 0,3 mol. m (NiCl2)= n (NiCl2)×M (NiCl2); m (NiCl 2) \u003d 0.3 × 130 \u003d 39 g. Calcula el volumen de una disolución 0,06 M que se puede obtener a partir de 39 g de cloruro de níquel (II): V (NiCl 2) \u003d n (NiCl 2) / c (NiCl 2); V (NiCl 2) \u003d 0.3 / 0.06 \u003d 0.5 l. |
| Respuesta | La masa de cloruro de níquel (II) es de 39 g, el volumen de una solución 0,06 M es de 0,5 l (500 ml). |
sobre el tema: Níquel y sus propiedades
El trabajo fue compilado por estudiantes de 2do año del grupo 5202
Nikitin Dmitry y Sharhemullin Emil.
Kazán 2013
Propiedades físicas del Níquel.
El elemento fue descubierto en 1761. El níquel es un elemento del décimo grupo, el cuarto período del sistema periódico de elementos químicos. I. Mendeleev, con número atómico 28. Metal blanco plateado que no se empaña en el aire. En su forma pura, es muy plástico y puede procesarse a presión. Es un ferromagneto, es decir cuando conduce corriente a través de él, tiene propiedades magnéticas pronunciadas. Los átomos de níquel tienen una configuración electrónica externa 3d 8 4s 2 . Es un metal maleable y maleable, lo que permite producir las láminas y tubos más delgados a partir de él.
Propiedades químicas del níquel
Químicamente, el Ni es similar al Fe y al Co, pero también al Cu ya los metales nobles. En compuestos, exhibe valencia variable (la mayoría de las veces bivalente). El níquel es un metal de actividad media. Absorbe (especialmente en el estado finamente dividido) grandes cantidades de gases
El níquel se quema solo en forma de polvo. En este caso, forma dos óxidos NiO y Ni 2 O 3 y, en consecuencia, dos hidróxidos Ni(OH) 2 y Ni(OH) 3 . Las sales de níquel solubles más importantes son acetato, cloruro, nitrato y sulfato. Las soluciones acuosas de sales suelen ser de color verde y las sales anhidras son de color amarillo o marrón amarillento. que se utiliza a menudo en química analítica.
La saturación de N. con gases empeora sus propiedades mecánicas. La interacción con el oxígeno comienza a 500 °C; en un estado finamente disperso, N. es pirofórico: se enciende espontáneamente en el aire. De los óxidos, el óxido más importante es el NiO, cristales verdosos, prácticamente insolubles en agua (el mineral bunsenita). El hidróxido se precipita de las soluciones de sales de níquel cuando se agregan álcalis en forma de un precipitado voluminoso de color verde manzana. Cuando se calienta, H. se combina con halógenos, formando NiX 2 . Al quemarse en vapor de azufre, se obtiene un sulfuro de composición similar al Ni 3 S 2 . El monosulfuro de NiS se puede obtener calentando NiO con azufre. N. no reacciona con el nitrógeno incluso a altas temperaturas (hasta 1400 ° C)
En estado líquido, el N disuelve una cantidad apreciable de C, que precipita al enfriarse en forma de grafito. Cuando se aísla el grafito, el N. pierde maleabilidad y la capacidad de ser procesado por presión.
El níquel es resistente al agua. Los ácidos orgánicos actúan sobre N. solo después de un contacto prolongado con él. Los ácidos sulfúrico y clorhídrico disuelven lentamente el N.; ácido nítrico diluido - muy fácil; El HNO 3 concentrado pasiva el N., pero en menor medida que el hierro. Al interactuar con ácidos, se forman sales de Ni bivalente. Casi todas las sales de Ni(II) y ácidos fuertes altamente solubles en agua, sus soluciones son ácidas debido a la hidrólisis.
Compuestos complejos de Níquel.
La unión de níquel en complejos es un proceso de diagnóstico importante para la química analítica.
El níquel se caracteriza por la formación de complejos. Así, el catión Ni 2+ con el amoníaco forma un complejo de hexaamina 2+ y un complejo de dicuatetraamina 2+. Estos complejos con aniones forman compuestos azules o violetas.
Las sales insolubles incluyen oxalato y fosfato (color verde), tres sulfuros: NiS (negro), Ni 3 S 2 (bronce amarillento) y Ni 3 S 4 (blanco plateado). O, dimetilglioximato de níquel Ni (C 4 H 6 N 2 O 2) 2, dando un color rojo claro en un ambiente ácido, que es ampliamente utilizado en el análisis cualitativo para la detección de níquel.
Las soluciones acuosas de sales de níquel (II) contienen el ion hexaaquanickel (II) 2+. Cuando se agrega una solución de amoníaco a una solución que contiene estos iones, precipita hidróxido de níquel (II), una sustancia gelatinosa de color verde. Este precipitado se disuelve cuando se añade un exceso de amoníaco debido a la formación de iones hexamino-níquel(II) 2+.
El níquel forma complejos con estructuras tetraédricas y cuadradas planas. Por ejemplo, el complejo 2− de tetracloroníquelato (II) tiene una estructura tetraédrica, mientras que el complejo 2− de tetracianónicoquelato (II) tiene una estructura cuadrada plana.
Es característica la reacción de los iones Ni 2+ con la dimetilglioxima, que conduce a la formación de dimetilglioximato de níquel rosa-rojo. Esta reacción se usa en la determinación cuantitativa de níquel, y el producto de reacción se usa como pigmento en materiales cosméticos y para otros fines.
Cuantificación del Elemento.
Se lleva a cabo principalmente por los siguientes métodos:
1) Precipitación en forma de dimetoiglioximato de níquel, como ya se mencionó.
2) precipitación en forma de eníquel-alfa-bencildioxima.
3) Precipitación en forma de hidróxido de níquel (3) . Esta reacción se lleva a cabo utilizando potasa cáustica y agua de bromo.
4) Precipitación en forma de sulfuro. Donde se utilizará óxido de níquel como forma de peso2.
5) método electrolítico
6) Método volumétrico, es decir, titulación de cianuro de potasio para la formación de cianuro complejo (Potasio 2 níquel ce en cuatro veces)
7) Un método colorimétrico basado en un cambio de color del ion de níquel hexammina, o el color rojo de un compuesto complejo soluble, que se forma por la reacción de iones de níquel 3 con dimetilglioxima en una solución alcalina en presencia de un oxidante agente.
8) Método complexométrico.
MÉTODO GRAVIMÉTRICO PARA LA DETERMINACIÓN DEL NÍQUEL El método se basa en la precipitación del níquel en una solución amoniacal con dimetilglioxima como compuesto intercomplejo poco soluble en presencia de ácido cítrico o tartárico.
MÉTODO TITRIMÉTRICO PARA LA DETERMINACIÓN DEL NÍQUEL
El método se basa en la precipitación de níquel en una solución de amoníaco con dimetilglioxima como compuesto intracomplejo escasamente soluble en presencia de ácido cítrico o tartárico y la determinación de níquel por titulación complejométrica con eriocromo negro T como indicador.
Historia
El níquel (níquel inglés, francés y alemán) se descubrió en 1751. Sin embargo, mucho antes de eso, los mineros sajones conocían muy bien el mineral, que exteriormente se parecía al mineral de cobre y se usaba en la fabricación de vidrio para colorear el vidrio en color verde. Todos los intentos de obtener cobre de este mineral fueron infructuosos, y por lo tanto en finales del XVII v El mineral se llamó Kupfernickel, que significa aproximadamente "Diablo de cobre". Este mineral (pirita de níquel rojo NiAs) fue estudiado en 1751 por el mineralogista sueco Kronstedt. Consiguió obtener óxido verde y, mediante la reducción de este último, un nuevo metal llamado níquel. Cuando Bergman recibió el metal en una forma más pura, descubrió que las propiedades del metal eran similares a las del hierro; El níquel ha sido estudiado con más detalle por muchos químicos, comenzando con Proust. Nikkel es una mala palabra en el lenguaje de los mineros. Se formó a partir de Nicolaus distorsionado, una palabra genérica que tenía varios significados. Pero principalmente la palabra Nicolás sirvió para caracterizar a las personas de dos caras; además, significaba "un pequeño espíritu travieso", "un holgazán engañoso", etc. En la literatura rusa principios del XIX v se utilizaron los nombres nikolan (Scherer, 1808), nikolan (Zakharov, 1810), nicol y nickel (Dvigubsky, 1824).
Propiedades físicas
El metal níquel tiene un color plateado con un tinte amarillento, es muy duro, dúctil y maleable, bien pulido, atraído por un imán, mostrando propiedades magnéticas a temperaturas inferiores a 340 °C.
Propiedades químicas
Dicloruro de níquel (NiCl2)
Los átomos de níquel tienen una configuración electrónica externa de 3d84s2. El estado de oxidación de Ni(II) es el más estable para el níquel.
El níquel forma compuestos con estados de oxidación +2 y +3. En este caso, el níquel con un estado de oxidación de +3 se encuentra únicamente en forma de sales complejas. Para los compuestos de níquel +2, se conocen un gran número de compuestos ordinarios y complejos. El óxido de níquel Ni2O3 es un agente oxidante fuerte.
El níquel se caracteriza por una alta resistencia a la corrosión: es estable en el aire, en el agua, en los álcalis y en varios ácidos. La resistencia química se debe a su tendencia a la pasivación, la formación de una densa película de óxido en su superficie, que tiene un efecto protector. El níquel se disuelve activamente en ácido nítrico.
Con el monóxido de carbono CO, el níquel forma fácilmente un carbonilo volátil y altamente tóxico Ni(CO)4.
El polvo de níquel finamente disperso es pirofórico (se autoinflama en el aire).
El níquel se quema solo en forma de polvo. Forma dos óxidos NiO y Ni2O3 y, respectivamente, dos hidróxidos Ni(OH)2 y Ni(OH)3. Las sales de níquel solubles más importantes son acetato, cloruro, nitrato y sulfato. Las soluciones suelen ser de color verde, mientras que las sales anhidras son de color amarillo o marrón amarillento. Las sales insolubles incluyen oxalato y fosfato (verde), los tres sulfuros NiS (negro), Ni2S3 (bronce amarillento) y Ni3S4 (negro). El níquel también forma numerosos compuestos complejos y de coordinación. Por ejemplo, el dimetilglioximato de níquel Ni(C4H6N2O2)2, que da un color rojo claro en medios ácidos, se usa ampliamente en análisis cualitativos para la detección de níquel.
Una solución acuosa de sulfato de níquel en un frasco es verde.
Las soluciones acuosas de sales de níquel (II) contienen el ion hexaaquanickel (II) 2+. Cuando se agrega una solución de amoníaco a una solución que contiene estos iones, precipita hidróxido de níquel (II), una sustancia gelatinosa de color verde. Este precipitado se disuelve cuando se añade un exceso de amoníaco debido a la formación de iones hexamino-níquel(II) 2+.
El níquel forma complejos con estructuras tetraédricas y cuadradas planas. Por ejemplo, el complejo 2− de tetracloroníquelato (II) tiene una estructura tetraédrica, mientras que el complejo 2− de tetracianónicoquelato (II) tiene una estructura cuadrada plana.
El análisis cualitativo y cuantitativo utiliza una solución alcalina de butanodiondioxima, también conocida como dimetilglioxima, para detectar iones de níquel (II). Cuando interactúa con los iones de níquel (II), se forma un compuesto de coordinación rojo bis (butanodiondioximato) níquel (II). Es un compuesto quelato y el ligando butanodiondioximato es bidentado.
estar en la naturaleza
El níquel es bastante común en la naturaleza - su contenido en la corteza terrestre es aprox. 0,01% (masa). Ocurre en la corteza terrestre solo en forma unida; los meteoritos de hierro contienen níquel nativo (hasta un 8%). Su contenido en rocas ultrabásicas es aproximadamente 200 veces superior al de las ácidas (1,2 kg/t y 8 g/t). En las rocas ultramáficas, la cantidad predominante de níquel está asociada con olivinos que contienen 0,13 a 0,41 % de Ni. Reemplaza isomórficamente al hierro y al magnesio. Una pequeña parte del níquel está presente en forma de sulfuros. El níquel exhibe propiedades siderófilas y calcofílicas. Con un mayor contenido de azufre en el magma, aparecen sulfuros de níquel junto con cobre, cobalto, hierro y platinoides. En un proceso hidrotermal, junto con el cobalto, el arsénico y el azufre, ya veces con el bismuto, el uranio y la plata, el níquel forma concentraciones elevadas en forma de arseniuros y sulfuros de níquel. El níquel se encuentra comúnmente en minerales de cobre y níquel que contienen sulfuro y arsénico.
* Níquel (pirita de níquel rojo, kupfernickel) NiAs
* clorantita (pirita de níquel blanca) (Ni, Co, Fe) As2
* garnierita (Mg, Ni)6(Si4O11)(OH)6*H2O y otros silicatos
* piritas magnéticas (Fe, Ni, Cu)S
* brillo de arsénico-níquel (gersdorfita) NiAsS,
* pentlandita (Fe,Ni)9S8
En plantas, en promedio, 5 × 10−5 por ciento en peso de níquel, en animales marinos - 1,6 × 10−4, en animales terrestres - 1 × 10 cuerpo humano— 1…2×10−6. Se sabe mucho sobre el níquel en los organismos. Se ha establecido, por ejemplo, que su contenido en la sangre humana cambia con la edad, que en los animales aumenta la cantidad de níquel en el cuerpo y, finalmente, que hay algunas plantas y microorganismos - "concentradores" de níquel, que contienen miles e incluso cientos de miles de veces más níquel que el medio ambiente.
Yacimientos de minerales de níquel
Los principales yacimientos de minerales de níquel se encuentran en Canadá, Rusia, Nueva Caledonia, Filipinas, Indonesia, China, Finlandia y Australia. Isótopos naturales de níquel.
El níquel natural contiene 5 isótopos estables: 58Ni (68,27%), 60Ni (26,10%), 61Ni (1,13%), 62Ni (3,59%), 64Ni (0,91%).
Recibo
Las reservas totales de níquel en minerales a principios de 1998 se estiman en 135 millones de toneladas, incluidas reservas fiables de 49 millones de toneladas.
Los principales minerales de níquel (níquel (kupfernickel) NiAs, millerita NiS, pentlandita (FeNi)9S8) también contienen arsénico, hierro y azufre; Las inclusiones de pentlandita también ocurren en la pirrotita ígnea. Otros minerales de los que también se extrae el Ni contienen impurezas de Co, Cu, Fe y Mg. A veces, el níquel es el producto principal del proceso de refinación, pero más a menudo se obtiene como subproducto en otras tecnologías de metales. De las reservas confiables, según diversas fuentes, del 40 al 66% del níquel se encuentra en "minerales de níquel oxidado" (ONR), el 33% - en sulfuro, el 0,7% - en otros. A partir de 1997, la proporción de níquel producido por el procesamiento de OHP fue de alrededor del 40% de la producción mundial. En condiciones industriales, OHP se divide en dos tipos: magnesiano y ferruginoso.
Los minerales refractarios de magnesio, por regla general, se someten a fundición eléctrica para ferroníquel (5-50% Ni + Co, según la composición de la materia prima y las características tecnológicas).
Los minerales más ferruginosos - lateríticos se procesan por métodos hidrometalúrgicos utilizando lixiviación con carbonato amónico o lixiviación en autoclave con ácido sulfúrico. Dependiendo de la composición de las materias primas y de los esquemas tecnológicos aplicados, los productos finales de estas tecnologías son: óxido de níquel (76-90% Ni), sinterizado (89% Ni), concentrados de sulfuro de diversas composiciones, así como electrolíticos metálicos. níquel, polvos de níquel y cobalto.
Menos ferruginoso: los minerales de nontronita se funden en mata. En las empresas que operan en un ciclo completo, otro esquema de procesamiento incluye la conversión, la tostación de la mata y la fundición eléctrica del óxido de níquel para obtener níquel metálico. En el camino, el cobalto extraído se produce en forma de metal y/o sales. Otra fuente de níquel: en las cenizas de los carbones de Gales del Sur en Inglaterra - hasta 78 kg de níquel por tonelada. El mayor contenido de níquel en algunos carbones, petróleo y esquistos indica la posibilidad de concentración de níquel en los fósiles. materia orgánica. Las razones de este fenómeno aún no han sido dilucidadas.
La mayor parte del níquel se obtiene a partir de garnierita y piritas magnéticas.
1. El mineral de silicato se reduce con polvo de carbón en hornos tubulares rotatorios a gránulos de hierro y níquel (5-8% Ni), que luego se purifican a partir de azufre, se calcinan y se tratan con una solución de amoníaco. Después de que la solución se acidifica, se obtiene un metal electrolíticamente a partir de ella.
2. Método carbonilo (método Mond). Primero, se obtiene mata de cobre-níquel a partir de mineral de sulfuro, sobre el cual se pasa CO a alta presión. Se forma tetracarbonilníquel fácilmente volátil, cuya descomposición térmica produce un metal especialmente puro.
3. Método aluminotérmico de recuperación de níquel del mineral de óxido: 3NiO + 2Al = 3Ni + Al2O3
Solicitud
Aleaciones
El níquel es la base de la mayoría de las superaleaciones, materiales de alta temperatura utilizados en la industria aeroespacial para piezas de centrales eléctricas.
* Metal Monel (65 - 67% Ni + 30 - 32% Cu + 1% Mn), resistente al calor hasta 500 °C, muy resistente a la corrosión;
* oro blanco (por ejemplo, 585 muestras contienen 58,5% de oro y una aleación (ligadura) de plata y níquel (o paladio));
* nicromo, aleación resistente (60% Ni + 40% Cr);
* permalloy (76% Ni + 17% Fe + 5% Cu + 2% Cr), tiene una alta susceptibilidad magnética con muy bajas pérdidas por histéresis;
* Invar (65% Fe + 35% Ni), casi no se alarga cuando se calienta;
* Además, las aleaciones de níquel incluyen aceros al níquel y al cromo-níquel, alpaca y diversas aleaciones de resistencia como el constantán, la niquelina y la manganina.
niquelado
El niquelado es la creación de una capa de níquel en la superficie de otro metal para protegerlo de la corrosión. Se lleva a cabo mediante galvanoplastia utilizando electrolitos que contienen sulfato de níquel (II), cloruro de sodio, hidróxido de boro, tensioactivos y sustancias brillantes y ánodos de níquel solubles. El espesor de la capa de níquel resultante es de 12 a 36 µm. La estabilidad del brillo de la superficie puede garantizarse mediante un cromado posterior (espesor de la capa de cromo 0,3 µm).
El niquelado sin corriente se lleva a cabo en una solución de una mezcla de cloruro de níquel (II) e hipofosfito de sodio en presencia de citrato de sodio:
NiCl2 + NaH2PO2 + H2O = Ni + NaH2PO3 + 2HCl
El proceso se lleva a cabo a pH 4-6 y 95 °C.
Producción de baterías
Fabricación de baterías de hierro-níquel, níquel-cadmio, níquel-zinc, níquel-hidrógeno.
Tecnologías de radiación
El nucleido 63Ni que emite partículas β+ tiene una vida media de 100,1 años y se utiliza en krytrons.
Medicamento
* Se utiliza en la fabricación de sistemas de brackets (niqueluro de titanio).
* Prótesis
moneda
El níquel se usa ampliamente en la producción de monedas en muchos países. En los Estados Unidos, la moneda de 5 centavos se conoce coloquialmente como el níquel.
Rol biológico
Función biológica: el níquel es uno de los oligoelementos necesarios para el desarrollo normal de los organismos vivos. Sin embargo, poco se sabe sobre su papel en los organismos vivos. Se sabe que el níquel participa en reacciones enzimáticas en animales y plantas. En los animales se acumula en los tejidos queratinizados, especialmente en las plumas. Un mayor contenido de níquel en los suelos conduce a enfermedades endémicas: aparecen formas feas en las plantas y enfermedades oculares en los animales asociadas con la acumulación de níquel en la córnea. Dosis tóxica (para ratas) - 50 mg. Particularmente dañinos son los compuestos volátiles de níquel, en particular, su tetracarbonilo Ni(CO)4. El MPC de los compuestos de níquel en el aire oscila entre 0,0002 y 0,001 mg/m3 (para varios compuestos).
Acción fisiológica
El níquel es la principal causa de alergia (dermatitis de contacto) a los metales que entran en contacto con la piel (joyas, relojes, botones de jeans). En la Unión Europea, el contenido de níquel en los productos que entran en contacto con la piel humana es limitado.
El carbonilo de níquel es altamente tóxico. La concentración máxima permisible de sus vapores en el aire de locales industriales es de 0,0005 mg/m³.
En el siglo XX se descubrió que el páncreas es muy rico en níquel. Cuando se administra después de la insulina, el níquel prolonga la acción de la insulina y, por lo tanto, aumenta la actividad hipoglucemiante. El níquel afecta los procesos enzimáticos, la oxidación del ácido ascórbico, acelera la transición de los grupos sulfhidrilo a disulfuro. El níquel puede inhibir la acción de la adrenalina y disminuir la presión arterial. El consumo excesivo de níquel en el cuerpo causa vitíligo. El níquel se deposita en el páncreas y las glándulas paratiroides.
Níquel- una sustancia simple, dúctil, maleable, metal de transición de color blanco plateado, a temperaturas ordinarias en el aire se cubre con una fina película de óxido. Químicamente inactivo. Pertenece a los metales pesados no ferrosos, no se encuentra en su forma pura en la tierra; generalmente se incluye en la composición de varios minerales, alta dureza, bien pulido, es un ferromagnético: es atraído por un imán, en sistema periódico Mendeleev se denota con el símbolo Ni y tiene 28 números de serie.
Ver también:
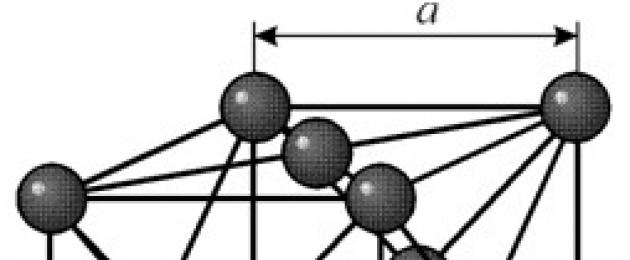
ESTRUCTURA
 Tiene una red cúbica centrada en las caras con un período a = 0.35238 å nm, grupo espacial Fm3m. Esta estructura cristalina es resistente a la presión de al menos 70 GPa. En condiciones normales, el níquel existe en forma de una modificación b que tiene una red cúbica centrada en las caras (a = 3,5236 å). Pero el níquel, sometido a pulverización catódica en una atmósfera de h 2 , forma una modificación a que tiene una red hexagonal compacta (a = 2,65 å, c = 4,32 å), que, cuando se calienta por encima de 200 °C, se transforma en un cúbico uno. El níquel cúbico compacto tiene una densidad de 8,9 g/cm 3 (20 °C), un radio atómico de 1,24 å
Tiene una red cúbica centrada en las caras con un período a = 0.35238 å nm, grupo espacial Fm3m. Esta estructura cristalina es resistente a la presión de al menos 70 GPa. En condiciones normales, el níquel existe en forma de una modificación b que tiene una red cúbica centrada en las caras (a = 3,5236 å). Pero el níquel, sometido a pulverización catódica en una atmósfera de h 2 , forma una modificación a que tiene una red hexagonal compacta (a = 2,65 å, c = 4,32 å), que, cuando se calienta por encima de 200 °C, se transforma en un cúbico uno. El níquel cúbico compacto tiene una densidad de 8,9 g/cm 3 (20 °C), un radio atómico de 1,24 å PROPIEDADES
 El níquel es un metal maleable y maleable que se puede utilizar para fabricar las láminas y los tubos más delgados. Resistencia a la tracción 400-500 MN/m 2 , límite elástico 80 MN/m 2 , límite elástico 120 MN/m 2 ; elongación 40%; módulo de elasticidad normal 205 Gn/m 2 ; Dureza Brinell 600-800 MN/m 2 . En el rango de temperatura de 0 a 631K (el límite superior corresponde al punto de Curie). El ferromagnetismo del níquel se debe a las peculiaridades de la estructura de las capas externas de electrones de sus átomos. El níquel es un componente de los más importantes materiales magnéticos y aleaciones con un mínimo coeficiente de dilatación térmica (permalloy, monel metal, invar, etc.).
El níquel es un metal maleable y maleable que se puede utilizar para fabricar las láminas y los tubos más delgados. Resistencia a la tracción 400-500 MN/m 2 , límite elástico 80 MN/m 2 , límite elástico 120 MN/m 2 ; elongación 40%; módulo de elasticidad normal 205 Gn/m 2 ; Dureza Brinell 600-800 MN/m 2 . En el rango de temperatura de 0 a 631K (el límite superior corresponde al punto de Curie). El ferromagnetismo del níquel se debe a las peculiaridades de la estructura de las capas externas de electrones de sus átomos. El níquel es un componente de los más importantes materiales magnéticos y aleaciones con un mínimo coeficiente de dilatación térmica (permalloy, monel metal, invar, etc.).
RESERVAS Y PRODUCCIÓN
 El níquel es bastante común en la naturaleza: su contenido en la corteza terrestre es de aproximadamente 0,01% (masa). Se encuentra en la corteza terrestre solo en forma unida; los meteoritos de hierro contienen níquel nativo (hasta un 8%). Su contenido en rocas ultrabásicas es aproximadamente 200 veces superior al de las ácidas (1,2 kg/t y 8 g/t). En las rocas ultramáficas, la cantidad predominante de níquel está asociada con olivinos que contienen 0,13 - 0,41% de Ni.
El níquel es bastante común en la naturaleza: su contenido en la corteza terrestre es de aproximadamente 0,01% (masa). Se encuentra en la corteza terrestre solo en forma unida; los meteoritos de hierro contienen níquel nativo (hasta un 8%). Su contenido en rocas ultrabásicas es aproximadamente 200 veces superior al de las ácidas (1,2 kg/t y 8 g/t). En las rocas ultramáficas, la cantidad predominante de níquel está asociada con olivinos que contienen 0,13 - 0,41% de Ni.
En plantas, en promedio, 5 10 -5 por ciento en peso de níquel, en animales marinos - 1.6 10 -4, en animales terrestres - 1 10 -6, en el cuerpo humano - 1 ... 2 10 -6.
La mayor parte del níquel se obtiene a partir de garnierita y piritas magnéticas.
El mineral de silicato se reduce con polvo de carbón en hornos tubulares rotatorios a gránulos de hierro y níquel (5-8% Ni), que luego se purifican a partir de azufre, se calcinan y se tratan con una solución de amoníaco. Después de que la solución se acidifica, se obtiene un metal electrolíticamente a partir de ella.
Método de carbonilo (método de Mond): Primero, se obtiene mata de cobre-níquel a partir de mineral de sulfuro, sobre el cual se pasa CO2 a alta presión. Se forma tetracarbonilníquel fácilmente volátil, cuya descomposición térmica produce un metal especialmente puro.
Método aluminotérmico de recuperación de níquel del mineral de óxido: 3NiO + 2Al = 3Ni + Al 2 O 3
ORIGEN
 Los depósitos de minerales de sulfuro de cobre-níquel están asociados con macizos de gabroides en capas con forma de lopolit o placas confinados a zonas de fallas profundas en escudos y plataformas antiguas. característica distintiva depósitos de cobre-níquel en todo el mundo es una composición mineral consistente de minerales: pirrotita, pentlandita, calcopirita, magnetita; Además de ellos, se encuentran en los minerales pirita, cubanita, polidimita, niquelina, millerita, violarita, minerales del grupo del platino, ocasionalmente cromita, arseniuros de níquel y cobalto, galena, esfalerita, bornita, makinavita, wallerita, grafito, oro nativo.
Los depósitos de minerales de sulfuro de cobre-níquel están asociados con macizos de gabroides en capas con forma de lopolit o placas confinados a zonas de fallas profundas en escudos y plataformas antiguas. característica distintiva depósitos de cobre-níquel en todo el mundo es una composición mineral consistente de minerales: pirrotita, pentlandita, calcopirita, magnetita; Además de ellos, se encuentran en los minerales pirita, cubanita, polidimita, niquelina, millerita, violarita, minerales del grupo del platino, ocasionalmente cromita, arseniuros de níquel y cobalto, galena, esfalerita, bornita, makinavita, wallerita, grafito, oro nativo.
Los depósitos exógenos de minerales de silicato de níquel se asocian universalmente con uno u otro tipo de corteza de serpentenitas meteorizadas. durante la meteorización, se produce la descomposición escalonada de los minerales, así como la transferencia de elementos móviles, con la ayuda del agua de partes superiores ladrar hasta el fondo. Allí, estos elementos precipitan en forma de minerales secundarios.
Yacimientos de este tipo contienen reservas de níquel que son 3 veces mayores que sus reservas en minerales sulfurados, y las reservas de algunos yacimientos alcanzan 1 millón de toneladas o más de níquel. Grandes reservas de minerales de silicato se concentran en Nueva Caledonia, Filipinas, Indonesia, Australia y otros países. El contenido promedio de níquel en ellos es 1.1-2%. Además, los minerales suelen contener cobalto.
SOLICITUD
La gran mayoría del níquel se utiliza para obtener aleaciones con otros metales (fe, cr, cu, etc.), que se distinguen por sus altas propiedades mecánicas, anticorrosivas, magnéticas o eléctricas y termoeléctricas. En relación con el desarrollo de la tecnología de chorro y la creación de plantas de turbinas de gas, las aleaciones de cromo-níquel resistentes al calor y resistentes al calor son especialmente importantes. Las aleaciones de níquel se utilizan en la construcción de reactores nucleares.
Se consume una cantidad significativa de níquel para la producción de pilas alcalinas y revestimientos anticorrosión. El níquel maleable en estado puro se utiliza para la fabricación de láminas, tubos, etc. También se usa en industria química para la fabricación de equipos químicos especiales y como catalizador para muchos procesos químicos. El níquel es un metal muy escaso y, si es posible, debe ser reemplazado por otros materiales más baratos y comunes.
Se utiliza en la fabricación de sistemas de brackets (níqueluro de titanio), prótesis. Es ampliamente utilizado en la producción de monedas en muchos países. En los Estados Unidos, la moneda de 5 centavos se conoce coloquialmente como el níquel. El níquel también se utiliza para la producción de cuerdas de instrumentos musicales.
Níquel - Ni
CLASIFICACIÓN
| Strunz (octava edición) | 1/A.08-10 |
| Nickel-Strunz (décima edición) | 1.AA.05 |
| Dana (séptima edición) | 1.1.17.2 |
| Dana (octava edición) | 1.1.11.5 | Hola, CIM Ref. | 1.61 |
Las propiedades del níquel son parámetros importantes para encontrar, procesar y aplicar el metal. Se tienen en cuenta a la hora de formar composiciones con otros materiales.
Las propiedades del níquel determinan su uso en la producción.
El níquel es un metal con un característico color blanco plateado. A una temperatura de 1453 °C, se vuelve líquido y hierve a 2732 °C. El níquel es dúctil y fácilmente maquinable bajo presión.
La propiedad química del níquel se caracteriza por su capacidad para formar compuestos con diversos grados de oxidación. En condiciones naturales, aparece una fina película de óxido sobre la superficie del metal.
El metal tiene una alta tasa de resistencia a la corrosión. El níquel no reacciona con una serie de ácidos y álcalis concentrados, pero se disuelve activamente en ácido nítrico diluido.

Al entrar en reacciones químicas, el níquel forma metales volátiles y sales solubles/insolubles
No reaccionan con el níquel.
- gases inertes;
- litio;
- potasio;
- sodio;
- cesio;
- rubidio;
- estroncio;
- bario;
- iridio;
- cesio.
El níquel se combina con el carbono para formar carbonilo, un metal de transición volátil utilizado en la producción de materiales de alta pureza. El polvo de níquel es capaz de autoencenderse al entrar en contacto con el aire para formar óxidos.
El níquel produce una serie de sales solubles e insolubles. Por ejemplo, una solución de sulfato de metal le da al líquido un color verde. Las sales insolubles suelen tener un color amarillo intenso.
Formas de encontrar metal.
En condiciones naturales, el níquel se encuentra en combinación con varios elementos químicos, y en forma de pepitas se encuentra en meteoritos de hierro.
En condiciones hidrotermales, el níquel forma compuestos con arsénico, cobalto y plata. Las concentraciones elevadas de metales están asociadas con formaciones minerales: arseniuros y sulfuros.

En la naturaleza, el níquel suele encontrarse en compuestos con otros elementos.
La materia prima para la extracción de un componente valioso es sulfuro, minerales de cobre y níquel que contienen arsénico:
- nickeline - un compuesto con arsénico;
- clorantita: piritas blancas que contienen cobalto y hierro;
- garnierita - roca de silicato que contiene magnesio;
- piritas magnéticas - un compuesto de azufre con hierro y cobre;
- gersdorfita - brillo de arsénico-níquel;
- pentlandita es un compuesto de azufre, hierro y níquel.
El contenido de metales en los organismos vivos depende de las condiciones y el medio ambiente. Algunos representantes de la flora y la fauna pueden concentrar el metal.
Los principales depósitos de mineral se encuentran en Canadá, Federación Rusa, Albania, Sudáfrica, Cuba, Grecia.
El proceso de extracción de metal de minerales implica el uso de tecnologías según el tipo de materia prima. El níquel es a veces un material de enriquecimiento menor para la roca.
Los minerales refractarios que contienen magnesio se someten a fundición eléctrica. Los minerales lateríticos que contienen hierro se procesan por el método hidrometalúrgico, seguido de un tratamiento con soluciones alcalinas.
La roca con un contenido de hierro más bajo se funde, se cuece y se funde eléctricamente. En el camino se recupera cobalto metálico o sus sales. Se observa un mayor contenido del metal en las cenizas de carbones duros en Inglaterra. Este hecho está asociado a la actividad de los microorganismos concentradores de níquel.
plasticidad y otros propiedades físicas las composiciones de níquel dependen de la pureza del material. Una ligera mezcla de azufre hace que el metal se vuelva quebradizo. La adición de magnesio al material fundido purifica la mezcla de impurezas menores con la formación de un compuesto con azufre.
Industrias donde se utiliza el níquel
Las propiedades físicas y químicas del metal determinan su uso:
- en la fabricación de acero inoxidable;
- para la formación de aleaciones que no contengan hierro;
- con el fin de aplicar recubrimientos protectores a productos por método galvánico;
- para la producción de reactivos químicos;
- en pulvimetalurgia.
El metal se utiliza en la fabricación de baterías, con la ayuda de procesos catalíticos. reacciones químicas en la producción industrial. Las aleaciones de titanio son un excelente material para fabricar prótesis dentales y dispositivos de alineación dental.
La composición a base del elemento químico N° 28 es materia prima para la acuñación de monedas, fabricación de bobinas de cigarrillos electrónicos. Se utiliza para dar cuerda a las cuerdas de los instrumentos musicales.
En la fabricación de núcleos para electroimanes, se utilizan composiciones: permalloys, que incluyen 20–60% de hierro. El níquel se utiliza en la fabricación de diversas piezas y equipos para la industria química.
Los óxidos metálicos se utilizan en la producción de vidrio, esmaltes y cerámica. La producción moderna se especializa en la fabricación de una variedad de productos laminados: alambre, cinta, láminas, tubos.

El níquel tiene una amplia gama de aplicaciones, desde revestimientos hasta productos químicos.
La resistencia a ambientes agresivos hace posible el uso de níquel laminado para el transporte de álcalis en la industria química.
Los instrumentos de aleación a base de níquel se utilizan en medicina y investigación científica. El metal se utiliza en la creación de instrumentos de precisión para control remoto procesos en la industria de la energía nuclear, instalaciones de radar.
Características de las aleaciones de níquel
En las composiciones, el metal se combina principalmente con hierro y cobalto. Se utiliza como componente de aleación maestra para la producción de varios aceros estructurales, aleaciones magnéticas y no magnéticas.
Las aleaciones metálicas basadas en el elemento químico No. 28 tienen fuerza, resistencia a las temperaturas, deformación e influencias ambientales. Su número alcanza varios miles. Las composiciones más comunes son combinaciones con cromo, molibdeno, aluminio, titanio, berilio.
Se considera que el metal es el componente de ligadura del oro, lo que le da a la joyería su característico color blanco y su fuerza. En relación a esta composición, existen opiniones sobre el efecto alérgico del níquel en la piel.
En combinación con el cromo, se forma un compuesto de nicromo, que es resistente a alta temperatura, coeficiente mínimo de resistencia eléctrica, plasticidad.
Se utiliza para la fabricación de dispositivos de calefacción, piezas, como revestimiento. La alta resistencia de la conexión permite mecanizarla, tornearla, soldarla, estamparla.

Las aleaciones de níquel tienen una alta resistencia, lo que les permite ser ampliamente utilizadas en la producción.
Un grupo especial está formado por aleaciones, que incluyen cobre. Entre ellos, los más populares son:
- monel;
- latón;
- bronce;
- alpaca
Hace más de un siglo se descubrió que una composición de hierro-níquel que contiene un 28% del metal descrito pierde sus propiedades de magnetización. Las aleaciones que contienen 36% de níquel se caracterizan por una ligera expansión lineal, lo que permite su uso en la fabricación de instrumentos y herramientas de precisión.
Esta composición, que se denomina FeNi36, se denomina invar, es decir, "invariable". La aleación Kovar que contiene 29 % de níquel, 17 % de cobalto y 54 % de hierro ha encontrado una amplia aplicación en la producción.
Tiene una alta adherencia al vidrio fundido, lo que permite que la composición se utilice para fabricar cables eléctricos que pasan a través de esta sustancia.
- En contacto con 0
- Google+ 0
- DE ACUERDO 0
- Facebook 0