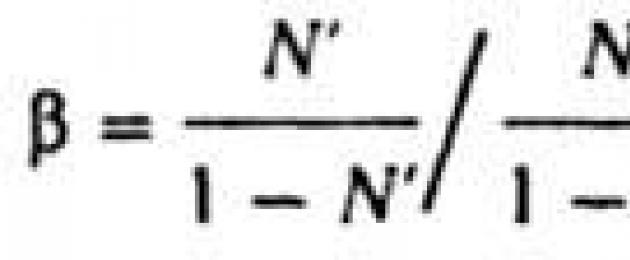Separazione isotopica- un processo tecnologico di modifica della composizione isotopica di una sostanza costituita da una miscela di diversi isotopi di un elemento chimico. Da una miscela di isotopi si ottengono all'uscita del processo due miscele: una con un contenuto aumentato dell'isotopo richiesto (miscela arricchita), l'altra con un contenuto ridotto (miscela impoverita).
L'applicazione principale del processo di separazione isotopica è l'arricchimento dell'uranio con l'isotopo 235 U per la produzione di combustibile nucleare, materiali radioattivi per armi e altre applicazioni che comportano l'uso di sostanze radioattive.
Il lavoro industriale per separare gli isotopi viene misurato in unità di lavoro di separazione (SWU). Per un certo cambiamento nella composizione isotopica di una certa miscela iniziale, è necessaria la stessa quantità di SWU, indipendentemente dalla tecnologia di separazione isotopica.
YouTube enciclopedico
1 / 5
✪ NEPTUNIO 237 - PRODUZIONE DI NETTUNO DA SALI DI URANIO. DECADIMENTO RADIOATTIVO DEL NITRATO DI NETTUNILO
✪ La Siberian Chemical Combine ha ricevuto un contratto per la produzione di isotopi stabili
✪ Chimica 8 Semplice e sostanze complesse Composizione delle sostanze
✪ 10. Elementi chimici
✪ lezione 2. Metodi di conoscenza in chimica. Precauzioni di sicurezza nelle lezioni di chimica.
Sottotitoli
Principi generali
La separazione degli isotopi (ad esempio l'estrazione di 6 Li, 235 U) è sempre associata a notevoli difficoltà, perché gli isotopi, che sono variazioni di un elemento che differiscono poco in massa, si comportano chimicamente in modo quasi identico. Ma la velocità di alcune reazioni varia a seconda dell'isotopo dell'elemento, inoltre è possibile utilizzare la differenza nella loro proprietà fisiche- ad esempio, in massa.
Comunque sia, le differenze nel comportamento degli isotopi sono così piccole che durante una fase di separazione la sostanza si arricchisce di centesimi di percentuale e il processo di separazione deve essere ripetuto ancora e ancora, un numero enorme di volte. Tecnologicamente, ciò viene effettuato facendo passare in sequenza il volume separato di isotopi attraverso celle dello stesso tipo che eseguono la separazione - cascate. Per ottenere la separazione necessaria, possono essere presenti diverse migliaia di cascate in serie e, per ottenere il volume richiesto, decine e centinaia di migliaia di tali gruppi sequenziali di cascate collegate in parallelo.
Le prestazioni di un tale sistema a cascata sono influenzate da due fattori: il grado di arricchimento in ciascuna fase e la perdita dell'isotopo desiderato nel flusso di rifiuti.
Spieghiamo il secondo fattore. Ad ogni fase di arricchimento, il flusso viene diviso in due parti: arricchita e impoverita dell'isotopo desiderato. Poiché il grado di arricchimento è estremamente basso, la massa totale dell'isotopo nella roccia di scarto può facilmente superare la sua massa nella parte arricchita. Per evitare tale perdita di preziose materie prime, il flusso esaurito di ogni fase successiva ritorna all'ingresso di quella precedente.
Il materiale di partenza non entra nella prima fase della cascata. Viene introdotto nel sistema immediatamente ad una certa ennesima fase. Grazie a ciò, fin dalla prima fase, il materiale altamente impoverito nell'isotopo principale viene smaltito come rifiuto.
Principali metodi di separazione isotopica utilizzati
- Separazione elettromagnetica
- Diffusione del gas
- Diffusione termica di gas o liquidi
- Separazione aerodinamica
- Separazione isotopica laser
- Arricchimento chimico
- Separazione fotochimica
In ogni caso, la quantità di materiale arricchito prodotto dipende dal grado desiderato di arricchimento e di impoverimento dei flussi in uscita. Se la sostanza sorgente è disponibile in grandi quantità ed è economica, la produttività della cascata può essere aumentata scartando insieme ai rifiuti una grande quantità di elemento utile non estratto (ad esempio, la produzione di deuterio dall'acqua ordinaria). Se necessario, si ottiene un maggiore grado di estrazione isotopica dalla materia prima (ad esempio durante l'arricchimento dell'uranio).
Separazione elettromagnetica
Il metodo di separazione elettromagnetica si basa sull'eguale forza di interazione tra un campo magnetico e particelle ugualmente caricate elettricamente. Tuttavia, a parità di forza, particelle di massa diversa si comporteranno diversamente. Ad esempio, la traiettoria degli ioni con uguale carica che si muovono in un campo magnetico dipenderà dalla loro massa. Posizionando le trappole in posizioni di installazione appropriate, è possibile raccogliere gli isotopi appropriati. In effetti, tali installazioni, chiamate calutroni, sono enormi spettrometri di massa. In essi, gli ioni delle sostanze separate, muovendosi in un forte campo magnetico, vengono attorcigliati con raggi proporzionali alle loro masse e cadono nei ricevitori, dove si accumulano.
Questo metodo consente di separare qualsiasi combinazione di isotopi e ha molto alto grado divisioni. Solitamente sono sufficienti due passaggi per ottenere un grado di arricchimento superiore all'80% da un materiale magro (con un contenuto iniziale dell'isotopo desiderato inferiore all'1%). Tuttavia, la separazione elettromagnetica è poco adatta alla produzione industriale: maggior parte all'interno del calutrone si depositano delle sostanze, per cui deve essere periodicamente fermato per manutenzione. Altri svantaggi sono l’elevato consumo energetico, la complessità, gli alti costi di manutenzione e le basse prestazioni. Il principale ambito di applicazione del metodo è la produzione di piccole quantità di isotopi puri per uso di laboratorio. Tuttavia, durante la seconda guerra mondiale, fu costruito l'impianto Y-12, che raggiunse una capacità di 204 grammi di U-235 all'80% al giorno nel gennaio 1945.
Efficienza. Un impianto che produce 50 kg di uranio altamente arricchito all'anno attraverso la separazione elettromagnetica ( calutrone), si stima che consumerà oltre 50 MW di elettricità.
Diffusione del gas
Questo metodo utilizza la differenza nella velocità di movimento delle molecole di gas di masse diverse. È chiaro che sarà adatto solo per sostanze allo stato gassoso.
A diverse velocità di movimento delle molecole, se le costringi a muoversi attraverso un tubo sottile, quelle più veloci e leggere supereranno quelle più pesanti. Per fare questo, il tubo deve essere così sottile che le molecole si muovano lungo di esso una ad una. Pertanto, il punto chiave qui è la produzione di membrane di separazione porose con dimensioni tipiche dei pori comprese tra decine e centinaia di nanometri. Devono essere esenti da perdite, resistere a un'elevata sovrapressione ed essere resistenti agli ambienti fluorurati. Esistevano diversi metodi per produrre membrane porose, ad esempio:
- Sinterizzazione di polveri metalliche o polimeriche in condizioni tali che rimangano spazi normalizzati tra i grani della polvere.
- Incisione di un metallo da una lega di due metalli in determinate condizioni previste struttura porosa.
- L'ossidazione elettrolitica dell'alluminio forma una struttura porosa di ossido di alluminio.
Le membrane venivano solitamente realizzate sotto forma di tubi lunghi fino a diversi metri. Una cascata di separazione è stata assemblata da diverse centinaia di tubi.
Per alcuni elementi leggeri il grado di separazione può essere piuttosto elevato, ma per l'uranio è solo 1,00429 (il flusso in uscita da ciascuno stadio è arricchito di un fattore 1,00429). Ricevere gradi più alti gli arricchimenti talvolta collegavano in serie diverse migliaia di cascate di separazione. Considerando che una tipica cascata industriale occupava un'area fino a 100 m 2 o più, le imprese di arricchimento con diffusione del gas erano di dimensioni ciclopiche. Le perdite di pressione relativamente elevate sulle membrane e le dimensioni degli impianti hanno determinato l'enorme consumo energetico dei compressori. Inoltre, l'impianto conteneva enormi quantità di esafluoruro tecnologico: dall'avvio dell'impianto al ricevimento del primo prodotto in uscita passavano talvolta diverse settimane, durante le quali l'esafluoruro riempiva sequenzialmente i volumi di tutte le cascate. Questa circostanza metteva a dura prova l'affidabilità dell'apparecchiatura, poiché il guasto anche di una sola cascata poteva causare l'arresto dell'intera catena. Per ridurre al minimo i danni derivanti dalle interruzioni del processo, le cascate sono state dotate di monitoraggio automatico delle prestazioni e bypass della cascata problematica.
Diffusione termica
In questo caso, ancora una volta, viene utilizzata la differenza nella velocità di movimento delle molecole. Quelli più leggeri, quando c'è una differenza di temperatura, tendono a finire in una zona più riscaldata. Il coefficiente di separazione dipende dal rapporto tra la differenza di massa degli isotopi e la massa totale ed è maggiore per gli elementi leggeri. Nonostante la sua semplicità, questo metodo richiede molta energia per creare e mantenere il calore. Agli albori dell’era nucleare esistevano impianti industriali basati sulla diffusione termica. Attualmente non ampiamente utilizzato da solo, tuttavia, il concetto di diffusione termica viene utilizzato per aumentare l’efficienza delle centrifughe a gas.
Centrifugazione del gas
L'idea della separazione centrifuga iniziò a essere sviluppata attivamente durante la seconda guerra mondiale. Tuttavia, le difficoltà nell’ottimizzazione della tecnologia ne hanno ritardato lo sviluppo Paesi occidentali si giunse addirittura ad un verdetto sull’inutilità economica del metodo. Anche in URSS l'introduzione industriale della tecnologia delle centrifughe è iniziata solo dopo lo sviluppo industriale della diffusione gassosa.
Se una miscela gassosa di isotopi viene fatta passare attraverso centrifughe a gas ad alta velocità, la forza centrifuga separerà le particelle più leggere o più pesanti in strati dove potranno essere raccolte. Il grande vantaggio della centrifugazione è che il coefficiente di separazione dipende dalla differenza assoluta di massa piuttosto che dal rapporto di massa. La centrifuga funziona ugualmente bene sia con elementi leggeri che pesanti. Il grado di separazione è proporzionale al quadrato del rapporto tra la velocità di rotazione e la velocità delle molecole nel gas. Pertanto è molto consigliabile far girare la centrifuga il più velocemente possibile. Le velocità lineari tipiche dei rotori rotanti sono 250-350 m/s e oltre 600 m/s nelle centrifughe avanzate. La differenza di pressione sull'asse della centrifuga e sulla parete esterna può raggiungere decine di migliaia di volte, quindi le cascate di centrifughe funzionano a basse pressioni per evitare la condensazione dell'esafluoruro. Per migliorare la separazione mediante diffusione termica, nelle centrifughe viene creato un gradiente di temperatura di diverse decine di gradi lungo l'asse della centrifuga.
Il coefficiente di separazione tipico è 1,01 - 1,1. Rispetto agli impianti a diffusione di gas, questo metodo ha ridotto il consumo energetico e una maggiore facilità di incremento della potenza. Attualmente, la centrifugazione del gas è la principale metodo industriale separazione isotopica in Russia.
Separazione aerodinamica
Questo metodo può essere considerato una variante della centrifugazione, ma invece di far roteare il gas in una centrifuga, questo rotea quando esce da un ugello speciale, dove viene alimentato sotto pressione. Questa tecnologia, basata sull'effetto vortice, è stata utilizzata dal Sud Africa e dalla Germania.
I problemi con la tecnologia erano che il raggio dell'ugello era di circa 100 micron, mentre la lunghezza totale dell'ugello in ciascuna cascata di separazione industriale ammontava a centinaia e migliaia di metri. Questa lunghezza veniva ottenuta in pezzi da diverse decine a centinaia di centimetri. Oltre alle difficoltà di produzione degli ugelli, c'era il problema del gas diluente, come l'elio. Il diluente ha permesso di mantenere l'esafluoruro di uranio in fase gassosa ad alte pressioni in ingresso agli ugelli, necessarie per creare un flusso ad alta velocità nell'ugello. All'uscita della produzione, il diluente e l'esafluoruro dovevano essere separati. Le alte pressioni hanno determinato un notevole consumo di energia.
Separazione isotopica laser (LSI)
La separazione laser no metodo indipendente, ma viene utilizzato per migliorare le prestazioni dei metodi di separazione elettromagnetica o chimica. Il metodo si basa sulla ionizzazione selettiva di uno degli isotopi mediante radiazione elettromagnetica (ad esempio luce laser). La selettività della ionizzazione si basa sull'assorbimento risonante (a banda stretta) della luce da parte degli atomi. Ciò significa che è possibile selezionare i parametri di irradiazione ai quali gli atomi di un dato isotopo vengono prevalentemente ionizzati. Ulteriori atomi ionizzati possono essere separati, ad esempio, in un campo magnetico (AVLIS (Inglese) russo). Inoltre, la ionizzazione degli atomi può modificare la velocità delle reazioni chimiche, ad esempio rendendo più semplice la scomposizione di alcuni atomi. composti chimici(MLIS (Inglese) russo).
La tecnologia di separazione laser è stata sviluppata a partire dagli anni ’70 da molti paesi ed è considerata promettente, ma non è ancora andata oltre lavoro di ricerca. Negli anni '90 del secolo scorso negli Stati Uniti esisteva un programma di ricerca sull'arricchimento laser con separazione elettromagnetica in un impianto sperimentale, ma fu chiuso. Attualmente è in corso negli Stati Uniti un programma di ricerca presso un impianto dimostrativo di una delle opzioni di arricchimento laser con separazione chimica denominata SILEX (Inglese) russo. La tecnologia è stata sviluppata nel 1992 dalla società australiana Silex. Dal 2006, il lavoro sulla tecnologia Silex è stato svolto da Global Laser Enrichment LLC. È stata ottenuta una licenza per costruire uno stabilimento a Wilmington, nella Carolina del Nord.
Arricchimento chimico
L'arricchimento chimico sfrutta le differenze nella velocità delle reazioni chimiche con diversi isotopi. Funziona meglio quando si separano elementi leggeri, dove la differenza è significativa. Nella produzione industriale si utilizzano reazioni che coinvolgono due reagenti in fasi diverse (gas/liquido, liquido/solido, liquidi immiscibili). Ciò semplifica la separazione dei flussi ricchi e magri. Utilizzando la differenza di temperatura aggiuntiva tra le fasi, si ottiene un ulteriore aumento del coefficiente di separazione. Oggi, la separazione chimica è la tecnologia che consente il maggior risparmio energetico per la produzione di acqua pesante. Oltre alla produzione di deuterio, viene utilizzato per estrarre 6 Li. In Francia e Giappone furono sviluppati metodi di arricchimento chimico dell'uranio, ma non raggiunsero mai lo sviluppo industriale.
Distillazione
La distillazione (distillazione) utilizza la differenza nei punti di ebollizione di isotopi di masse diverse. In genere, quanto più piccola è la massa di un atomo, tanto più basso è il punto di ebollizione di questo isotopo. Ancora una volta, questo funziona meglio su elementi leggeri. La distillazione viene utilizzata con successo come fase finale nella produzione di acqua pesante.
Separazione isotopica- un processo tecnologico in cui da un materiale costituito da una miscela di diversi isotopi di uno elemento chimico, si distinguono i singoli isotopi di questo elemento. La separazione degli isotopi è sempre associata a notevoli difficoltà, poiché gli isotopi, che sono variazioni di un elemento che differiscono poco in massa, si comportano chimicamente in modo quasi identico. Ma la velocità di alcune reazioni varia a seconda dell'isotopo dell'elemento, inoltre è possibile utilizzare la differenza nelle loro proprietà fisiche, ad esempio in massa. Le differenze nel comportamento degli isotopi sono così piccole che durante una fase di separazione la sostanza si arricchisce di centesimi di percentuale e il processo di separazione deve essere ripetuto ancora e ancora, un numero enorme di volte. Le prestazioni di un tale sistema a cascata sono influenzate da due fattori: il grado di arricchimento in ciascuna fase e la perdita dell'isotopo desiderato nel flusso di rifiuti.
Metodi di base della separazione isotopica
Separazione elettromagnetica
Il metodo della separazione elettromagnetica si basa sui diversi effetti di un campo magnetico su particelle di massa diversa ugualmente caricate elettricamente. Le macchine, chiamate calutroni, sono enormi spettrometri di massa. Gli ioni delle sostanze separate, muovendosi in un forte campo magnetico, vengono attorcigliati con raggi proporzionali alla loro massa e cadono nei ricevitori, dove si accumulano.
Questo metodo consente la separazione di qualsiasi combinazione di isotopi e ha un grado di separazione molto elevato. Due passaggi sono solitamente sufficienti per ottenere un tasso di arricchimento superiore all'80% da un materiale magro (con un contenuto iniziale dell'isotopo desiderato inferiore all'1%). Tuttavia, la separazione elettromagnetica è poco adatta alla produzione industriale: la maggior parte delle sostanze si depositano all'interno del calutrone, per cui deve essere periodicamente fermato per manutenzione. Altri svantaggi sono l’elevato consumo energetico, la complessità, gli alti costi di manutenzione e le basse prestazioni. Il principale ambito di applicazione del metodo è la produzione di piccole quantità di isotopi puri per uso di laboratorio.
Diffusione del gas
Questo metodo utilizza la differenza nella velocità di movimento delle molecole di gas di masse diverse. È chiaro che sarà adatto solo per sostanze allo stato gassoso. A diverse velocità di movimento delle molecole, se le costringi a muoversi attraverso un tubo sottile, quelle più veloci e leggere supereranno quelle più pesanti. Per fare questo, il tubo deve essere così sottile che le molecole si muovano lungo di esso una ad una. Pertanto, la chiave qui è produrre membrane porose per la separazione. Devono prevenire perdite e resistere alla pressione eccessiva.
Per alcuni elementi leggeri il grado di separazione può essere piuttosto elevato, ma per l'uranio è solo 1,00429 (il flusso in uscita da ciascuno stadio è arricchito di un fattore 1,00429). Pertanto, le imprese di arricchimento per diffusione del gas hanno dimensioni ciclopiche e comprendono migliaia di fasi di arricchimento.
Centrifugazione del gas
Questa tecnologia è stata sviluppata per la prima volta in Germania durante la seconda guerra mondiale, ma non è stata utilizzata a livello industriale fino all'inizio degli anni '50. Se una miscela gassosa di isotopi viene fatta passare attraverso centrifughe ad alta velocità, la forza centrifuga separerà le particelle più leggere o più pesanti in strati dove potranno essere raccolte. Il grande vantaggio della centrifugazione è che il coefficiente di separazione dipende dalla differenza assoluta di massa piuttosto che dal rapporto di massa. La centrifuga funziona ugualmente bene sia con elementi leggeri che pesanti. Il grado di separazione è proporzionale al quadrato del rapporto tra la velocità di rotazione e la velocità delle molecole nel gas. Pertanto è molto consigliabile far girare la centrifuga il più velocemente possibile. Le velocità lineari tipiche dei rotori rotanti sono 250-350 m/s e oltre 600 m/s nelle centrifughe avanzate.
Il coefficiente di separazione tipico è 1,01 - 1,1. Rispetto agli impianti a diffusione di gas, questo metodo ha ridotto il consumo di energia e una maggiore facilità di incremento della potenza. Attualmente, la centrifugazione del gas lo è il principale metodo industriale di separazione isotopica in Russia.
Produttori di isotopi stabili: la Rosatom State Corporation comprende imprese impegnate nella produzione industriale di isotopi di massa media e pesante, nonché di isotopi di gas nobili. Le tecnologie elettromagnetiche e delle centrifughe a gas vengono utilizzate per la separazione industriale degli isotopi. Queste tecnologie consentono di separare gli isotopi di quasi tutti gli elementi della tavola periodica. Il numero di imprese della Rosatom State Corporation che utilizzano questi metodi di separazione isotopica include quanto segue:
- Impianto "Electrokhimpribor" dell'impresa unitaria dello Stato federale - 209 articoli (metodo elettromagnetico).
- L'impianto elettrochimico della OJSC Production Association produce 95 tipi di isotopi (metodo della centrifuga a gas).
- OJSC "Siberian Chemical Plant" - 91 nomi di isotopi (metodo della centrifuga a gas).
- FSUE "RFNC-VNIIEF" - 24 articoli (metodo con centrifuga a gas)
Ionizza, quindi gli ioni vengono accelerati elettricamente. campo e cadere nello spartiacque. camera dove, sotto l'influenza del magnetico campo perpendicolare alla direzione del moto degli ioni, la miscela viene divisa in fasci separati con identici valori m/z; i raggi vengono poi raccolti in diversi ricevitori. Questo metodo può isolare tutti gli isotopi di un dato elemento. Viene utilizzato per ottenere piccole quantità di isotopi superiori a 50 elementi; Per la prima volta ne sono stati ottenuti diversi utilizzando questo metodo. kg 235 U (1943-45). Svantaggi del metodo: bassa produttività, basso utilizzo di materie prime, complessità delle attrezzature, elevato consumo energetico.
Metodo fotochimico(Separazione isotopica laser) si basa sul fatto che molecole di diversa composizione isotopica vengono eccitate dalla radiazione. lunghezza d'onda. Utilizzando monocromatico La radiazione laser può eccitare selettivamente le molecole contenenti un isotopo specifico di un dato elemento. Le molecole eccitate vengono quindi separate mediante mezzi chimici. r-zioni, esposizione all'elettricità. campi o altro metodo. Il metodo può essere utilizzato per qualsiasi elemento. Per ora viene utilizzato solo in laboratorio. scala; di base le difficoltà sono legate alla necessità di mantenere la selettività in tutte le fasi successive all'assorbimento di un quanto di luce (vedi Chimica dei laser).
Metodi di separazione del secondo gruppo si basano sulla distribuzione non uniforme di molecole di diversa composizione isotopica tra due fasi del sistema o tra due zone della stessa fase, in cui le differenze vengono mantenute. valori di temperatura, pressione, elettrici. potenziale o altro parametro. Se, cambiando lo stato aggregativo di parte della miscela o per l'influenza di un campo, la miscela iniziale viene divisa in due frazioni con contenuti isotopici diversi, allora quella elementare si separerà. l'effetto di tale operazione è caratterizzato dal coefficiente di separazione UN . Per una miscela di due isotopi
dove N" e N : frazioni molari dell'isotopo rilasciato nelle frazioni arricchite e impoverite. La variazione della composizione isotopica della frazione arricchita rispetto alla miscela in ingresso è caratterizzata dal coefficiente di arricchimento

dove N è la frazione molare dell'isotopo rilasciato nella miscela in entrata. Grandezza B può assumere valori compresi tra 1 e UN a seconda del rapporto tra le masse delle frazioni arricchite e impoverite.
Per separare gli isotopi di tutte le sostanze chimiche. Negli elementi (eccetto l'idrogeno) il valore di a è solo leggermente maggiore di 1. Pertanto, l'elementale si dividerà. l'effetto è moltiplicato in cascate o colonne. Le cascate sono elementi collegati in serie di un singolo divisore. azioni (passi). Nel cosiddetto in cascata semplice la frazione arricchita del primo stadio viene alimentata al secondo stadio, ripetere
operazione di separazione, quindi la frazione arricchita del secondo stadio viene alimentata al terzo stadio, ecc. Per risparmiare il materiale di partenza, le frazioni impoverite degli stadi distanti, che si arricchiscono nell'isotopo target rispetto alla miscela iniziale, non vengono scartati, ma vengono utilizzati come complemento. materie prime nelle fasi precedenti (viene effettuato il ricircolo dei flussi). Molto spesso, la frazione impoverita della placenta. i passaggi (frazione molare dell'isotopo rilasciato N: i+1) vengono riportati al passaggio precedente (Fig. 1). In ottimale opzione, la composizione della frazione restituita i-esimo stadio, deve essere identico alla composizione della frazione arricchita dello stadio precedente (i - 1) che entra in questo stadio (frazione molare N" i -
1). Se i valori B per tutti gli stadi il grado di separazione raggiunto in tale cascata (detto ideale) è lo stesso

dove N p e N 0 sono le frazioni molari dell'isotopo nel prodotto e nella miscela iniziale, n è il numero di stadi della cascata.
Riso. 1. Schema di una cascata con ricircolo del flusso della miscela (N - frazione molare dell'isotopo rilasciato; N 0 - nella miscela iniziale; N" i e N: i - rispettivamente nelle frazioni arricchite e impoverite dello stadio i ; N p - nel prodotto (N p = N" n); N w nei rifiuti (N w - N: 1).
Per ridurre i costi energetici per lo spostamento dei flussi, ridurre il volume delle apparecchiature e il periodo iniziale. Gli accumuli di isotopi (vedi sotto) di solito riducono i flussi quando si passa dagli stadi bassi a quelli superiori, cioè conducono il processo in modo tale che la frazione arricchita di un dato stadio abbia una massa inferiore rispetto alla frazione arricchita dello stadio precedente. In alcuni casi vengono utilizzate cascate senza ridurre i flussi (le cosiddette cascate rettangolari). Gli analoghi di una cascata rettangolare sono divisori controcorrente. colonne, ad esempio colonne di distillazione. Nelle cascate, il movimento dei flussi tra gli stadi viene effettuato utilizzando pompe o altri dispositivi, in colonne per convezione. flussi derivanti da differenze di densità, eccesso di pressione, elettrici. potenziale, ecc. In questo caso, in ciascuna sezione trasversale della colonna, gli isotopi vengono ridistribuiti tra flussi che si muovono in direzioni opposte (secondo l'effetto di separazione elementare). Ottenere in una cascata rettangolare (o in una colonna controcorrente) gradi di separazione maggiori che in una singola operazione (q > B ), parte del flusso arricchito in uscita dall'ultimo stadio viene restituito alla cascata o colonna (Fig. 2) e il flusso viene invertito (ad esempio evaporazione del liquido o condensazione del vapore durante la rettifica).
L'accumulo dell'isotopo bersaglio inizia alla fine della cascata (o colonna), dove, a causa dell'inversione del flusso, le frazioni o i flussi in contatto vengono portati fuori dall'equilibrio. Di conseguenza, una frazione con diversi
contenuto più elevato dell'isotopo target rispetto alla frazione impoverita rimossa da questa fase. Placenta. la ridistribuzione degli isotopi porta ad un aumento della concentrazione dell'isotopo rispetto a quella iniziale in entrambe le frazioni che escono da questo stadio. Man mano che il processo procede, aumenta l'arricchimento alla fine della cascata, gli stadi sempre più distanti dal luogo di circolazione del flusso si allontanano dallo stato di equilibrio e aumenta la lunghezza della parte arricchita della cascata. Raggiunto il grado di separazione richiesto, al termine della cascata si inizia la raccolta del prodotto. Quindi la cascata (o colonna) funziona in modalità stazionaria.

Riso. 2. Schema di una colonna controcorrente con inversione di flusso.
A causa di piccole differenze UN da 1, e anche a causa del basso per i plurali. elementi delle concentrazioni iniziali dell'isotopo target, il periodo di accumulo dell'isotopo (periodo di avvio dell'impianto) è di centinaia e migliaia di ore. Per caratterizzare l'efficienza delle colonne si utilizza il concetto di altezza equivalente a quella teorica. stadio (HETS), - l'altezza della sezione della colonna, sulla quale, in modalità stazionaria, le composizioni dei flussi in uscita sono correlate nello stesso rapporto di un'unica divisione. operazioni. Per cascata a colonna o rettangolare max. il grado di separazione si ottiene lavorando senza selezione del prodotto. In queste condizioni q = UN n, dove n è il numero di stadi in cascata o il numero di stadi di separazione di colonne equivalenti. Quando si lavora con la selezione del prodotto, il grado di separazione diminuisce.
Di base da cui dipendono le caratteristiche del processo di separazione isotopica UN : produttività (numero di prodotti prodotti per unità di tempo) e lnq sono proporzionali a ( UN- 1), quantità di sostanze ed energia trasformate in cascata. i costi sono inversamente proporzionali ( UN - 1) 2, il periodo iniziale diminuisce all'aumentare UN . Di norma, per ottenere l'arricchimento desiderato sono necessari un gran numero di fasi, la lavorazione di grandi flussi di materiale e grandi costi energetici. Pertanto, la scelta delle condizioni è molto importante, in quali differenze UN da 1 sarebbe il massimo. Ogni metodo ha la propria dipendenza UN sulle proprietà delle molecole da separare e sulle condizioni di separazione. In una approssimazione approssimativa per la maggior parte dei metodi, il valore ( UN - 1) proporzionale (M 1-
M 2)/M 1, dove M 1 e M 2 sono le masse di molecole isotopicamente diverse.
Diamo un'occhiata alle basi. Metodi utilizzati per separare gli isotopi.
Distillazione. La separazione isotopica si basa sulle differenze nella composizione di equilibrio di liquido e vapore. Tipicamente, un composto contenente un isotopo leggero è concentrato nel vapore. Il valore di a è uguale al rapporto delle pressioni di saturazione. coppia (volatilità) di composti isotopicamente diversi, diminuisce con l'aumentare della mol. masse e provarci. Gli isotopi sono separati in colonne controcorrente. Utilizzato per uso industriale separazione degli isotopi dell'idrogeno e, su scala minore, B, C, N, O.
Scambio isotopico. La separazione isotopica è dovuta alla differenza dall'unità nella costante di equilibrio dello scambio di isotopi di un dato elemento tra due composti in fasi di contatto (molto spesso liquido e gas, ma sono anche sistemi liquido-liquido, liquido-solido e gas-solido usato). Effettuato in colonne controcorrente. Il calore termico viene utilizzato per invertire i flussi. o elettrochimico decomposizione o r-zione con ausiliario. v-tu. Ad esempio, quando si concentra l'isotopo 10 B mediante scambio tra BF 3 e il suo composto con anisolo, quest'ultimo si decompone quando riscaldato. e BF 3 viene restituito alla colonna. Quando si separano gli isotopi del litio
Attraverso lo scambio tra l'amalgama e le soluzioni saline, il litio viene trasferito all'amalgama mediante elettrolisi della soluzione salina su un elettrodo di mercurio fluente. Quando si concentra l'isotopo 15 N mediante scambio tra HNO 3 e NO, l'azoto viene ridotto con anidride solforosa.
Nel caso della separazione degli isotopi dell'idrogeno non vengono utilizzati processi di scambio isotopico con inversione di flusso perché Più economico è lo schema a due temperature (Fig. 3), in cui, invece di trasferire l'intera miscela arricchita in un'altra fase mediante conversione. una connessione in un altro utilizzano lo scambio isotopico tra le stesse connessioni. (ad esempio H 2 O e H 2 S) a una temperatura più alta (più bassa UN ). Di conseguenza, dalla fase in uscita dalla colonna fredda (H 2 O) alla fase in entrata (H 2 S), viene trasferita una quantità di isotopo accumulato in eccesso rispetto a quella iniziale. L'acqua arricchita di deuterio viene scaricata al confine tra le colonne fredda e calda.
Lo scambio isotopico viene utilizzato per scopi industriali. separazione degli isotopi degli elementi leggeri: idrogeno, Li, B, N, C.

Riso. 3. Schema di concentrazione del deuterio a due temperature (T 2 > T 1).
Centrifugazione. La separazione isotopica si basa sulla distribuzione dei componenti della miscela di gas in un campo centrifugo. Viene eseguito in una centrifuga a gas in controcorrente, che è uno stretto cilindro verticale che ruota attorno al proprio asse ad alta velocità. L'isotopo pesante è concentrato alla periferia del cilindro, l'isotopo leggero è concentrato vicino al suo asse. A causa delle differenze di densità, la miscela si muove verso l'alto lungo l'asse e verso il basso lungo la periferia. A differenza di altri metodi, viene determinato l'abs. la differenza nelle masse degli isotopi separati M 1 e M 2, e non relativi (M 1 - M 2)/M 1, pertanto il metodo viene utilizzato sia per gli elementi leggeri che per quelli pesanti (C, Kr, Xe, U).
Effusione di gas. Il metodo si basa sul fatto che quando dicono. Durante il flusso (effusione) di una miscela di molecole isotopicamente sostituite attraverso una partizione porosa con fori, il cui diametro è inferiore al percorso libero delle molecole di gas, le molecole leggere penetrano attraverso la partizione più velocemente di quelle pesanti. Massimo. Senso ![]() . La separazione isotopica viene effettuata in una cascata di passaggi. Ogni stadio è una camera divisa da un setto poroso, da un lato viene pompata tramite una pompa la miscela gassosa da separare. La miscela che attraversa il divisorio risulta arricchita di un isotopo leggero. Il metodo viene utilizzato per la separazione degli isotopi H, He, C, nonché per scopi industriali. concentrazione 235 U (come UF 6).
. La separazione isotopica viene effettuata in una cascata di passaggi. Ogni stadio è una camera divisa da un setto poroso, da un lato viene pompata tramite una pompa la miscela gassosa da separare. La miscela che attraversa il divisorio risulta arricchita di un isotopo leggero. Il metodo viene utilizzato per la separazione degli isotopi H, He, C, nonché per scopi industriali. concentrazione 235 U (come UF 6).
Diffusione Macc. La separazione isotopica si basa sulla differenza nelle velocità di diffusione delle molecole di gas isotopi sostituiti nel flusso ausiliario. separazione del vapore. Ausiliario il vapore deve avere un coefficiente elevato. diffusione nella miscela in fase di separazione e si separa facilmente da essa. Spesso come ausiliario. coppia usa coppie. La separazione isotopica viene effettuata in una cascata di stadi (chiamati pompe) o in una colonna in controcorrente. Lo stadio a semplice effetto è un cilindro, all'interno del quale è posto coassialmente un cilindro. diaframma con fori diametro ca. 10 micron (Fig. 4). Centro il canale si sta muovendo come ausiliario. vapore, separando la miscela lungo l'intercapedine anulare tra il canale e la parete del cilindro in senso opposto. Le molecole della miscela si diffondono nei fori del diaframma attraverso il controcorrente dell'ausiliario. paio . Uscendo dal centro. incanalare parte della miscela portata via dall'ausiliario. vapore, arricchito con un isotopo leggero, lascia il canale anulare con uno pesante.
Nella colonna controflusso aiuterà. il vapore viene erogato uniformemente su tutta l'altezza della colonna attraverso un tubo forato,
posto lungo l'asse, si diffonde attraverso i fori alle pareti della colonna e si condensa. Elementare dividerà. l'effetto si verifica in ciascuna sezione trasversale a causa della diffusione delle molecole isotopicamente sostituite della miscela gassosa verso l'asse della colonna. Di conseguenza, la concentrazione dell'isotopo leggero aumenta vicino all'asse e la concentrazione dell'isotopo pesante vicino alle pareti. Le differenze di densità, nonché il movimento della pellicola di condensa lungo la parete, provocano la convezione. flussi diretti verso l'alto vicino all'asse e verso il basso verso le pareti. Il metodo viene utilizzato per separare gli isotopi Ne, Ar e C.

Riso. 4. Schema della fase di diffusione di massa: 1 - evaporatore; 2 - diaframma; 3 - condensa superficie; 4 - condensatore.
9.2. Per definizione, gli isotopi di un elemento differiscono per la massa, ma non per le proprietà chimiche. Più precisamente, sebbene le masse dei nuclei degli isotopi e la loro struttura siano diverse, le cariche dei nuclei sono le stesse, e quindi i gusci elettronici esterni sono quasi identici. Pertanto, per la maggior parte degli scopi pratici, gli isotopi di un elemento possono essere separati solo tramite processi che dipendono dalla massa del nucleo.
9.3. È noto che le molecole di un gas o di un liquido sono in continuo movimento e che la loro energia cinetica media dipende solo dalla temperatura e non dipende dalle proprietà chimiche della molecola. Pertanto, in un gas costituito da una miscela di due isotopi, l'energia cinetica media delle molecole leggere e pesanti sarà la stessa. Poiché l’energia cinetica di una molecola è pari a 1/2 mv2, dove m è la massa e v è la velocità della molecola, è ovvio che, in media, la velocità della molecola più leggera dovrebbe essere maggiore della velocità della molecola quello più pesante. Pertanto, secondo almeno in linea di principio, qualsiasi processo che dipenda da velocità media le molecole possono essere utilizzate per separare gli isotopi. Sfortunatamente, la velocità media è inversamente proporzionale alla radice quadrata della massa, quindi per i composti gassosi degli isotopi dell'uranio questa differenza è molto piccola. Inoltre, sebbene le velocità medie differiscano, gli intervalli di velocità si sovrappongono in larga misura. Pertanto, nel caso dell'esafluoruro di uranio gassoso, più del 49% delle molecole leggere hanno le stesse basse velocità del 50% delle molecole pesanti.
9.4. Ovviamente non esiste un modo pratico per candidarsi forze meccaniche direttamente alle singole molecole; non possono essere spinti con un bastone o tirati con una corda. Tuttavia, sono influenzati dai campi gravitazionali o, se le molecole sono ionizzate, elettrici e magnetici. Le forze gravitazionali sono proporzionali alla massa. In un vuoto molto spinto, gli atomi dell'U-235 e dell'U-238 cadranno con la stessa accelerazione, ma proprio come una piuma e una pietra cadono a velocità diverse nell'aria, dove ci sono forze di attrito che si oppongono al movimento, sono possibili condizioni in che una combinazione di forze gravitazionali e forze opposte im intramolecolari farà sì che gli atomi pesanti si muovano diversamente da quelli leggeri. I campi elettrici e magnetici sono più facili da controllare rispetto a quelli gravitazionali o “pseudo-gravitazionali” (cioè i campi di forza centrifuga) e sono molto efficaci nel separare ioni di masse diverse.
9.5. Oltre alle forze gravitazionali o elettromagnetiche, esistono forze intraatomiche e intramolecolari. Queste sono le forze di interazione tra le molecole e determinano la velocità delle reazioni chimiche, dei processi di evaporazione, ecc. In generale, tali forze dipendono dagli elettroni esterni delle molecole e non dalla massa del nucleo. Tuttavia, laddove le forze di interazione tra singoli atomi o molecole portano alla formazione di nuove molecole, si avverte l'influenza della massa (solitamente molto piccola).
In conformità con le leggi della meccanica quantistica, i livelli energetici delle molecole cambiano leggermente e in modi diversi per i diversi isotopi. Ciò, come vedremo, provoca alcuni cambiamenti nel comportamento dei due isotopi in alcune reazioni chimiche, sebbene la differenza di comportamento sia molto minore della solita differenza di comportamento chimico elementi diversi.
9.6. Pertanto, i principali fattori da tenere presenti nella scelta di un processo di separazione sono: l'uguaglianza dell'energia cinetica termica media delle molecole ad una data temperatura; effetti gravitazionali o centrifughi proporzionali alla massa delle molecole; forze elettriche o magnetiche che influenzano le molecole ionizzate e forze intraatomiche o intramolecolari. Alcuni processi di separazione isotopica utilizzano solo uno di questi fattori ed è possibile prevedere il grado complessivo di separazione. In altri processi di separazione, molti di questi fattori si verificano simultaneamente, per cui tale previsione diventa difficile.
CRITERI DI VALUTAZIONE DEL PROCESSO DI SEPARAZIONE
9.7. Prima di procedere a una considerazione dettagliata dei singoli processi di separazione isotopica, scopriremo quali requisiti generali sono imposti a questo processo. I criteri principali per giudicare il processo di separazione isotopica sono descritti di seguito.
FATTORE DIVISIONE9.8. Il coefficiente di separazione, o come viene talvolta chiamato, il coefficiente di arricchimento di qualsiasi processo di separazione, è il rapporto tra la concentrazione relativa dell'isotopo isolato dopo l'arricchimento e la sua concentrazione relativa nel prodotto originale. Più precisamente, se prima della separazione i numeri di atomi isotopici con masse m1 e m2 sono rispettivamente pari a n 1 e n 2 (per 1 g di miscela isotopica), e dopo la separazione i numeri corrispondenti sono n" 1 e n" 2, allora il coefficiente di separazione è
Questa definizione si applica sia ad un singolo stadio di un impianto di separazione che ad un intero impianto composto da più stadi. Di solito siamo interessati al fattore di separazione di uno stadio o coefficiente complessivo separazione dell’intero processo. Se r differisce poco dall'unità, come spesso accade per uno stadio, a volte è più conveniente utilizzare il valore r-1 invece di r. Il valore r-1 è chiamato fattore di arricchimento. Nell'uranio naturale m 1 = 235, m 2 = 238 e n 1 / n 2 = 1/140, nel 90% U-235, n " 1 / n " 2 = 9/1. Pertanto, quando si ottiene il 90% di U-235 dall'uranio naturale significato generale il valore r dovrebbe essere intorno a 1260.
PRESTAZIONE9.9. Per quasi tutti i metodi di separazione un elevato fattore di separazione va a scapito di una bassa resa. In futuro, salvo diversa indicazione, esprimeremo la produttività come U-235 puro. Quindi, se, ad esempio, un apparecchio di separazione ha un coefficiente di separazione pari a 2 (cioè n1" / n2" = 1/70) e una produttività di 1 grammo al giorno, ciò significa che dall'uranio naturale questo apparecchio ricava un prodotto in un giorno, costituito da una miscela di 1 g di U-235 e 70 g di U-238.
9.10. La quantità totale di materiale contenuto nell'unità di separazione è chiamata "carico". Il carico può raggiungere valori molto elevati in un impianto composto da gran numero passi.
PERIODO DI AVVIO9.11. In un impianto di separazione con un carico elevato è necessario un tempo piuttosto lungo - settimane o mesi - dall'avvio al raggiungimento delle condizioni operative stazionarie. Nel calcolo dei tempi, a questo “periodo di avviamento”, o periodo di stabilizzazione, va sommato il tempo di realizzazione dell'impianto.
EFFICIENZA9.12. Della quantità totale di materia prima che entra nell'impianto di separazione, una parte si arricchirà della componente leggera, una parte si esaurirà e una parte rimarrà invariata. Alcune di ciascuna di queste tre frazioni andranno perse e altre verranno rigenerate. Ovviamente, è importante disporre di un metodo per il recupero ad alta produttività della sostanza arricchita. In alcuni processi la quantità di sostanza inalterata è trascurabile; ma in alcuni, soprattutto nel metodo elettromagnetico descritto di seguito, è la frazione più grande, e quindi l'efficienza con cui viene recuperata per il riciclo è piuttosto significativa. L'importanza della rigenerazione del prodotto esaurito dipende in modo significativo dal grado di esaurimento della discarica. Pertanto, in generale, il concetto di efficienza non è del tutto univoco.
PREZZO9.13. Come per tutte le parti del progetto sull’uranio, il risparmio di tempo è stato molto più importante dei costi dei materiali. Pertanto, un certo numero di grandi impianti di separazione per l'U-235 e il deuterio erano più costosi di quanto sarebbe stato necessario se la costruzione fosse stata ritardata di diversi mesi o anni fino allo sviluppo di processi più avanzati.
ALCUNI METODI DI SEPARAZIONE
DIFFUSIONE DEL GAS9.14. Già nel 1896, Lord Rayleigh dimostrò che una miscela di due gas di diverso peso atomico poteva essere parzialmente separata facendo diffondere la miscela attraverso un divisorio poroso nel vuoto. Le molecole di gas leggero, a causa della loro velocità media più elevata, si diffondono più velocemente attraverso il divisorio, per cui il gas che è passato attraverso il divisorio si arricchisce del componente più leggero e il gas rimanente (che non è passato attraverso il divisorio) viene impoverito della componente leggera. Un gas arricchito al massimo nella componente luminosa si otterrà quando la quantità di gas diffuso sarà così piccola da non provocare un notevole impoverimento del gas rimanente. Se il processo di diffusione continua finché quasi tutto il gas non è passato attraverso il divisorio, l'arricchimento medio del gas attraversato diminuisce naturalmente. Il prossimo capitolo esaminerà questo fenomeno più in dettaglio. Qui facciamo solo notare che assumendo che le velocità di diffusione siano inversamente proporzionali alle radici quadrate di pesi molecolari, si ottiene per il coefficiente di separazione nella fase iniziale del processo di diffusione, detto “coefficiente di separazione ideale” ?, la seguente espressione:
dove M1 è il peso molecolare del gas più leggero e M2 è il peso molecolare del gas più pesante. Applicando questa formula al caso dell'uranio, ci si può convincere della difficoltà del compito di separarne gli isotopi.
Poiché l'uranio stesso non è un gas, per la separazione è necessario utilizzare alcuni suoi composti gassosi. L'unica soluzione adatta è l'esafluoruro di uranio, UF 6, che ha una pressione di vapore di un'atmosfera a 56 °C. Poiché il fluoro ha un solo isotopo, i composti dell'esafluoruro sono U 235 F 6 e U 238 F 6 con pesi molecolari rispettivamente di 349 e 352.
Pertanto, se si lascia diffondere una piccola quantità di esafluoruro di uranio attraverso un setto poroso, il gas che lo attraversa si arricchirà del composto U 235 F 6 con un coefficiente

che è molto lontano dai 1260 richiesti (vedi paragrafo 9.8).
9.15. Questo calcolo potrebbe dare l'impressione che sia inutile separare gli isotopi (tranne forse gli isotopi dell'idrogeno) mediante processi di diffusione. In realtà, tuttavia, tali metodi possono essere applicati con successo, anche per l'uranio. Il metodo che venne utilizzato per la prima volta da F.W. Aston nella separazione parziale degli isotopi (neon) fu proprio il metodo della diffusione del gas. Successivamente, G. Hertz e altri, lavorando con unità di diffusione multistadio con ricircolo, furono in grado di ottenere una separazione quasi completa degli isotopi del neon. Poiché il sistema di ricircolo a più stadi è necessario in quasi tutti i metodi di separazione, verrà descritto in dettaglio subito dopo le osservazioni introduttive sui diversi metodi a cui è rilevante.
DISTILLAZIONE FRAZIONATA9.16. La separazione mediante distillazione di miscele di sostanze con diversi punti di ebollizione, cioè diverse pressioni di vapore, è un processo ben noto nell'industria. La separazione dell'alcol e dell'acqua (differenza del punto di ebollizione di circa 20 °C) viene solitamente effettuata in un semplice alambicco, senza l'uso di alcun apparato diverso da un evaporatore e un condensatore. La materia condensata (condensato) può essere raccolta e distillata nuovamente, se necessario, più volte. Per separare composti con punti di ebollizione molto vicini sarebbe troppo difficile effettuare il numero richiesto di evaporazioni e condensazioni successive. Viene invece utilizzato un metodo di separazione continua in una colonna di separazione. Il compito principale di questa colonna è creare un flusso di vapore. diretto verso l'alto e il flusso di liquido che scorre verso il basso: entrambi i flussi sono in stretto contatto e si scambiano costantemente molecole. Le molecole nella frazione con punto di ebollizione inferiore hanno una tendenza relativamente maggiore ad entrare nel flusso di vapore e viceversa. Questo metodo di distillazione in controcorrente può essere utilizzato per separare l'acqua leggera da quella pesante, i cui punti di ebollizione differiscono di 1,4 °C.
APPLICAZIONE DEL CONTROFLUSSO9.17. Il metodo in controcorrente è utile non solo nei processi di distillazione a due fasi (gas liquido), ma anche in altri casi di separazione, come la diffusione sotto l'influenza di gradienti di temperatura all'interno di sistemi monofase o la separazione sotto l'influenza di forze centrifughe. Il controflusso può essere formato da due gas, due liquidi oppure gas e liquido.
CENTRIFUGAZIONE9.18. Abbiamo già notato che la separazione gravitazionale di due isotopi è possibile perché le forze gravitazionali che fanno muovere le molecole verso il basso sono proporzionali ai pesi molecolari, e le forze intramolecolari che si oppongono a questo movimento dipendono dalla configurazione degli elettroni, non dai pesi molecolari. Poiché il metodo della centrifugazione è essenzialmente un metodo per applicare grandi forze pseudogravitazionali, è sempre stato considerato un metodo adatto alla separazione isotopica. I primi esperimenti con le centrifughe però fallirono. Ulteriori miglioramenti nelle centrifughe ad alta velocità da parte di JW Beams e altri hanno portato a risultati positivi. La giuria di G. K. ha proposto centrifughe cilindriche alte con controflusso. Hanno trovato un'applicazione di successo.
9.19. In una centrifuga controcorrente, il flusso di vapore è diretto verso il basso nella parte esterna del cilindro rotante e verso l'alto nella regione centrale o assiale. Attraverso l'interfaccia tra i due flussi si ha una diffusione costante di entrambi i tipi di molecole da un flusso all'altro; il campo delle forze radiali della centrifuga agisce più forte sulle molecole pesanti che su quelle più leggere, per cui la concentrazione delle molecole pesanti aumenta alla periferia e diminuisce nella regione assiale; per le molecole più leggere il quadro sarà invertito.
9.20. Un vantaggio significativo di una centrifuga quando si separano isotopi pesanti come l'uranio è che il coefficiente di separazione dipende dalla differenza di massa di entrambi gli isotopi e non da radice quadrata dal rapporto di massa, come nei metodi di diffusione.
METODO DELLA DIFFUSIONE TERMICA9.21. Dalla teoria cinetica dei gas ne consegue che le velocità di diffusione dei gas con diversi pesi molecolari sono diverse. La possibilità di implementare praticamente la separazione isotopica mediante diffusione termica è stata dimostrata per la prima volta da ricerca teorica collisioni di molecole e forze di interazione tra loro. Le ricerche effettuate da Enskog e Chapman prima del 1920 hanno dimostrato che se in una miscela di gas c'è un gradiente di temperatura, un tipo di molecola tenderà a concentrarsi nella regione fredda e un'altra in quella calda. Questa tendenza dipende non solo dai pesi molecolari, ma anche dalle forze di interazione tra le molecole. Se un gas è una miscela di due isotopi, allora l'isotopo più pesante può accumularsi nella regione calda, o nella regione fredda, o non accumularsi affatto, a seconda della natura delle forze intramolecolari. La direzione della separazione può essere invertita da cambiamenti di temperatura o di concentrazione relativa.
9.22. Il fenomeno della diffusione termica fu utilizzato per la prima volta per separare gli isotopi da G. Clusius e G. Dickel in Germania nel 1938. Costruirono un tubo verticale lungo l'asse del quale veniva teso un filo riscaldato, creando una differenza di temperatura di circa 600 °C tra l'asse e la periferia. L'effetto è stato doppio. In primo luogo, gli isotopi pesanti nelle sostanze studiate da Clusius e Dickel si concentravano vicino alla parete esterna fredda, e in secondo luogo, il gas freddo alla periferia tendeva ad abbassarsi, mentre il gas caldo all'asse tendeva a salire. Questa convezione termica stabiliva un controflusso e la diffusione termica causava un flusso preferenziale di molecole pesanti verso la periferia attraverso l'interfaccia tra i due flussi.
9.23. La teoria della diffusione termica nei gas è piuttosto complessa; Non esiste alcuna teoria per il fenomeno della diffusione termica nei liquidi. Tuttavia, l'effetto di separazione è stato osservato ed è stato utilizzato con successo per separare l'esafluoruro di uranio leggero e pesante.
METODO DI SCAMBIO CHIMICO (ISOTOPICO).9.24. Nell'introduzione a questo capitolo, abbiamo notato che c'è motivo di credere che la separazione isotopica possa essere ottenuta mediante metodo convenzionale reazioni chimiche. Si è infatti riscontrato che la cosiddetta costante di equilibrio nelle reazioni semplici di scambio tra composti di due isotopi diversi non è esattamente la stessa per entrambi gli isotopi, e quindi la separazione è possibile in reazioni di questo tipo. Pertanto, durante lo scambio catalitico di atomi di idrogeno tra idrogeno gassoso e acqua, l'acqua contiene da tre a quattro volte più deuterio dell'idrogeno gassoso in equilibrio con essa. Per l'idrogeno e il vapore acqueo si osserva lo stesso effetto, ma l'equilibrio viene stabilito più velocemente. Questo metodo può essere adattato per produrre un processo continuo in controcorrente simile a quello utilizzato nella distillazione, e tali impianti vengono infatti utilizzati per la produzione di acqua pesante. Il metodo generale è ben compreso, ma è noto che l'efficienza della separazione generalmente diminuisce con l'aumentare del peso molecolare, quindi è improbabile che possa essere applicato con successo a isotopi pesanti come l'uranio.
METODO ELETTROLITICO9.25. Il metodo elettrolitico di separazione isotopica si basa sulla scoperta che l'acqua nei bagni elettrolitici utilizzati nella produzione industriale convenzionale di idrogeno e ossigeno ha una maggiore concentrazione di molecole di acqua pesante. Non esiste ancora una spiegazione completa per questo fenomeno. Prima della guerra, quasi tutta la produzione di idrogeno pesante veniva ottenuta con il metodo elettrolitico. Le quantità maggiori sono state prodotte in Norvegia, ma anche negli Stati Uniti è stato prodotto idrogeno pesante in quantità sufficienti per molti scopi sperimentali.
PANORAMICA GENERALE DEI METODI STATISTICI9.26. I sei metodi di separazione isotopica sopra descritti (diffusione, distillazione, centrifugazione, diffusione termica, scambio isotopico ed elettrolisi) sono stati testati con successo noto sull'uranio, sull'idrogeno o su entrambi. Ciascuno di questi metodi si basa su piccole differenze nel comportamento medio di molecole di diversi isotopi. Poiché le medie, per definizione, sono oggetto di statistica, tutti i metodi. che dipendono principalmente dal comportamento medio sono chiamati metodi statistici.
9.27. In termini di criteri stabiliti per giudicare i processi di separazione, tutti e sei i metodi statistici sono abbastanza simili. In ogni caso il fattore di separazione è piccolo, per cui sono necessari molti stadi di separazione successivi. Nella maggior parte dei casi, gli impianti di medie dimensioni possono riciclare relativamente gran numero sostanze. Il periodo di carico e di avvio (tempo per stabilire l'equilibrio) varia ampiamente, ma è generalmente elevato. La somiglianza dei sei metodi preclude la possibilità di selezione finale di un metodo senza prima aver studiato in dettaglio l'isotopo in questione, la produttività richiesta, ecc. I metodi di reazione di scambio ed elettrolitici probabilmente non sono adatti nel caso dell'uranio; allo stesso modo, nessuno schema di distillazione si giustificava. I restanti tre metodi sono stati sviluppati con vari gradi di successo per l’uranio, ma non sono utilizzati per l’idrogeno.
METODO ELETTROMAGNETICO E LIMITI DELLA SUA APPLICABILITÀ
9.28. L'esistenza di isotopi non radioattivi è stata dimostrata per la prima volta studiando le molecole di gas ionizzato che si muovono in campi elettrici e magnetici. Sono questi i campi che stanno alla base del cosiddetto metodo spettrografico di massa o elettromagnetico di separazione isotopica. Il metodo elettromagnetico è più adatto per determinare l'abbondanza relativa (abbondanza) degli isotopi. È comunemente usato per verificare i risultati delle separazioni degli isotopi dell'uranio

Riso. 5. Il campo magnetico è perpendicolare al piano del disegno.
utilizzando le modalità sopra descritte. Il valore del metodo elettromagnetico sta nel fatto che con il suo aiuto è facile eseguire una separazione quasi completa degli isotopi, molto rapidamente, con un carico ridotto e con un breve periodo di avvio. Per rispondere alla domanda sul perché vengono presi in considerazione altri metodi di separazione, è sufficiente ricordare che uno spettrografo di massa convenzionale può separare solo piccole quantità di una sostanza, solitamente dell'ordine di frazioni di microgrammo all'ora.
9.29. Per comprendere il motivo di queste prestazioni limitate, delineeremo il principio di funzionamento di un semplice spettrografo di massa utilizzato per la prima volta da A.J. Dempster nel 1918. Il dispositivo è mostrato schematicamente in Fig. 5. Il composto gassoso in via di separazione viene introdotto nello spazio, dove alcune sue molecole vengono ionizzate mediante una scarica elettrica. Alcuni ioni passano attraverso l'intervallo S 1 Tra S 1 e S 2 vengono accelerati da un campo elettrico, che conferisce a tutti quasi la stessa energia cinetica, migliaia di volte maggiore dell'energia termica media. Da ora tutti gli ioni hanno quasi la stessa cosa energie cinetiche, allora gli ioni più leggeri dovrebbero avere meno quantità di moto di quelli più pesanti. Entrando in un campo magnetico attraverso lo spazio S2, tutti gli ioni si muovono (perpendicolarmente a campo magnetico) in semicerchi con raggi proporzionali alla loro quantità di moto. Pertanto, gli ioni leggeri si muoveranno in un semicerchio più piccolo rispetto agli ioni pesanti e, se il collettore viene posizionato nella posizione appropriata, verranno raccolti solo gli ioni leggeri.
9.30. Tralasciando l'esame dettagliato del dispositivo, noteremo solo i principali motivi che limitano la quantità di sostanza separabile. Tali ragioni sono le seguenti: in primo luogo, è difficile ottenere grandi quantità di ioni gassosi; in secondo luogo, viene preso un fascio di ioni molto stretto (come mostrato in figura), in modo che venga utilizzata solo una parte degli ioni risultanti: in terzo luogo, densità ioniche troppo elevate nel fascio possono causare un effetto di carica spaziale, che interferisce con la separazione .
Tutti i dispositivi basati sul metodo elettromagnetico sviluppati prima del 1941 avevano coefficienti di separazione elevati, ma bassa produttività ed efficienza. Questo fu il motivo per cui, nell'estate del 1941, il Comitato per l'Uranio abbandonò l'uso di metodi elettromagnetici per separare l'U-235 su larga scala (vedi paragrafo 4.31). Successivamente, però, è stato dimostrato che questi limiti non sono insormontabili. Infatti, i primi campioni di U-235 puro di dimensioni apprezzabili furono ottenuti mediante separazione elettromagnetica, come descritto nel capitolo successivo.
ALTRI METODI DI SEPARAZIONE ISOTOPO
9.31. Oltre ai metodi di separazione isotopica sopra descritti, ne sono stati testati anche molti altri. Il metodo della mobilità ionica, come indica il nome, si basa sul fatto seguente.
In una soluzione elettrolitica, due ioni, chimicamente identici, ma con masse diverse, si muovono attraverso la soluzione a velocità diverse sotto l'influenza di campo elettrico. Tuttavia, la differenza nella mobilità è piccola e viene facilmente oscurata da fenomeni disturbanti. A. K. Brewer (Bureau of Standards) riferì di aver ottenuto la separazione degli isotopi di potassio con questo metodo. Brewer ha ottenuto risultati interessanti anche con il metodo dell'evaporazione. Il capitolo XI descrive due nuovi metodi elettromagnetici: il metodo isotropo e quello di centrifugazione ionica. Il metodo dell'isotrone ha prodotto un numero di campioni di discrete dimensioni di uranio parzialmente separato; La centrifuga ionica ha prodotto anche campioni che hanno rivelato la separazione dell'uranio, ma il suo funzionamento era instabile.
PROCESSI A CASCATA E COMBINATI
9.32. Insomma metodi statistici La separazione isotopica richiede molte fasi di separazione successive per produrre una sostanza contenente il 90% o più di U-235 o deuterio. Se il flusso si muove continuamente da uno stadio a quello successivo, allora una serie di stadi di separazione successivi viene chiamata cascata (una colonna di frazionamento di vassoi individuali è un esempio di un semplice impianto di separazione a cascata). La teoria della cascata è stata sviluppata da R. P. Feynman (Princeton) e altri per un certo tipo di separatore elettromagnetico, e da C. Cohen e I. Kaplan (Columbia University), M. Benedict e A. M. Squires (Kellex Corporation), ecc. per la diffusione processi. Qui noteremo solo due punti riguardanti le installazioni multistadio o “a cascata”.
9.33. Nelle installazioni in cascata è necessario utilizzare il ricircolo. In un impianto per la separazione dell'U-235, la sostanza che entra in qualsiasi stadio tranne il primo è già arricchita con U-235. Una parte di questa sostanza può arricchirsi nuovamente durante il passaggio attraverso questa fase. Il resto della sostanza sarà esaurito, ma non ancora del tutto svalutato. Deve essere riciclato a uno stadio inferiore. Anche il materiale impoverito del primo stadio (meno arricchito) deve essere riciclato, poiché parte dell'U-235 in esso contenuto può essere recuperato (rigenerato).
9.34. Considerando il funzionamento a regime dello stadio, vedremo che il flusso utile di uranio attraverso il primo stadio deve essere almeno 140 volte maggiore di quello attraverso l'ultimo stadio. Il flusso netto in ogni stadio è proporzionale alla concentrazione relativa di U-238 e quindi diminuisce con il numero di stadi attraversati. Poiché ogni dato campione di una sostanza viene sottoposto a riciclo ripetuto, la quantità di sostanza che passa attraverso ogni fase è significativamente maggiore del flusso utile attraverso quella fase, ma è proporzionale ad esso.
9.35. Ci soffermiamo su queste domande per evidenziare un aspetto del problema della separazione che non è sempre evidente, e cioè che il processo di separazione migliore per le prime fasi della separazione non è necessariamente il migliore per le fasi successive. I fattori che abbiamo notato sono diversi non solo per le diverse fasi, ma anche per i diversi processi di separazione. Ad esempio, il ricircolo è molto più semplice da realizzare in un impianto a diffusione che in uno elettromagnetico. Una configurazione che combina due o più processi può essere la soluzione migliore per ottenere la separazione finale richiesta. In una fase inferiore (e quindi più ampia), la dimensione delle apparecchiature e della potenza richieste possono determinare la scelta del processo. A un livello più alto (più piccolo), questi fattori lasciano il posto alla facilità d’uso e al tempo necessario per stabilire l’equilibrio, il che può rendere un altro metodo più redditizio.
PIANTE AD ACQUA PESANTE
INSTALLAZIONE PILOTA CON IL METODO DELLA CENTRIFUGAZIONE
9.36. I prossimi due capitoli descrivono tre metodi utilizzati per la separazione industriale degli isotopi dell'uranio. Sono della massima importanza per il Progetto in questo momento. All'inizio del lavoro, sembrava che la centrifugazione potesse rivelarsi possibile metodo migliore separazione degli isotopi dell'uranio. e che l'acqua pesante sarebbe necessaria come moderatore. Descriveremo brevemente l'impianto pilota di centrifugazione e l'impianto di produzione dell'acqua pesante.
IMPIANTI DI PRODUZIONE ACQUA PESANTE9.37. Per concentrare il deuterio sono stati utilizzati due metodi: la distillazione frazionata dell'acqua e il metodo dello scambio isotopico idrogeno-acqua.
9.38. Il primo utilizza metodi ben sviluppati di distillazione frazionata, ma il tempo di distillazione richiesto è molto lungo, poiché la differenza nei punti di ebollizione dell'acqua leggera e pesante è insignificante. Per lo stesso motivo la quantità di vapore necessaria è molto elevata. Il metodo è molto costoso, ma le fabbriche potrebbero essere costruite con un minimo di lavoro di ricerca. Gli impianti iniziarono la costruzione da parte della DuPont nel gennaio 1943 e entrarono in funzione nel gennaio 1944.
9.39. Il secondo metodo per produrre acqua pesante si basa sullo scambio catalitico di deuterio tra idrogeno gassoso e acqua. Quando tale scambio viene stabilito con l'aiuto di catalizzatori, la concentrazione di deuterio nell'acqua, come indicato, è circa tre volte maggiore che nel gas.
9.40. Quando si effettua il processo di scambio isotopico, l'acqua viene fornita alla colonna, in controcorrente rispetto all'idrogeno e al vapore, in modo piuttosto complesso. Sul fondo della colonna dell'elettrolizzatore, l'acqua viene scomposta in idrogeno e ossigeno, quindi l'idrogeno mescolato con vapore viene reimmesso sul fondo della colonna. La miscela di vapore e idrogeno passa attraverso il letto catalitico e bolle attraverso l'acqua che scorre verso il basso. L'essenza del processo è che parte del deuterio, originariamente presente nell'idrogeno, viene concentrata nel vapore e quindi trasferita nell'acqua che scorre verso il basso. L'impianto è costituito da una cascata di colonne con la colonna più grande in ingresso e le colonne più piccole in uscita. La costruzione di questa cascata si basa sugli stessi principi di cui abbiamo discusso sopra panoramica generale metodi di separazione. Il processo richiede catalizzatori molto attivi per le reazioni di scambio. Il catalizzatore più efficace fu trovato da X.S. Taylor all'Università di Princeton. Allo stesso tempo, A. von Grosse scoprì un catalizzatore meno attivo. Per migliorare questi catalizzatori, R. G. Christ (Columbia University) ha effettuato le necessarie determinazioni delle costanti fisiche e G. R. Arnold (DuPont) ha svolto un lavoro per migliorare uno dei catalizzatori.
9.41. Il processo descritto era economico. A causa della necessità di utilizzare idrogeno elettrolitico, l'impianto era situato sul territorio dello stabilimento Consolidated Mining and Smelting Co.. a Trail (Columbia britannica, Canada). La costruzione dell'impianto fu guidata da E. R. Murphree e F. T. Bahr della Standard Oil Development Co.
IMPIANTO PILOTA PER METODO CENTRIFUGAZIONE9.42. Agli albori del Progetto, i metodi più adatti per separare l'uranio furono a lungo considerati il metodo della diffusione gassosa e il metodo della centrifugazione. L’implementazione di entrambi i metodi su larga scala ha presentato sfide significative. Dopo la riorganizzazione nel dicembre 1941, la ricerca e lo sviluppo del metodo di centrifugazione continuarono presso l'Università della Virginia e il laboratorio della Standard Oil Development Co.. a Bayway. Per raggiungere velocità elevate nelle centrifughe di grandi dimensioni, un lavoro significativo è stato svolto da Westinghouse Electric and Manufacturing Co. a Pittsburgh est.
9.43. A causa delle grandi difficoltà tecniche sorte a questo riguardo, invece di un'installazione su scala industriale, è stato autorizzato e costruito un impianto pilota a Bayway. Ha funzionato con successo e ha raggiunto una separazione prossima a quella prevista dalla teoria. Successivamente l'impianto è stato chiuso e il lavoro sul metodo di centrifugazione è stato interrotto. Pertanto, il metodo di centrifugazione non viene discusso ulteriormente in questo rapporto.
SEPARAZIONE DEGLI ISOTOPI E PRODUZIONE DI PLUTONIO
9.44. I metodi più importanti descritti per la separazione degli isotopi erano conosciuti in linea di principio e messi in pratica prima che il compito di separare gli isotopi dell'uranio diventasse di fondamentale importanza. Questi metodi non sono stati utilizzati né per l'uranio (eccetto che per l'isolamento di pochi microgrammi) né per altre sostanze in misura paragonabile alle necessità attuali. Le questioni principali erano costi, rendimento e tempo, non i principi di separazione. In altre parole, il problema era principalmente tecnico, non scientifico; la produzione di plutonio raggiunse su larga scala solo dopo che la prima caldaia iniziò a funzionare e furono ottenuti i primi microgrammi di plutonio. Ma anche dopo questo, molti degli esperimenti condotti sul plutonio furono di notevole interesse dal punto di vista delle applicazioni militari sia dell'U-235 che del plutonio, e per il futuro sviluppo delle questioni relative all'energia atomica. Di conseguenza, le questioni relative alla produzione di plutonio hanno continuato a rivestire un interesse più generale rispetto alle questioni relative alla separazione degli isotopi. Molti problemi speciali eccezionalmente interessanti sono sorti nella risoluzione del problema della separazione e richiedevano personale altamente qualificato forze scientifiche per risolverli, ma devono comunque essere tenuti segreti. Per questi motivi, questo rapporto non tecnico pone l'accento principalmente sulla questione del plutonio e dedica meno spazio alle questioni relative alla separazione. Con questo non intendiamo dire che il problema della separazione sia più facile da risolvere o che la sua soluzione abbia meno importanza.
9.45. Ad eccezione del metodo di separazione elettromagnetico, la separazione isotopica si basa su piccole differenze nel comportamento medio delle molecole. Sono utilizzati in sei metodi di separazione "statistici": (1) diffusione del gas, (2) distillazione, (3) centrifugazione, (4) diffusione termica, (5) reazioni di scambio, (6) elettrolisi. Probabilmente solo i metodi (1), (3) e (4) sono adatti per l'uranio, mentre (2), (5) e (6) sono più adatti per la separazione del deuterio dall'idrogeno. In tutti i metodi "statistici", il coefficiente di separazione non è elevato, quindi richiedono molti passaggi, ma ciascun metodo consente di elaborare una grande quantità di sostanza. Tutti questi metodi erano stati sperimentati con successo prima del 1940, ma nessuno di essi fu utilizzato su scala industriale e nessuno di essi fu utilizzato per l'uranio. La produttività del metodo elettromagnetico è ancora inferiore, ma il coefficiente di separazione è maggiore.
C'erano evidenti limitazioni all'applicazione industriale del metodo elettromagnetico. A causa delle differenze nelle caratteristiche del processo tra le diverse fasi di separazione, c'era la possibilità di trarre vantaggi dalla combinazione di due o più metodi. Il problema di sviluppare uno o tutti questi metodi non è un problema scientifico di principio, ma un problema tecnico di scala e di costo. Queste questioni possono quindi essere trattate più brevemente di quelle del plutonio, anche se non sono meno importanti. Una centrifuga sperimentale è stata costruita e utilizzata con successo. Non è stato costruito alcun impianto industriale. Sono stati inoltre realizzati impianti per la produzione di acqua pesante utilizzando due metodi diversi.
L'invenzione riguarda l'energia nucleare e può essere utilizzata per regolare la composizione isotopica del combustibile nucleare. Una soluzione contenente: -115,5 g/l, -2,0 mol/l, -0,5 g/l viene versata in una colonna cromatografica con polvere di Teflon sulla cui superficie è applicato un solvente. Si forma una banda di uranio (IV). Il processo di estrazione in controcorrente prevede un fattore di separazione diverso da 1. Il riflusso dell'uranio viene effettuato senza modificare lo stato di valenza mediante il metodo di estrazione esaustiva e riestrazione alle estremità della striscia. Il grado di separazione degli isotopi U 238 e U 232 aumenta e il numero di reagenti diminuisce. Il sistema metabolico è chimicamente stabile. 4 tavole, 2 illustrate.
L'invenzione riguarda processi per la separazione degli isotopi dell'uranio metodi chimici e può essere utilizzato nella produzione radiochimica per regolare la composizione isotopica del combustibile nucleare. Conosciuto vari modi separazione degli isotopi di uranio mediante metodi chimici. Di questi, i più efficaci sono i metodi basati sulla reazione di scambio isotopico tra due forme di valenza dell'uranio situate in fasi diverse: acquosa e organica. Ad esempio, un noto metodo per la separazione degli isotopi dell'uranio della società giapponese Asahi Chemical Industry (brevetto US N 4118457, classe B 01 D 59/30, 03.10.78), che si basa sulla reazione di scambio isotopico tra tetra- ed esavalente uranio, che si trovano rispettivamente nelle fasi di soluzione e resina a scambio anionico. Una banda di uranio (IV) viene fatta passare attraverso una resina a scambio anionico sotto forma di un metallo ossidante, come il ferro (III), eluendo con una soluzione di acido cloridrico di un metallo riducente, come il titanio (III). Un diagramma del processo cromatografico redox a scambio ionico per la separazione degli isotopi di uranio dall'industria chimica Asahi (processo Asahi) è mostrato in Fig. 1. Interagendo con l'agente riducente, l'uranio esavalente viene ridotto allo stato tetravalente, desorbito dalla resina a scambio anionico e trasferito con l'eluato nella zona dell'agente ossidante , dove viene ossidato e adsorbito sulla resina. Pertanto, la banda di adsorbimento dell'uranio si sposta, durante la quale l'uranio (IV) si arricchisce con l'isotopo dell'uranio-238 secondo la reazione di scambio isotopico (. cioè) (1):
Con un unico fattore di separazione = 1.0013 e viene trasferito con esso sulla parte anteriore della striscia. In questo caso l'uranio in prossimità della parte anteriore posteriore della striscia di uranio viene arricchito corrispondentemente dell'isotopo uranio-235. Pertanto, in uno degli esperimenti, riportati come esempio nella descrizione del brevetto per il metodo descritto, è stata utilizzata una resina a scambio anionico, preparata mediante clorometilazione del copolimero stirene-divinilbenzene seguita dalla sua amminazione con trimetilammina. La resina aveva un grado di reticolazione del 6% e una dimensione delle particelle da 74 μm a 149 μm. Con questa resina sono state riempite due colonne (ciascuna lunga 1 m con un diametro interno di 1 cm). Facendo passare una soluzione contenente 0,05 mol/L di solfato ferrico e 0,6 mol/L di acido solforico attraverso due colonne collegate in serie, la resina è stata convertita nella forma Fe(III). Quindi, alimentando una soluzione della composizione: cloruro di uranile - 0,04 mol/l, acido solforico - 0,2 mol/l, sulla resina nella prima colonna è stata effettuata l'eluizione una soluzione contenente tricloruro di titanio 0,05 mol/l e acido solforico 0,2 mol/l. Allo stesso tempo, la fascia dell'uranio, situata tra la zona rossa degli ioni ferro (III) e la zona viola del titanio (III), si muoveva ad una velocità di 20 cm/giorno. Pertanto, la banda di uranio è stata fatta passare attraverso due colonne. L'analisi spettrometrica di massa del primo e dell'ultimo campione di uranio prelevato dall'eluato ha fornito i seguenti valori del rapporto U 235 /U 238, %: 0,00693 e 0,00759, che corrisponde a 0,9559 e 1,0469 parti del rapporto isotopico di 0,00725 nell'uranio naturale . Nella versione industriale della separazione degli isotopi di uranio utilizzando il metodo sopra descritto per ottenere un prodotto - uranio arricchito al 3% con l'isotopo uranio-235 e code - uranio contenente lo 0,1% di uranio-235, si presume che una striscia di uranio di diversi metri lungo viene fatto passare attraverso uno strato di resina ad una distanza da 10 a 1000 m. Questo movimento della striscia viene effettuato utilizzando almeno due colonne, una delle quali è occupata dalla striscia di uranio e la seconda è in questo momento in fase di rigenerazione. Il più vicino a quello proposto nell'essenza tecnica e nel risultato ottenuto è un metodo per arricchire l'uranio con uno dei suoi isotopi in una cascata a più stadi mediante contatto controcorrente di un estraente contenente composti di uranio tetravalente e soluzione acquosa, contenente composti di uranio trivalente (brevetto URSS n. 867283, classe B 01 D 59/28, 23/09/81). Il metodo si basa sul r.i.o. ad altissima velocità:

Per cui la costante di equilibrio r.i.o., determinata con il metodo della compressione graduale, è pari a 1.0012 - 1.0030. Per separare le forme di valenza dell'uranio è stato proposto di utilizzare diversi sistemi di estrazione, selezionando condizioni con transizione minima dell'uranio (III) e dell'uranio (IV) da una fase all'altra. Lo svantaggio di questi sistemi è l'estrema instabilità dell'uranio (III) nelle soluzioni acquose e la sua tendenza ad ossidarsi. Lavorare con tali composti è possibile in un'atmosfera di azoto in assenza di ioni metallici dei gruppi III-VIII. La messa in contatto viene effettuata escludendo qualsiasi contatto di fase con qualsiasi materiale solido elettricamente conduttivo e con reagenti che rilasciano ossigeno. L'organizzazione del processo di separazione degli isotopi di uranio mediante il metodo di estrazione si basa sullo stesso metodo della “striscia mobile” con movimento controcorrente delle fasi contenenti ioni di uranio opposti e con riflesso redox nelle sue parti anteriori. Quasi tutte le classi di estraenti possono essere utilizzate come fase organica, compresi composti organofosforici neutri, acidi, basi, alcoli, ammine, chetoni, eteri, chelati, nonché resine a scambio cationico e anionico. Nella banda dell'uranio, la sua forma tetravalente è preferibilmente nella fase organica, e la forma trivalente è nella fase acquosa, cioè qui si realizza il caso quando il coefficiente di separazione delle forme di valenza dell'uranio non è uguale all'unità. Il processo viene effettuato in una soluzione di acido cloridrico in presenza di metalli del gruppo III-IV con una concentrazione di 1 ppm con l'implementazione del riflesso redox dell'uranio (effettuando un processo redox con il trasferimento dell'uranio in una valenza opposta forma e un'altra fase) alle estremità della sua fascia, cioè con esaustivo (completo) mediante la sua riestrazione dalla fase organica alla fase acquosa nella parte di testa della fascia di uranio e la riduzione dell'uranio tetravalente allo stato trivalente con il suo ritorno allo stadio di selezione dell'uranio tetravalente e con l'ossidazione dell'uranio trivalente allo stato tetravalente, l'estrazione esaustiva dell'uranio tetravalente e il suo ritorno con l'estraente alle strisce di uranio della parte posteriore (nella fase di selezione dell'uranio trivalente). Tale cascata di estrazione viene alimentata fornendo la parte centrale della cascata con una soluzione acquosa iniziale di uranio. A causa della ridistribuzione non uniforme degli isotopi dell'uranio nella sua banda tra le sue due forme di valenza, che si trovano in diverse fasi immiscibili, gli isotopi dell'uranio leggero con uranio tetravalente e gli isotopi dell'uranio pesante con uranio trivalente vengono trasferiti alle estremità opposte della banda dell'uranio. Inoltre, maggiore è il numero di stadi di contatto implementati nella banda dell'uranio, maggiore è il grado finale di separazione isotopica. Il processo di separazione degli isotopi dell'uranio con scambio isotopico tra uranio (III) e uranio (IV) è presentato schematicamente in Fig. 2. Uno degli esempi di implementazione di questo metodo fornisce i seguenti dati. La separazione degli isotopi naturali dell'uranio è stata effettuata in una cascata di estrazione composta da 70 fasi. Composizione della fase:
La fase acquosa all’ingresso della cascata aveva la seguente composizione:
0,1 milioni;
La fase organica all'ingresso della cascata è pari al 50% di TBP nel dodecano. La riduzione dell'uranio tetravalente è stata effettuata elettrochimicamente e l'elettrolisi del diaframma con un catodo di mercurio e l'ossidazione dell'uranio trivalente è stata effettuata con cloro. Dall'uranio naturale contenente lo 0,7194% di uranio-235 si è ottenuto un prodotto arricchito contenente lo 0,80% di uranio-235 e un prodotto impoverito (rifiuti) contenente lo 0,7047% di uranio-235. Gli svantaggi di questo metodo sono:
La necessità di effettuare il riflesso redox delle forme di valenza dell'uranio alle estremità della sua banda (cioè convertire l'uranio nella forma di valenza opposta e un'altra fase con il suo ritorno nella parte anteriore della banda dell'uranio, dove l'uranio è stato selezionato );
Stabilità chimica estremamente bassa delle soluzioni di uranio trivalente e, di conseguenza, la necessità di utilizzare un mezzo di acido cloridrico con un contenuto minimo di impurità metalliche del gruppo III-IV. In questo caso, il singolo coefficiente di separazione degli isotopi di uranio non supera 1,0030. Lo scopo dell'invenzione è aumentare il grado di separazione degli isotopi, ridurre il numero di reagenti utilizzati e aumentare la stabilità chimica del sistema di scambio. Il problema è risolto dal fatto che nel metodo di separazione degli isotopi dell'uranio, compreso lo scambio isotopico tra le sue due forme di valenza, una delle quali è l'uranio tetravalente, che si muove in una striscia formata nel processo di estrazione in controcorrente, fornendo un coefficiente di separazione di valenza forme di uranio non uguali all'unità, con riflesso di valenza forme di uranio mediante metodi di estrazione esaustiva e riestrazione alle estremità della sua banda, l'uranio esavalente viene utilizzato come seconda forma di valenza, lo scambio isotopico viene effettuato in soluzioni acido nitrico, e il riflesso dell'uranio viene effettuato senza modificare il suo stato di valenza. Poiché il coefficiente di separazione delle forme di valenza non è uguale all'unità, viene creata una striscia di uranio con zone di due forme di valenza opposte di uranio distanziate alle sue estremità: uranio tetra ed esavalente, e la reazione di scambio isotopico avviene a il punto in cui le zone distanziate delle forme di valenza dell'uranio si sovrappongono, dove la direzione del trasferimento interfase delle forme di valenza è opposta. Secondo i concetti tradizionali, in un tale sistema il grado massimo di separazione isotopica non può superare un valore pari al valore del singolo coefficiente di separazione isotopica, ad esempio per la coppia uranio (VI)/uranio (IV) 235/238 = 1.0013, poiché l'operazione di separazione stessa delle forme di valenza dell'uranio nella banda dell'uranio, portate in equilibrio isotopico nella soluzione di alimentazione, non dovrebbe portare ad un aumento dell'effetto isotopico. Tuttavia, in modo del tutto inaspettato, è stato ottenuto un effetto isotopico, la cui grandezza era due ordini di grandezza maggiore del valore calcolato, pari a un singolo fattore di separazione, e la direzione dell'effetto isotopico si è rivelata opposta all'analogo, cioè, in questo caso, l'uranio tetravalente è stato arricchito con un isotopo leggero. Questa è probabilmente una conseguenza della ridistribuzione degli isotopi dell'uranio tra le sue forme di valenza nel processo di trasferimento in controfase delle forme di valenza dell'uranio, che avviene nel punto in cui le bande delle forme di valenza opposte dell'uranio si sovrappongono. Nel prototipo e nei metodi analoghi questo processo è praticamente assente, poiché implementano il riflesso redox alle estremità della striscia di uranio, mentre nel metodo proposto il riflesso dell'uranio viene effettuato senza modificarne la valenza. Esempi di implementazione del metodo
Tre esempi di implementazione del metodo forniscono dati sulla separazione di una miscela di isotopi di uranio-232 e uranio-238 presenti nell'uranio ad alto fondo. Il contenuto di uranio-232 è stato determinato secondo OST 95.999-92, che comprende l'isolamento chimico dell'uranio e la successiva determinazione spettrometrica alfa del contenuto di uranio-232 come percentuale di uranio-238. Gli esperimenti in cui è stato organizzato il movimento di una banda di forme esavalenti e tetravalenti di uranio sono stati condotti in due versioni: estrazione cromatografica e in controcorrente. Esempio 1. L'esperimento ha utilizzato una colonna cromatografica dotata di polvere di Teflon con una frazione di 0,25 - 0,5 mm, sulla cui superficie è stato precedentemente applicato l'estraente 65% TBP in RED-2 in una quantità pari al 5% in peso della polvere . Caratteristiche dell'altoparlante:
Altezza - 1 m;
Diametro: 0,1 m;
Peso della polvere di teflon (0,25 - 0,5 mm) - 72,14 g;
Peso estraente - 3.607 g;
Il volume dello spazio intergranulare è 35 cm3. La colonna è stata precedentemente equilibrata con una soluzione contenente 2 mol/L di acido nitrico e 0,5 g/L di idrazina. Per formare una banda di uranio (IV) nella colonna, sono stati introdotti in essa 2 ml di una soluzione della seguente composizione:
115,5 g/l;
2,0 mol/l;
0,5 g/l. Successivamente la colonna è stata lavata con 60 ml di una soluzione di U(VI) della seguente composizione:
31,0 g/l;
2,0 mol/l;
0,5 g/l. Al termine dell'esperimento, la colonna è stata lavata con una soluzione contenente acido nitrico con una concentrazione di 0,3 mol/L per riestrarre l'uranio (VI). Pertanto, nell'esperimento, il movimento controcorrente delle fasi acquose e organiche è stato realizzato con la formazione di una striscia di due forme di valenza di uranio e con un'estrazione e riestrazione esaustiva alle estremità della striscia di uranio. L'uranio esavalente che entra nella colonna ha spostato l'uranio tetravalente. Il movimento della striscia di uranio tetravalente lungo la colonna, i suoi bordi iniziale e finale potevano essere osservati visivamente. La durata dell'esperimento è di 4 ore. Quando il bordo d'uscita dell'uranio tetravalente (il bordo d'attacco dell'uranio esavalente) emergeva dalla colonna, venivano prelevati campioni per l'analisi del contenuto di uranio di composizione tetravalente, esavalente e isotopica. La composizione isotopica dell'uranio iniziale e i risultati sperimentali sono riportati rispettivamente nella Tabella 1. 1 e 2. Dai dati in tabella. 2 ne consegue che l'uranio si arricchisce in isotopi leggeri dal fronte di uscita della fascia dell'uranio tetravalente nel punto in cui si sovrappone al fronte dell'uranio esavalente. Esempio n. 2. L'esperimento ha utilizzato la stessa colonna cromatografica del primo esperimento. La colonna è stata precedentemente equilibrata con una soluzione contenente 2 mol/L di acido nitrico e 0,5 g/L di idrazina. Per formare una banda di uranio (IV) nella colonna, è stato introdotto in essa 1 ml di una soluzione della seguente composizione:
163,3 g/l;
29,7 g/l;
2,13 mol/giorno;
26 g/l,
E poi l'uranio tetravalente è stato eluito con una soluzione di uranio esavalente con la composizione:
100,0 g/l;
2,0 mol/l;
0,5 g/l. Durante il processo di eluizione, l'uranio tetravalente veniva spostato verso il bordo anteriore della banda dell'uranio. L'uranio esavalente che entrava nella colonna spostò l'uranio tetravalente sul fronte principale. Il movimento di una banda di uranio tetravalente lungo la colonna poteva essere osservato visivamente. La durata dell'esperimento è di 4 ore. Quando il bordo d'uscita dell'uranio tetravalente (il bordo d'attacco dell'uranio esavalente) emergeva dalla colonna, venivano prelevati campioni per l'analisi del contenuto di uranio di composizione tetravalente, esavalente e isotopica. I risultati sono mostrati nella tabella. 3. Dai dati in tabella. 3 ne consegue che l'uranio si arricchisce in isotopi leggeri, a partire dal bordo d'uscita della fascia dell'uranio tetravalente nel punto in cui si sovrappone al fronte dell'uranio esavalente e terminando con il bordo d'entrata della fascia dell'uranio tetravalente. Esempio n. 3. Questo esempio descrive l'effetto isotopico che è stato registrato durante il processo di estrazione di soluzioni di uranio ad alto fondo allo stato esavalente. La tecnologia per la lavorazione dell'uranio ad alto fondo prevede l'introduzione di uranio tetravalente nelle soluzioni iniziali e di lavaggio, che viene utilizzato per ridurre il plutonio allo stato trivalente. Nella colonna di estrazione, durante la lavorazione della soluzione iniziale di uranio ad alto fondo contenente acido nitrico 30 - 60 g/l, con rapporto di fase O:B = 2,5:1 e saturazione dell'estraente con uranio esavalente 100 - 105 g /l, l'uranio tetravalente forma un picco di concentrazione davanti all'uranio esavalente. Nella zona di sovrapposizione dei fronti dell'uranio tetravalente ed esavalente, viene riprodotta la situazione con il movimento controcorrente delle forme di valenza dell'uranio attraverso il confine di fase, quando l'uranio tetravalente viene spostato dalla fase organica dall'uranio esavalente e viene riestratto in la fase acquosa, arricchita in isotopi leggeri, e l'uranio esavalente, invece, viene estratta nella fase organica, arricchita in isotopi pesanti. Parzialmente, dentro piccole quantità (< 1 г/л), уран уходил с рафинатом. Так как пик четырехвалентного урана находился ближе к выходу рафината из колонны, чем фронт шестивалентного урана, то в рафинате относительное содержание в уране его четырехвалентной формы оказывалось значительно выше, чем в реэкстракте урана, что повлекло изменение изотопного состава урана в рафинате и в реэкстракте. Результаты анализа исходного урана, урана, ушедшего с рафинатом, и урана в упаренном реэкстракте показали (см. табл. 4), что наблюдается концентрирование урана-232 в уране, теряемом с рафинатом, и обеднение по этому изотопу урана реэкстракта.
FORMULA DELL'INVENZIONE
Un metodo per la separazione chimica degli isotopi dell'uranio, compreso lo scambio isotopico tra due delle sue forme di valenza, una delle quali è l'uranio tetravalente, che si muove in una banda formata nel processo di estrazione in controcorrente, fornendo un coefficiente di separazione delle forme di valenza dell'uranio non uguale all'unità, con riflesso delle forme di valenza dell'uranio mediante metodi esaustivi di estrazione e riestrazione alle estremità della sua striscia, caratterizzato dal fatto che l'uranio esavalente è utilizzato come seconda forma di valenza, lo scambio isotopico viene effettuato in soluzioni di acido nitrico e il riflesso dell'uranio viene effettuata senza modificare il suo stato di valenza.- VKontakte 0
- Google+ 0
- OK 0
- Facebook 0