Blodplättar- bildade element av blod, vars mängd är 150-400 109 / l. Dessa är kärnvapenfria, pigmentfria runda strukturer som ser ut som skivor med en diameter på cirka 3,6 mikron. De bildas i benmärgen från stora megakaryocytceller genom fragmentering av cytoplasman; deras antal i blodet är konstant. Men med intensiv användning kan bildningen av nya blodplättar öka 8 gånger. Stimulering av trombocytopoes orsakar trombopoietin, som produceras i levern och delvis i njurarna. Aktivering av trombocytopoies kan också utföras av andra hematopoetiska faktorer, i synnerhet interleukiner (1/1-3, IL-6, IL-11), men denna process är inte specifik jämfört med trombopoietin.
Trombocyternas struktur och funktion
Täta granuler (β) innehåller icke-proteinämnen: ADP och serotonin; faktorer som främjar trombocytaggregation, såväl som antitrombocyt-ATP och Ca2. Lysosomala granulat innehåller hydrolytiska enzymer och peroxisomer innehåller katalas. Det yttre skalet av blodplättar och VCS är belagt med glykoproteiner som främjar trombocytvidhäftning och aggregation.
Trombocytmembranet innehåller receptorer för fysiologiska trombocytaktivatorer (ATP, adrenalin, serotonin, tromboxan Aj).
Trombocyternas funktioner:
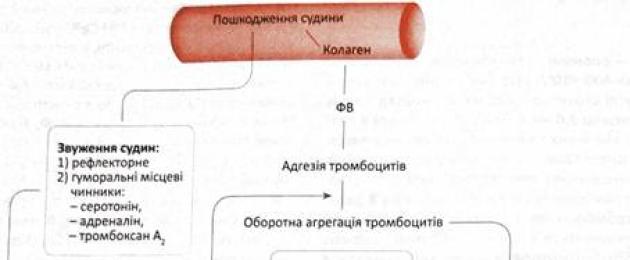
■ blodplättar utlöser snabbt det hemostatiska systemet. På grund av vidhäftning (klibbning) och aggregering (klumpning) av blodplättar bildas en vit tromb i kärlen i mikrovaskulaturen
■ ämnen som drar ihop blodkärlen frigörs lokalt i det skadade området;
■ aktivera uppkomsten av koagulationshemostas med bildandet av en fibrintrombus,
■ reglera lokala inflammatoriska reaktioner.
I vilotillstånd har blodplättar ett cytoplasmatiskt membran som är invaginerat på sina ställen och ansluter till ett nätverk av kanaler som kallas det öppna kanalikulära systemet (OCS) i blodplättarna. Det andra systemet i det inre membranet (tätt rörformigt system) bildas från det endoplasmatiska retikulumet hos megakaryocyter och är inte anslutet till det extracellulära utrymmet. I cytoplasman hos icke-aktiverade blodplättar finns granuler, inklusive α-granulat, täta β-granuler, lysosomgranulat och peroxisomer (Fig. 9.20).
Mest av allt innehåller blodplätten a-granuler som innehåller olika peptider som är involverade i mekanismerna för koagulation, inflammation, immunitet, reparation och modulering av dessa processer.
RIS. 9.20.
Blodplättsaktivering sker endast när det vaskulära endotelet är skadat och det finns kontakt med subendotelmatrisen, där kollagen, andra proteiner och von Willebrand-faktor (producerad av endotelet) finns. Trombocytmembranreceptorer binder till von Willebrand-faktor (VWF), kollagen och andra proteiner, vilket leder till trombocytaktivering, deras vidhäftning, formförändringar och irreversibel utsöndring av täta granuler och α-granuler. Förändringen i blodplättsformen orsakas av det intracellulära systemet av kontraktila mikrofilament, vilket leder till en ökning av ytan av deras membran och frisättning av ämnen som är involverade i koagulationshemostas genom dess öppna tubuli.
Fibrinogen fäster på membranets yta på grund av en förändring i tillståndet hos dess glykoproteiner och främjar blodplättsaggregation. I blodplättar syntetiseras tromboxan A2 från arakidonsyra, frisatt av membranet i det täta rörformiga systemet, och trombocytaktiverande faktor (TAF) syntetiseras, vilket förbättrar trombocytaggregationen och aktiverar neutrofiler. Trombinbildning förbättrar också trombocytaggregationen.
Det är känt att blodplättar syntetiserar blodkoagulationsfaktorerna V, VIII, XIII, von Willebrand-faktor och fibrinogen avsatt i a-granuler, som frisätts genom exocytos.
Blodplättsmembranlipoproteiner katalyserar flera faktorer vid bildandet av protrombinas. Aktiverade blodplättar binder trombin och trombomodulin (en komponent i α-granuler), vilket främjar aktiveringen av det antikoagulerande proteinet C.
Blodplättar frigör tillväxtfaktorer från α-granulat till det skadade området, främjar fibroblastproliferation och reparation av skadad vävnad. De har en koppling till det humorala immunförsvaret och binder IgG, vilken endocytos kommer in i cellen, lagras i a-granulat och utsöndras sedan genom exocytos.

RIS. 9.21. Sekvens av stadier av vaskulär-trombocythomeostas. VWF - von Willebrand faktor, PF-6 - trombostenin
Mänskliga blodplättar är kärnfria, högt differentierade och högt specialiserade celler med en unik struktur och funktioner.
Manifestationen av funktionell aktivitet av blodplättar åtföljs av en kardinal förändring i deras inre struktur När man studerar blodplättarnas morfologi är det därför vanligt att särskilja celler i "vilostadiet" (initiala icke-aktiverade blodplättar) och celler som befinner sig i olika aktiveringsstadier.
Trombocyter i vilostadiet beskrivs som små skivformade celler med en diameter på 2-5 mikron. Den diskoida formen av blodplättar kan tydligt observeras i ofixerade preparat med hjälp av ljusmikroskopi. På fixerade preparat färgade enligt Romanovsky har blodplättar utseendet av polygonala, mindre ofta ovala, plattor, där den perifera delen avslöjas – hyalomer, och den centrala delen – granulometer innehållande granulat.
Normalt är hyalomeren basofil till färgen, medan granulomeren är oxifil. På den ultrastrukturella nivån innehåller hyalomeren cytoskelettelement - mikrotubuli och aktin-myosinkomplex, som bestämmer formen på blodplättar i vila och under aktivering. Granulomeren innehåller mycket små mitokondrier med 1-2 cristae, glykogenansamlingar, 2 typer av membransystem (öppet tubulärt system och tätt tubulärt system), ett antal lysosomer och peroxisomer samt sekretoriska vesiklar eller granulat. Delar av det vakuolära systemet som är involverade i syntesen och mognaden av proteiner (granulärt endoplasmatiskt retikulum och Golgi-apparat) finns inte i blodplättar eller finns i form av små restformer som detekteras endast i vissa patologier. Man tror att alla sekretoriska blodplättsproteiner syntetiseras i megakaryocytstadiet.
Det öppna rörformiga systemet (OCS) är ett nätverk som består av enmembrantubuli och tunnlar som penetrerar en betydande del av trombocytvolymen och har kontakt med plasmamembranet. Membranen hos CSC inkluderar många receptorproteiner och adhesionsmolekyler; vid aktivering av en blodplätt observeras diffusion av dessa proteiner från CSCs mot plasmamembranet, och olika membrankomponenter - in i omvänd riktning, Den där. OSC utför omfördelningen av membrankomponenter inuti blodplättar. Dessutom är CSC involverad i exocytosen av sekretoriska vesiklar och, uppenbarligen, i endocytosen av vissa blodplasmaproteiner (fibronektin, albuminer, immunglobuliner).
Till skillnad från CSCs har det täta tubulisystemet (DTS) ingen koppling till plasmamembranet hos blodplättar och är ett derivat av det släta endoplasmatiska retikulumet. Huvudfunktionen hos PSC är lagring av intracellulärt kalcium, som också spelar en viktig roll i processerna för trombocytaktivering. Blodplättar innehåller ett stort antal sekretoriska vesiklar (vesiklar), med en diameter av 200 till 600 nm; På histologiska preparat ser dessa vesiklar ut som granuler; därför används termen "trombocytgranuler" eller "trombocytgranuler" oftast i litteraturen.
Det finns 3 typer av granulat i blodplättar:
1. Alfa granulat– innehåller trombocytfaktor IV, beta-tromboglobulin, trombospondin, fibronektin, fibrinogen, von Willebrand-faktor, olika tillväxtfaktorer (VEGF, PDGF, EGF, etc.), samt lysosomala enzymer. Diameter på alfagranulat – 300-500 nm;16
2. Beta granulat(ett annat namn är täta granuler) - innehåller ADP (icke-metabolisk pool), BNP, serotonin och kalciumjoner. Beta-granulat är något mindre än alfa-granulat, deras diameter är 250-350 nm;
3.Gammagranulat(lysosomer) - innehåller surt fosfatas, p-glukuronidas, katepsin och andra lysosomala enzymer. De minsta granulerna, deras diameter är 200-250 nm.
Figur 1. Schema över en blodplätts struktur (Bykov V.L. Private human histology. St. Petersburg: Sotis, 1999. 301 s.) Massspektrometrisk analys har visat att blodplättar innehåller mer än 700 typer av proteiner, varav cirka 200 har varit identifierats hittills. Mest av blodplättsproteiner lagras i alfagranuler, täta kroppar och lysosomer. De kommer in där både under megakaryocytopoiesis och genom inkludering från plasma. Under trombocytaktivering kastas innehållet i granulerna ut, varefter aktiveringsprocessen blir irreversibel. Man tror att trombocytdegranulering är ett nödvändigt villkor för deras ytterligare aggregering är därför en kränkning av den funktionella aktiviteten hos blodplättar mycket ofta förknippad med brist på degranulering.
Tabell 1 beskriver den kemiska sammansättningen av innehållet i trombocytgranulat.
bord 1
Morfologisk studie av fraktionen av täta granuler, fraktionen av α-granuler, fraktionen av lysosomer och vesiklar från mänskliga blodplättar tillåter oss att adekvat bedöma deras morfofunktionella status.
Blodplattor
Blodplättar, eller blodplättar, i färskt mänskligt blod ser de ut som små, färglösa, runda eller spindelformade kroppar. De kan aggregera (agglutinera) till små eller stora grupper. Deras antal sträcker sig från 200 till 400 x 10 9 i 1 liter blod. Blodplattor är kärnfria fragment av cytoplasman separerade från megakaryocyter- gigantiska benmärgsceller.
Blodplättar i blodomloppet är formade som en bikonvex skiva. De avslöjar en ljusare perifer del - hyalomer och den mörkare, korniga delen - granulometer. Trombocytpopulationen innehåller både yngre och mer differentierade och åldrande former. Hyalomeren i unga plattor är färgad blå (basofilen), och i mogna - rosa (oxifilen). Unga former av blodplättar är större än äldre.
Blodplättsplasmalemmat har ett tjockt lager av glykokalyx och bildar invaginationer med utgående tubuli, även täckta med glykokalyx. Plasmalemmat innehåller glykoproteiner som fungerar som ytreceptorer involverade i processerna för adhesion och aggregation av blodplättar (dvs. processerna för blodkoagulering eller koagulering).
Cytoskelettet i blodplättar är välutvecklat och representeras av aktinmikrofilament och buntar av mikrotubuli placerade cirkulärt i hyalomeren och intill den inre delen av plasmalemma. Element i cytoskelettet säkerställer upprätthållandet av formen av blodplättar och deltar i bildandet av deras processer. Aktinfilament är involverade i att minska volymen (återdragning) av blodproppar som bildas.
Blodplattorna har två system av tubuli och tubuli. Den första är ett öppet system av kanaler associerade, som redan nämnts, med invaginationer av plasmalemma. Genom detta system släpps innehållet av trombocytgranulat ut i plasman och substanser absorberas. Den andra är det så kallade täta rörformiga systemet, som representeras av grupper av rör som liknar det släta endoplasmatiska retikulumet. Det täta tubulära systemet är platsen för syntes av cykloxygenas och prostaglandiner. Dessutom binder dessa rör selektivt tvåvärda katjoner och fungerar som en reservoar av Ca2+-joner. Ovanstående ämnen är nödvändiga komponenter i blodkoaguleringsprocessen.
Frisättningen av Ca 2+ -joner från rören till cytosolen är nödvändig för att säkerställa blodplättarnas funktion. Enzym cyklooxygenas metaboliserar arakidonsyra till bildning prostaglandiner och tromboxan A2, som utsöndras från plattorna och stimulerar deras aggregation under blodkoagulation.
När cyklooxygenas blockeras (till exempel med acetylsalicylsyra) hämmas trombocytaggregationen, vilket används för att förhindra bildandet av blodproppar.
Organeller, inneslutningar och speciella granuler identifierades i granulometern. Organeller representeras av ribosomer, element i det endoplasmatiska retikulumet i Golgi-apparaten, mitokondrier, lysosomer och peroxisomer. Det finns inneslutningar av glykogen och ferritin i form av små granuler.
Specialgranulat utgör huvuddelen av granulomeren och finns i tre typer.
Den första typen är stora alfagranulat. De innehåller olika proteiner och glykoproteiner som är involverade i blodkoaguleringsprocesser, tillväxtfaktorer och lytiska enzymer.
Den andra typen av granulat är deltagranuler som innehåller serotonin ackumulerat från plasma och andra biogena aminer (histamin, adrenalin), Ca2+-joner, ADP, ATP i höga koncentrationer.
Den tredje typen av små granuler representeras av lysosomer som innehåller lysosomala enzymer, såväl som mikroperoxisomer som innehåller enzymet peroxidas.
Innehållet i granulatet frigörs när plattorna aktiveras. öppna system kanaler kopplade till plasmalemma.
Huvudfunktionen hos blodplättar är deltagande i koaguleringsprocessen, eller koagulering, av blod - kroppens skyddande reaktion på skada och förhindrande av blodförlust. Blodplättar innehåller cirka 12 faktorer som är involverade i blodets koagulering. När kärlväggen är skadad, samlas plattorna snabbt och fäster vid de resulterande fibrinsträngarna, vilket resulterar i bildandet av en blodpropp som stänger defekten. I processen för trombbildning finns det flera stadier som involverar många blodkomponenter.
I det första skedet sker trombocytackumulering och frisättning av fysiologiskt aktiva substanser. I det andra steget - den faktiska koagulationen och stopp av blödning (hemostas). Först bildas aktivt tromboplastin från blodplättar (den så kallade inre faktorn) och från kärlets vävnader (den så kallade externa faktorn). Sedan, under påverkan av tromboplastin, bildas aktivt trombin från inaktivt protrombin. Vidare, under påverkan av trombin, bildas fibrinogen fibrin. Ca2+ krävs för alla dessa faser av blodkoagulation.
Slutligen, i det sista tredje steget, observeras tillbakadragande av blodproppen, associerad med sammandragning av aktinfilament i blodplättsprocesser och fibrintrådar.
Morfologiskt, i det första steget, sker således trombocytvidhäftning på basalmembranet och på kollagenfibrerna i den skadade kärlväggen, vilket resulterar i att blodplättsprocesser bildas och granuler som innehåller tromboplastin kommer ut från plattorna genom ett system av rör på deras yta. Det aktiverar reaktionen att omvandla protrombin till trombin, och det senare påverkar bildningen av fibrin från fibrinogen.
En viktig funktion hos blodplättar är deras deltagande i ämnesomsättningen serotonin. Blodplättar är praktiskt taget de enda blodelementen i vilka serotoninreserver ackumuleras från plasma. Bindning av serotonin med blodplättar sker med hjälp av högmolekylära faktorer i blodplasman och tvåvärda katjoner med deltagande av ATP.
Under processen för blodkoagulering frigörs serotonin från nedbrytande blodplättar, vilket verkar på vaskulär permeabilitet och kontraktion av vaskulära glatta muskelceller.
Livslängden för trombocyter är i genomsnitt 9-10 dagar. Åldrande blodplättar fagocyteras av mjältmakrofager. Ökad destruktiv funktion av mjälten kan orsaka en signifikant minskning av antalet blodplättar i blodet (trombocytopeni). För att rätta till detta kan mjälten behöva tas bort (mjälte).
När antalet blodplättar minskar, till exempel vid blodförlust, trombopoietin- en faktor som stimulerar bildningen av plattor från benmärgsmegakaryocyter.
· hemofili- ärftlig sjukdom orsakad av brist på faktor VIII eller IX i blodkoagulationen; manifesteras av symtom på ökad blödning; ärvt på ett könsbundet recessivt sätt;
· purpura- Flera små blödningar i huden och slemhinnorna;
· trombocytopen purpura-- det allmänna namnet för en grupp sjukdomar som kännetecknas av trombocytopeni och manifesteras av hemorragiskt syndrom (t.ex. Werlhofs sjukdom);
Del fyra – Blodformel, leukocytformel, åldersrelaterade förändringar i blod, egenskaper hos lymf.
Hemogram och leukogram
I medicinsk praxis spelar blodprover en stor roll. Kliniska tester undersöker blodets kemiska sammansättning (inklusive elektrolytsammansättning), bestämmer mängden bildade element, hemoglobin, erytrocytresistens, och många andra indikatorer. Hos en frisk person är de bildade elementen av blod i vissa kvantitativa förhållanden, som vanligtvis kallas ett hemogram eller blodformel.
Den så kallade differentialräkningen av leukocyter är viktig för att karakterisera kroppens tillstånd. Vissa procentandelar av leukocyter kallas leukogram eller leukocytformel.
Åldersrelaterade förändringar i blodet
Antalet röda blodkroppar vid födseln och under de första timmarna av livet är högre än hos en vuxen, och når 6,0-7,0 x 10 12 i 1 liter blod. Efter 10-14 dagar är det lika med samma antal som i en vuxen kropp. Under efterföljande perioder sker en minskning av antalet röda blodkroppar med minimala indikatorer under den 3-6:e levnadsmånaden (så kallad fysiologisk anemi). Antalet röda blodkroppar återgår till normala värden under puberteten. Nyfödda kännetecknas av närvaron av anisocytos med en dominans av makrocyter, ett ökat innehåll av retikulocyter, såväl som närvaron av ett litet antal kärnförsedda erytrocytprekursorer.
Antalet leukocyter hos nyfödda ökas och når 30 x 10 9 i 1 liter blod. Inom 2 veckor efter födseln sjunker deras antal till 9-15 x 10 9 på 1 liter (så kallad fysiologisk leukopeni). Antalet leukocyter når en nivå vid 14-15 års ålder som finns kvar hos en vuxen.
Förhållandet mellan antalet neutrofiler och lymfocyter hos nyfödda är detsamma som hos vuxna 4,5-9,0 x 10 9. Under efterföljande perioder ökar innehållet av lymfocyter, och neutrofiler minskar, och på den fjärde eller femte dagen utjämnas antalet av dessa typer av leukocyter - detta är den så kallade. först fysiologiskt kors leukocyter. En ytterligare ökning av antalet lymfocyter och en minskning av neutrofiler leder till det faktum att under det första-2:a året av ett barns liv står lymfocyter för 65% och neutrofiler - 25%. En ny minskning av antalet lymfocyter och en ökning av neutrofiler leder till en utjämning av båda indikatorerna hos 4-åriga barn (detta är den andra fysiologiska övergången). En gradvis minskning av innehållet av lymfocyter och en ökning av neutrofiler fortsätter fram till puberteten, när antalet av dessa typer av leukocyter når vuxennormen.
Lymfa
Lymf är en lätt gulaktig flytande vävnad som flyter i lymfatiska kapillärer och kärl. Den består av lymfoplasma (plasma lymfae) och bildade element. Förbi kemisk sammansättning Lymfoplasma är nära blodplasma, men innehåller färre proteiner. Lymfoplasma innehåller också neutrala fetter, enkla sockerarter, salter (NaCl, Na2CO3, etc.), samt olika föreningar, som inkluderar kalcium, magnesium och järn.
De bildade delarna av lymfan representeras huvudsakligen lymfocyter(98 %), samt monocyter och andra typer av leukocyter. Lymf filtreras från vävnadsvätska till blinda lymfatiska kapillärer, där, under påverkan av olika faktorer, olika komponenter av lymfoplasma ständigt tillförs från vävnaderna. Från kapillärerna rör sig lymfan in i de perifera lymfkärlen, genom dem in i lymfkörtlarna, sedan in i de stora lymfkärlen och rinner ut i blodet.
Sammansättningen av lymfan förändras ständigt. Det finns perifer lymfa (dvs före lymfkörtlarna), mellanliggande (efter att ha passerat genom lymfkörtlarna) och centrala (lymf i bröst- och höger lymfgångar). Processen för lymfbildning är nära relaterad till flödet av vatten och andra ämnen från blodet till de intercellulära utrymmena och bildandet av vävnadsvätska.
Några termer från praktisk medicin:
· neonatal gulsot, fysiologisk - övergående gulsot (hyperbilirubinemi), som förekommer hos de flesta friska nyfödda under de första dagarna av livet;
Blodplättar, blodplättar, i färskt mänskligt blod ser ut som små, färglösa kroppar av rund, oval eller spindelform, 2-4 mikron i storlek. De kan förenas (agglutineras) till små eller stora grupper (bild 4.29). Deras mängd i humant blod varierar från 2,0 × 10 9 /l till 4,0 × 10 9 /l. Blodplattor är kärnfria fragment av cytoplasma separerade från megakaryocyter - jätteceller i benmärgen.
Blodplättar i blodomloppet är formade som en bikonvex skiva. När blodutstryk färgas med azur-eosin avslöjar blodplättarna en ljusare perifer del - hyalomeren och en mörkare, granulär del - granulomeren, vars struktur och färg kan variera beroende på utvecklingsstadiet för blodplättarna. Trombocytpopulationen innehåller både yngre och mer differentierade och åldrande former. Hyalomeren i unga plattor är färgad blå (basofilen), och i mogna - rosa (oxifilen). Unga former av blodplättar är större än äldre.
I trombocytpopulationen finns det 5 huvudtyper av blodplättar:
1) ung - med en blå (basofil) hyalomer och enkla azurofila granuler i en rödviolett granulomer (1-5%);
2) mogen - med en något rosa (oxifil) hyalomer och välutvecklad azurofil granularitet i granulomeren (88%);
3) gammal - med en mörkare hyalomer och granulomer (4%);
4) degenerativ - med en gråblå hyalomer och en tät mörklila granulomer (upp till 2%);
5) gigantiska former av irritation - med en rosa-lila hyalomer och violett granulomer, 4-6 mikron i storlek (2%).
Vid sjukdomar kan förhållandet mellan olika former av blodplättar förändras, vilket beaktas när man ställer en diagnos. En ökning av antalet juvenila former observeras hos nyfödda. Vid cancer ökar antalet gamla blodplättar.
Plasmalemmat har ett tjockt lager av glykokalyx (15-20 nm), bildar invaginationer med utgående tubuli, även täckt med glykokalyx. Plasmalemma innehåller glykoproteiner som fungerar som ytreceptorer involverade i processerna för adhesion och aggregation av blodplättar.
Cytoskelettet i trombocyter är välutvecklat och representeras av aktinmikrofilament och buntar (10-15 vardera) av mikrotubuli, placerade cirkulärt i hyolomeren och intill den inre delen av plasmalemma (Fig. 46-48). Element i cytoskelettet säkerställer upprätthållandet av formen på blodplättar och deltar i bildandet av deras processer. Aktinfilament är involverade i att minska volymen (återdragning) av blodproppar som bildas.
Blodplattorna har två system av tubuli och rör, tydligt synliga i hyalomeren under elektronmikroskopi. Den första är ett öppet system av kanaler associerade, som redan nämnts, med invaginationer av plasmalemma. Genom detta system släpps innehållet av trombocytgranulat ut i plasman och substanser absorberas. Det andra är det så kallade täta rörformiga systemet, som representeras av grupper av rör med elektrontätt amorft material. Det liknar det släta endoplasmatiska retikulumet och bildas i Golgi-apparaten. Det täta tubulära systemet är platsen för syntes av cyklooxygenas och prostaglandiner. Dessutom binder dessa rör selektivt tvåvärda katjoner och fungerar som en reservoar av Ca 2+ joner. Ovanstående ämnen är nödvändiga komponenter i blodkoaguleringsprocessen.
| A | B | I |
| G | D |
Ris. 4.30.Tromplättar. A – blodplättar i ett perifert blodutstryk. B – diagram över strukturen av en blodplätt. B – TEM. D – icke-aktiverade (markerade med en pil) och aktiverade (markerade med två pilar) trombocyter, SEM. E – trombocyter som fäster vid aortaväggen i området för skada på endotelskiktet (D, E – enligt Yu.A. Rovenskikh) 1 – mikrotubuli; 2 - mitokondrier; 3 - u-granulat; 4 - system av täta rör; 5 – mikrofilament; 6 - system av tubuli anslutna till ytan; 7 - glykokalyx; 8 - täta kroppar; 9 – cytoplasmatiskt retikulum.
Frisättningen av Ca 2+ från rören till cytosolen är nödvändig för att säkerställa att blodplättarna fungerar (vidhäftning, aggregation, etc.).
Organeller, inneslutningar och speciella granuler identifierades i granulometern. Organeller representeras av ribosomer (i unga plattor), element i det endoplasmatiska retikulumet, Golgi-apparaten, mitokondrier, lysosomer och peroxisomer. Det finns inneslutningar av glykogen och ferritin i form av små granuler.
Speciella granuler i mängden 60-120 utgör huvuddelen av granulomeren och representeras av två huvudtyper - alfa- och deltagranuler.
Första typen: a-granulat- dessa är de största (300-500 nm) granulerna, med en finkornig central del, separerad från det omgivande membranet av ett litet ljust utrymme. De innehåller olika proteiner och glykoproteiner som är involverade i blodkoaguleringsprocesser, tillväxtfaktorer och hydrolytiska enzymer.
De viktigaste proteinerna som utsöndras under trombocytaktivering inkluderar lamina faktor 4, p-tromboglobin, von Willebrand-faktor, fibrinogen, tillväxtfaktorer (trombocyt-PDGF, transformerande TGFp), koagulationsfaktor - tromboplastin; Glykoproteiner inkluderar fibronektin och trombospondin, som spelar en viktig roll i blodplättsvidhäftningsprocesser. Proteiner som binder heparin (förtunnar blodet och förhindrar att det koagulerar) inkluderar faktor 4 och p-tromboglobulin.
Den andra typen av granulat är 5-granuler(delta granulat) - representeras av täta kroppar 250-300 nm i storlek, som har en excentriskt placerad tät kärna omgiven av ett membran. Det finns ett väldefinierat ljusutrymme mellan krypterna. Huvudkomponenterna i granulerna är serotonin, ackumulerat från plasma, och andra biogena aminer (histamin, adrenalin), Ca 2+, ADP, ATP i höga koncentrationer.
Dessutom finns det en tredje typ av små granuler (200-250 nm), representerade av lysosomer (ibland kallade A-granuler) som innehåller lysosomala enzymer, samt mikroperoxisomer som innehåller enzymet peroxidas. När plattorna aktiveras frigörs innehållet i granulerna genom ett öppet system av kanaler kopplade till plasmalemma.
Den huvudsakliga funktionen för blodplättar är att delta i processen för blodkoagulering - kroppens skyddande svar på skador och förhindra blodförlust. Blodplättar innehåller cirka 12 faktorer som är involverade i blodets koagulering. När kärlväggen är skadad, samlas plattorna snabbt och fäster vid de resulterande fibrinsträngarna, vilket resulterar i bildandet av en blodpropp som stänger såret. I processen för trombbildning finns det flera stadier som involverar många blodkomponenter.
En viktig funktion hos trombocyter är deras deltagande i metabolismen av serotonin. Blodplättar är praktiskt taget de enda blodelementen i vilka serotoninreserver ackumuleras från plasma. Bindning av serotonin av blodplättar sker med hjälp av högmolekylära faktorer av blodplasma och tvåvärda katjoner.
Under processen för blodkoagulering frigörs serotonin från nedbrytande blodplättar, vilket verkar på vaskulär permeabilitet och kontraktion av vaskulära glatta muskelceller. Serotonin och dess metaboliska produkter har antitumör- och strålskyddande effekter. Hämning av serotoninbindning av blodplättar har hittats i ett antal blodsjukdomar - malign anemi, trombocytopenisk purpura, myelos, etc.
Livslängden för trombocyter är i genomsnitt 9-10 dagar. Åldrande blodplättar fagocyteras av mjältmakrofager. Ökad destruktiv funktion av mjälten kan orsaka en signifikant minskning av antalet blodplättar i blodet (trombocytopeni). För att eliminera detta krävs operation - avlägsnande av mjälten (splenektomi).
När antalet blodplättar minskar, till exempel vid blodförlust, ansamlas trombopoietin i blodet - ett glykoprotein som stimulerar bildningen av blodplättar från benmärgsmegakaryocyter.
Blodplättar och hemostas
M.A. Panteleev1-5, A.N. Sveshnikova1-3
1 Center teoretiska problem Fysikalisk-kemisk farmakologi RAS, Moskva; 2Federal State Budgetary Institution Federal Scientific and Clinical Center for Children's Orthopetics uppkallad efter. Dmitry Rogachev, Rysslands hälsoministerium, Moskva; 3Fysikfakulteten, Federal State Budgetary Educational Institute of Higher Professional Education "Moskva State University dem. M.V. Lomonosov";
4FGBU State Scientific Center vid Rysslands hälsoministerium, Moskva; 5GemaKor LLC, Moskva
Kontakter: Mikhail Alexandrovich Panteleev [e-postskyddad]
Blodplättar är anukleära cellfragment som spelar en viktig roll i hemostas, stoppa blödning vid skada, såväl som vid patologisk trombbildning. Det huvudsakliga sättet att trombocyter utför sin funktion är genom att bilda aggregat som täcker platsen för skadan. De får förmågan att aggregera som ett resultat av en övergående process som kallas aktivering. Trots deras relativt enkla och otvetydiga funktion är strukturen hos blodplättar mycket komplex: de har en nästan komplett uppsättning organeller, inklusive endoplasmatiska retikulum, mitokondrier och andra formationer; när de aktiveras utsöndrar blodplättar en mängd olika granuler och interagerar med plasmaproteiner och blodkroppar och andra vävnader; deras aktivering i sig kontrolleras av många receptorer och komplexa signalkaskader. I denna översyn kommer vi att överväga trombocytens struktur, mekanismerna för dess funktion i hälsa och sjukdom, metoder för att diagnostisera störningar i blodplättsfunktioner och metoder för att korrigera dem. Särskild uppmärksamhet kommer att ägnas åt de områden inom trombocytvetenskapen där mysterier fortfarande lurar.
Nyckelord: trombocytstruktur, trombocytfunktion
Blodplättar och hemostas M.A. Panteleev1-5, A.N. Sveshnikova1-3
"Theoretical Problems Center of Physical and Chemical Pharmacology, Russian Academy of Sciences, Moskva; 2Federal Research Center of Pediatric Hematology, Oncology and Immunology uppkallad efter Dmitriy Rogachev,
Rysslands hälsoministerium, Moskva; 3Lomonosov Moscow State University, Fysiska fakulteten, Moskva; 4Hematological Research Center, Rysslands hälsoministerium, Moskva; 5HemaCore Company, Moskva
Blodplättar är anukleära cellfragment som spelar en viktig roll i hemostas, avbrytande av blödning efter skada, såväl som vid patologisk trombbildning. Trombocyternas huvudsakliga verkan är bildandet av aggregat som överlappar skadan. De fick förmågan att aggregera genom den övergångsprocess som kallas aktivering. Trots den relativt enkla och bestämda funktionen är trombocytstrukturen mycket svår: de har nästan en full uppsättning organeller, inklusive endoplasmatiska retikulum, mitokondrier och andra enheter. När aktiverade blodplättar utsöndrar interagerar olika granuler med plasmaproteiner och röda blodkroppar och andra vävnader. Deras aktivering styrs av flera receptorer och komplexa signalkaskader. I denna översyn övervägdes trombocytstrukturens mekanismer för dess funktion i hälsa och sjukdom, diagnostiska metoder för trombocytfunktion och metoder för att korrigera dem. Särskild uppmärksamhet kommer att ägnas åt de områden inom trombocytvetenskapen, som fortfarande ligger dolda mysterier.
Nyckelord: trombocytstruktur, trombocytfunktion
Introduktion
Blodplättar är små, 2-4 mikrometer i diameter, anukleära cellulära fragment (även om de ibland kallas celler), cirkulerar i blodomloppet i en koncentration av 200-400 tusen per mikroliter och är ansvariga för nyckelstadier i processen att stoppa blödning - hemostas. I händelse av skada kan de fästa till skadade vävnader och till varandra, bilda ett blodplättspluggaggregat (fig. 1), stoppa blodförlust och förhindra mikrober från att komma in i cirkulationssystemet. Detta är inte den enda mekanismen för hemostas, men det är extremt viktigt. Ärftliga och förvärvade störningar av trombocytfunktionen, såsom
som Glanzmanns trombasteni eller immuntrombocytopeni, är allvarliga sjukdomar som kännetecknas av farlig blödning. Blodplättar deltar också aktivt i andra komponenter i hemostasmekanismen: vissa ämnen de utsöndrar orsakar lokal vasokonstriktion, medan andra påskyndar blodkoagulationsreaktioner.
Å andra sidan kan överdriven funktion eller antal blodplättar, eller andra störningar i det kardiovaskulära systemet leda till bildandet av blodplättsaggregat inte utanför, utan inuti kärlet - blodproppar (Fig. 2). Blodproppar kan bildas i de flesta fall olika situationer och spelar en central roll i sådana patologiska tillstånd
Ris. 1. Hemostatiskt aggregat bildat av blodplättar i arteriolen hos en hund. Observerad under ett ljusmikroskop överlappar en blodplättsplugg (H) ett brustet kärl (V). Biopsi utfördes 3 minuter efter skadan. Många röda blodkroppar i den övre delen av bilden finns i sårets lumen, sträcker sig från vänster till höger. Storleksskalan i det nedre högra hörnet motsvarar 10 mikrometer. Återges från
Ris. 2. Bildning av en blodpropp i arteriolen. Intravital DIC-mikroskopi av trombbildning i ett råttkärl skadat av fotoaktivering av rosa bengalfärgämne. En blodpropp på kärlväggen som täcker platsen för skadan indikeras i den övre högra delen av bilden. Det är möjligt att särskilja enskilda blodplättar i den och märka att de behåller sin diskoida form under de första stadierna av fastsättning. Flödesriktningen indikeras med en pil. Skalstången motsvarar 5 mikrometer. Återges från
händelser som hjärtinfarkt och stroke. De är alltså ansvariga för lejonparten av dödligheten och funktionshinder i modern värld, och trombocythämmande läkemedel som klopidogrel är bland de mest sålda läkemedlen på planeten.
Blodplättar är enkla på många sätt: de har ingen kärna, liten eller ingen proteinsyntes och kan inte växa eller dela sig. Trombocytens uppgift - att hålla sig till skadeplatsen - ser också enkel och entydig ut jämfört med uppgifterna för nästan vilken annan cell som helst. Men i praktiken visar det sig att denna enkelhet är vilseledande. För att utföra sin funktion måste de aktiveras i en process som styrs av ett dussin aktivatorer som verkar genom många receptorer. Nätverket av signalvägar i blodplätten som styr dess respons är komplext och dåligt förstådd. Blodplättsresponsen i sig är inte en enkel "klibbning", utan inkluderar dussintals funktioner, allt från primär vidhäftning till vesikulering.
Förutom grundläggande svårigheter är blodplättar fyllda med många praktiska mysterier: för närvarande har läkare varken ett adekvat test för att bedöma trombocytfunktionen eller ett effektivt verktyg för att förbättra den. Trots de enorma framsteg som uppnåddes i slutet av 1900-talet i samband med utvecklingen av läkemedel som är antagonistiska mot glykoprotein IIb-IIIa och P2Y12-receptorn, är undertryckandet av blodplättsaktivitet för att bekämpa trombos fortfarande inte ett löst problem. Slutligen pågår nu intensiv forskning om trombocyternas roll bortom hemostas - i angiogenes, immunitet och andra system.
Både kliniska och biologisk forskning blodplättar tilldrar sig stort intresse från specialister över hela världen. Nästan varje år ger oss nya upptäckter och idéer om de viktigaste processerna bokstavligen inom oss senaste åren har genomgått radikala förändringar. I den här recensionen försökte vi fokusera på trombocytens grundläggande begrepp och prata om de senaste framstegen för att förstå dess funktion. För dem som vill bli mer bekanta med olika aspekter av livet i denna fantastiska cell, kan vi rekommendera den grundläggande läroboken av A.V. Mazurova. Ägare engelska språket kommer att hitta värdefull information i referensläroboken Trombocyter, redigerad av Alan Michelson, som regelbundet trycks om.
Trombocytstruktur
I sin ursprungliga, icke-aktiverade form liknar blodplättarna bikonvexa "plattor" (Fig. 3, vänster). På grund av sin lilla storlek (2-4 mikron i diameter) passerar de fritt genom kapillärer,
Ris. 3. Blodplättar. Elektronmikrofotografi av icke-aktiverade blodplättar som behåller sin diskformade form (vänster) och ADP-aktiverade blodplättar i ett aggregat (höger). Återges från
så att deras form är konstant, i motsats till att de röda blodkropparna tvingas pressa sig genom kapillärerna. Först vid aktivering ändras formen på blodplättarna och blir i de flesta fall amöboid (fig. 3, höger). Formen på blodplätten upprätthålls både av spektrincytoskelettet, som ger elasticitet åt deras skal, och av en ring av tubulinmikrotubuli (fig. 4), som förstörs vid aktivering. Cellens cytoplasma innehåller många granuler, varav de viktigaste är täta granuler som innehåller övervägande lågmolekylära ämnen som serotonin och adenosindifosfat (ADP), och alfagranuler som innehåller proteiner - fibrinogen, trombospondin, P-selektin, koagulationsfaktor V, von Willebrand faktor och många andra . Innehållet i dessa granuler utsöndras när de aktiveras
tioner. Det är viktigt att notera att blodplättsformen är illusorisk på många sätt. Dess inre miljö är faktiskt en kontinuerlig "svamp", ett nätverk av membrankanaler som fungerar som en ytterligare källa för membranytan vid aktivering och främjar utsöndringen av granulat.
Förmågan att aktivera - en snabb och i de flesta fall irreversibel övergång till ett nytt tillstånd - är huvudkvaliteten hos en trombocyt. Nästan alla betydande störningar kan fungera som en aktiveringsstimulans miljö, ner till enkel mekanisk påfrestning. Emellertid är de huvudsakliga fysiologiska aktivatorerna för blodplättar: 1) kollagen - huvudproteinet i den extracellulära matrisen; 2) trombin - serinproteinas, det centrala enzymet i plasmakoagulationssystemet; 3) ADP - adeninnukleotid, som frisätts från förstörda kärlceller eller utsöndras av täta granuler av själva blodplättarna; 4) tromboxan A2 - en lipid från eikosanoidklassen, syntetiserad och utsöndrad av blodplättar.
Verkan av varje trombocytaktivator medieras genom specialiserade receptorer i trombocytmembranet. Således aktiverar kollagen blodplättar genom glykoprotein VI, trombin har 2 huvudsakliga proteinasaktiverade receptorer PAR1 och PAR4, ADP verkar genom purinoceptorerna P2Y1 och P2Y12. Stimulering av någon av receptorerna leder till aktiveringen av ett komplext nätverk av intracellulära signalkaskader som styr cellens svar; med olika receptorer som i allmänhet utlöser olika vägar.
Membran
Öppet rörsystem
Mikrotubuli ring
Täta granulat
a-granulat
Mitokondrier
Tätt rörsystem
Glykogen
Täta granulat
Ris. 4. Trombocytstruktur. I diagrammet till vänster kan du urskilja huvudelementen i trombocytstrukturen, observerade under ett elektronmikroskop. Återges från. Till höger är en tredimensionell rekonstruktion av insidan av en blodplätt med hjälp av elektrontomografidata. Observera att det kanalikulära systemet som visas i blått tar upp en stor del av cellens volym. Återges från
Aktivering av blodplättar manifesteras externt av många interna omarrangemang och förändringar i egenskaper, de viktigaste bland vilka är: 1) förändring i form till amöboid, för vissa blodplättar - sfäriska; 2) stärka förmågan till vidhäftning - fästning till skadeplatsen; 3) uppkomsten av förmågan att aggregera - fästa till andra blodplättar för att bilda en fullvärdig plugg; 4) utsöndring av de många låg- och högmolekylära föreningarna beskrivna ovan från täta granuler, alfa-granuler och andra källor; 5) exponering av prokoagulantmembranet.
Vissa av dessa egenskaper tjänar till att implementera huvudfunktionen hos blodplättar - bildandet av en hemostatisk plugg, den andra - för att påskynda blodkoagulationsreaktioner. Exponering av prokoagulantmembranet och utsöndring av alfagranuler är således nödvändiga för implementeringen av den andra funktionen hos blodplättar.
Blodkoagulering är en kaskad av reaktioner i blodplasman som slutar med bildandet av ett nätverk av fibrinfibrer och överföring av blod från en vätska till ett geléliknande tillstånd. Många nyckelkoagulationsreaktioner är membranberoende (fig. 5), och accelererar i många storleksordningar i närvaro av negativt laddade fosfolipidmembran, till vilka koagulationsproteiner binder genom så kallade kalciumbryggor. Under normala förhållanden stöder inte trombocytmembranet koaguleringsreaktioner. Negativt laddade fosfolipider, främst fosfatidylserin, är koncentrerade i det inre
skikt av membranet, och fosfatidylkolin i det yttre skiktet binder koagulationsfaktorer mycket sämre. Även om vissa koagulationsfaktorer kan binda till icke-aktiverade blodplättar, leder detta inte till bildandet av aktiva enzymatiska komplex.
Aktivering av trombocyten leder förmodligen till aktivering av enzymet scramblase, som snabbt, specifikt, bilateralt och ADP-oberoende börjar överföra negativt laddade fosfolipider från ett lager till ett annat. Som ett resultat uppstår ett accelererat upprättande av jämvikt, där koncentrationen av fosfatidylserin i båda skikten blir lika. Vid aktivering inträffar dessutom exponering och/eller konformationsförändringar i många transmembranproteiner i det yttre lagret av membranet, och de förvärvar förmågan att specifikt binda koagulationsfaktorer, vilket accelererar reaktioner med deras deltagande. Intressant nog uppvisar endast vissa blodplättar sådana egenskaper när de aktiveras.
Generellt sett kan det aktiverade tillståndet för en trombocyt vara annorlunda: trombocytaktivering har flera grader, och uttrycket av den prokoagulerande ytan är en av de högsta. Endast trombin eller kollagen kan producera ett så starkt svar. Svagare aktivatorer, särskilt ADP, kan bidra till att starka aktivatorer fungerar. Emellertid kan de inte självständigt orsaka frisättning av fosfatidylserin till det yttre lagret av membranet; deras effekter reduceras till att ändra formen, aggregationen och utsöndringen av en del av granulerna.
Ris. 5. Membranblodkoagulationsreaktioner. Aktivering av blodplättar leder till uppkomsten av fosfatidylserin i det yttre lagret av trombocytmembranet. Koagulationsfaktorer binder till sådana membran genom kalciumbryggor och bildar proteinkomplex där koagulationsreaktionerna accelereras i storleksordningar. Illustrationen visar ett protrombinaskomplex, bestående av faktorerna Xa, Va, II, beläget på ytan av ett dubbelskiktsmembran
Hur fungerar en blodplätt?
Det vanligaste sättet att testa blodplättshemostassystemets tillstånd i modern diagnostisk praxis är aggregering, där effekten av att tillsätta en viss aktivator till en trombocytsuspension bedöms genom optisk densitet. En aktivator, oftast ADP eller kollagen, tillsätts till den blodplättsrika blodplasman under konstant omrörning i flera minuter. Blodplättarna aktiveras, interagerar med varandra och bildandet av aggregat sker, vilket kan ses av en minskning av suspensionens grumlighet orsakad av en minskning av antalet ljusspridande partiklar. Det finns varianter av aggregationstestet som involverar olika detektionsprinciper: till exempel kan trombocytaggregation i helblod mätas genom att använda impedansmetoden istället för den optiska metoden.
Kanske, just på grund av prevalensen av aggregeringstestet under de senaste decennierna, har idén blivit fast etablerad i många specialisters medvetande att bildandet av en trombocytpropp eller hemostatisk plugg i kroppen sker på liknande sätt: för det första aktivering (till exempel släppt från cellen).
ström av den skadade kärlväggen ADP), och sedan aggregering. Även om studiet av trombocyttillväxt i flödeskammare har en historia på nästan ett halvt sekel, har denna traditionella uppfattning börjat ifrågasättas först under de senaste decennierna.
Låt oss överväga det första steget av trombbildning: trombocytvidhäftning till kollagen som exponeras på platsen för skadan. Låt oss försöka uppskatta de tider och avstånd som är typiska för denna process. Låt den karakteristiska storleken på skadeområdet vara, säg, l = 10 mikrometer (1 fristående endotelcell). Låt flödeshastigheten vara arteriell, det betyder att flödeshastighetsgradienten på väggen är ca u = 1000 s - 1. Då kommer blodplätten, som har en karakteristisk storlek (i storleksordning) på ca x = 1 mikrometer, att röra sig nära väggen med en hastighet v = x x u = 1000 mikrometer per sekund. Detta innebär att den kommer att flyga över skadeplatsen på en tid av l/v = 10 mikrosekunder, trots att den typiska aktiveringstiden för en blodplätt är minuter, för vissa händelser (t.ex. aktivering av integriner) flera sekunder, men inte en hundradels sekund. Detta leder till den enda möjliga slutsatsen, som nu har fått stöd experimentellt: för att aktiveras normalt måste trombocyten först fästa vid skadeplatsen.
Dessutom gäller samma sak för efterföljande händelser med ökande trombstorlek - aggregering. En blodplätt som flyter över en tromb som växer i en artär måste hinna sammanfoga den på hundradelar av en sekund. Därför kan aggregation i kroppen också ske endast på ett sätt: först aggregation och sedan aktivering.
Ett annat problem är rörelsen av en blodplätt i ett kärl över blodflödet. Om blodplättarna var jämnt fördelade i blodet och lugnt rörde sig med ett laminärt flöde längs kärlet (och vid skada längs såret), var och en längs sin egen flödeslinje, kunde de inte närma sig skadeplatsen för att utföra sin uppgift vid hemostas: för vidhäftning kräver platsen för skada eller fästning till en redan aktiverad blodplätt i en tromb någon form av stöt fysisk styrka föra celler i kontakt. I in vitro-tester utförs denna uppgift vanligtvis med en magnetomrörare; vad fungerar i kroppen?
Ovanstående överväganden kan naturligtvis inte tjäna som bevis för en ny bild av blodplättshemostas och trombos. Denna nya bild, som kommer att beskrivas nedan, har framkommit under de senaste 10 åren som ett resultat av aktivt experimentellt arbete av många forskare, bland vilka en ledande roll spelas av Shaun P. Jackson-laboratoriet i Australien; Dessutom erhölls de allra flesta resultat med hjälp av videomikroskopi
observationer av trombbildning in vivo. De numeriska uppskattningarna som presenteras för läsarens uppmärksamhet är endast avsedda att visa overkligheten och den interna inkonsekvensen i den traditionella idén om trombocytaggregation.
Hur bildas en trombocytpropp i verkligheten?
Det första steget är förskjutningen av blodplättar till kärlets väggar, utförd av röda blodkroppar. Röda blodkroppar upptar nästan hälften av dess volym, de är en storleksordning större än blodplättar i både koncentration och massa. Kollisioner av röda blodkroppar som rör sig med olika hastigheter på olika flödeslinjer leder till deras omfördelning och koncentration nära kärlets axel. Många detaljer om denna process är oklara, men liknande omfördelningar har observerats i suspensioner av partiklar av olika typer, inte bara i blodet. Lätta och små blodplättar skjuts ständigt ut till periferin, vilket är extremt bekvämt, eftersom det är där, nära potentiella skadeställen, som deras arbetsplats är belägen; Således är den lokala koncentrationen av blodplättar nära kärlväggen en storleksordning högre än genomsnittet i blodet.
Dessutom, även nära kärlets väggar, genomgår blodplättar ständigt kollisioner med röda blodkroppar, vilket faktiskt leder till själva blandningen som är nödvändig för att interaktion ska inträffa. Tack vare sådana kollisioner pressas blodplättar ofta mot väggen, och om det finns en skada där kan de fästa vid den. Förutom de 2 huvudmekanismerna för vilka tillförlitliga teorier har byggts - förskjutning och konstant tryck - diskuteras nu andra, men det experimentella faktumet är obestridligt: närvaron av erytrocyter ökar tillväxthastigheten för ett blodplättsaggregat på en skadad yta med mer än 10 gånger.
Det andra problemet är behovet av att snabbt och försiktigt stoppa en blodplätt som befinner sig på platsen för skadan eller nära en växande blodpropp. För att delta i bildandet av en blodpropp eller tromb måste blodplätten släcka sin avsevärda hastighet. För detta ändamål finns det en speciell receptor på blodplättar, glykoprotein Ib-V-IX och von Willebrand faktor löst i blodet (fig. 6). Denna faktor, som cirkulerar i form av stora multimerer upp till 100 nanometer i diameter, kan reversibelt binda till kollagen och blodplättar i tromben, så att den snabbt täcker dem. Blodplättar som rusar genom att klamra sig fast vid von Willebrand-faktorn och börjar sluta. Om de skulle binda kollagen direkt, kan det vara skadligt att abrupt stoppa dem, men svagt bunden von Willebrand-faktor kan lossna och fästa igen till kollagen, så att blodplättarna snabbt kan återhämta sig.
att sakta ner, glida bara några av dess längder, som ett flygplan som landar på magen.
Aktivering i detta tillvägagångssätt är inte det första, utan det sista steget i bildandet av en blodpropp. En blodplätt som är reversibelt bunden till skadeplatsen kan lossna; aktivering kan dock stabilisera den. Blodplättar i det första lagret, som sitter direkt på kollagen, aktiveras av kollagen genom glykoprotein VI-receptorn och binder sedan fast till kollagen genom integrin a2p1-receptorn: proteiner i denna familj kan ändra sin konformation och styrkan i bindningen till målet under påverkan av intracellulära signaler (Fig. 6). I sitt normala tillstånd interagerar det inte med kollagen, men när det aktiveras är det ordentligt fäst vid det.
Fästningen av efterföljande lager av blodplättar, det vill säga den faktiska tillväxten av en blodpropp, sker på ett liknande sätt: till en början sitter cellerna löst på von Willebrand-faktorn och efter aktivering fästs de säkert genom integrinreceptorer. Skillnaden är att blodplättar kommunicerar med varandra genom ett annat integrin, kallat aPbp3 (eller glykoprotein Pb-Sha): dessa receptorer "griper" fibrinogenmolekyler från båda sidor och genom sådana "fibringen-bryggor" binder enskilda blodplättar. Den andra skillnaden är att nästa skikt av blodplättar aktiveras inte av kontakt med kollagen (som redan täcks av det första skiktet), utan av lösliga aktivatorer, som antingen utsöndras av själva blodplättarna (ADP, tromboxan A2) eller bildas under funktionen av plasmakoagulationssystemet (trombin). Det är viktigt att återigen betona att dessa aktivatorer uteslutande verkar inom tromben: det snabba flödet utanför den för bort dem och förhindrar rekrytering av nya celler in i tromben.
Bilden av trombocyttillväxt in vivo är nu ganska väl etablerad och händelseförloppet som beskrivs ovan är allmänt accepterat. Det finns dock många oklara områden i den, som kommer att diskuteras nedan.
Problem med att diagnostisera trombocytfunktion
För närvarande utförs minst 90 % av blodplättsfunktionsdiagnostiken med hjälp av aggregeringsstudier. Principerna och begränsningarna för detta tillvägagångssätt har diskuterats ovan; Huvudproblemet är att inget av aggregeringstesterna motsvarar vad som sker in vivo.
Förmodligen tillhandahålls ytterligare 10% av den funktionella bedömningen av flödescytometri, vilket gör att vi kan bestämma den antigena sammansättningen av proteiner på ytan av blodplätten. De mest utbildade specialisterna kan också använda cytometri för att karakterisera trombocytfunktionerna mer i detalj: integrinaktivering, granulfrisättning och fosfatidylserin. Detta ger användbar information om enskilda molekyler och cellförmågor. Allt detta svarar dock inte på den allmänna frågan: hur man adekvat bedömer trombocytfunktionen i allmänhet?
Det mest naturliga svaret: vi måste tvinga blodplättar att bilda blodproppar under förhållanden nära fysiologiska. Flödeskammare, där blodplättsvidhäftning till ett kollagenbelagt substrat studeras med hjälp av mikroskopi, får nu ökad användning. För närvarande finns kommersiellt tillgängliga kameror redan och deras standardisering pågår, om än i någon betydande utsträckning klinisk tillämpning Det är fortfarande en lång väg kvar att gå i utövandet av det diagnostiska komplexet. En möjlig rival till videomikroskopi är liknande metoder som används
Vid GP Ib-V-IX | GP VI
icke-handling
kollagen
Ris. 6. Huvudmekanismen för den initiala tillväxten av en trombocyttromb. Den primära fixeringen av trombocyten vid platsen för skadan sker genom interaktionen av den huvudsakliga adhesionsreceptorn för glykoproteinet III-Y-1X med den intermediära molekylen von Willebrand-faktor (vWF), fäst till det exponerade kollagenet (steg 1). Signalreceptorn glykoprotein VI binder sedan till kollagen, vilket leder till blodplättsaktivering (steg 2). Aktivering av aggregationsreceptorer av integriner a2p1 (tjänar för bindning av kollagen) och aShp3 (för bindning genom fibrinogenbryggor med andra blodplättar) främjar fixeringen av den aktiverade trombocyten på kollagen (steg 3) och skapar grunden för fortsatt tillväxt av tromben. Återges från
i apparater som RBL, där blodplättarnas förmåga att täppa till med aggregat bedöms en patron genom vilken helblod pumpas.
Problem med korrigering av trombocytfunktion
Kontroll av trombocytfunktionen är ett av de viktigaste sätten att bekämpa arteriell trombos av nästan alla slag. Ursprungligen var det huvudsakliga läkemedlet för detta ändamål aspirin, som blockerar syntesen av tromboxan A2: trots läkemedlets långa historia, var dess förmåga först under andra hälften av 1900-talet att undertrycka trombbildning och minska risken för hjärtinfarkt. upptäckt. På 1990-talet dök det upp effektiva trombocythämmande medel som angriper fibrinogenreceptorn, integrin αββ3: abciximab, tirofiban, eptifibatid, såväl som det inhemska läkemedlet monafram. Nu är båda dessa klasser av läkemedel till stor del ersatta av hämmare av adenosindifosfatreceptorn P2Y12: dessa är främst klopidogrel, samt prasugrel, ticagrelor och cangrelor. För närvarande pågår ett aktivt arbete med att skapa nya läkemedel som är effektivare och har mindre risk för blödningar.
En svårare uppgift är vad man ska göra när det finns få blodplättar eller de inte fungerar bra? Tekniken för att förbereda och lagra trombocytkoncentrat för transfusion uppnådde sina bästa resultat i mitten av 1980-talet, och inga grundläggande genombrott har skett sedan dess. Den korta livslängden, den höga risken för immunkomplikationer och infektion hos patienten, den ständigt förvärrade bristen på donatorer över hela världen och frånvaron tills helt nyligen av konstgjorda substitut gör situationen med blodplättstransfusion extremt otillfredsställande, kanske den mest problematiska av alla. blodkomponenter.
Under de senaste decennierna, den enda tillgängliga för klinisk användning
Ett alternativ till konventionella trombocytkoncentrat var kryokonservering, vilket gjorde det möjligt att förlänga deras livslängd till flera år. Men det var inte möjligt att helt lösa problemet med att bevara trombocyternas egenskaper under frysning och upptining. Dessutom visade det sig att frysning av dessa celler var förenat med så många tekniska svårigheter att det hittills inte har kunnat konkurrera med användningen av ofrysta trombocytkoncentrat.
Det är därför varje år mer och mer uppmärksamhet ägnades åt det arbete som började redan på 1950-talet för att skapa nya läkemedel och metoder som radikalt kan förlänga livslängden och användarvänligheten för donatorblodplättar, eller till och med skapa möjliga analoger som tillåter dem att helt överge deras användning. Antibakteriella läkemedel och hämmare av blodplättsaktivitet, nya kryokonserveringsmedel och frysningsprotokoll, lyofiliserade blodplättar och vesiklar baserade på trombocytmembran, röda blodkroppar med hemostatisk funktion och liposomer är inte en komplett lista över tillvägagångssätt som används för att uppnå detta mål. Några av dem - till exempel frystorkade blodplättar B1a$1x - befinner sig redan i aktiva kliniska prövningar.
Mysterier med blodplättar
Underpopulationer. Ett av blodplättarnas mest spännande mysterier är deras heterogenitet. När blodplättar aktiveras bildas 2 subpopulationer med dramatiskt olika egenskaper. Deras bildning styrs av ofullständigt studerade signalvägar. Intressant nog accelererar en av dessa subpopulationer koagulationsreaktioner, medan den andra är kapabel till normal aggregation (fig. 7). Denna separation av de två huvudfunktionerna hos trombocyter är spännande, men ingen förklaring har ännu erbjudits för det.
Ris. 7. Subpopulationer av blodplättar skiljer sig radikalt åt i deras förmåga att påskynda koagulations- och aggregationsreaktioner. Punktdiagram av en suspension av oaktiverade (vänster) och aktiverade (höger) blodplättar på en flödescytometer. X-axeln visar fluorescensen av annexin V, en markör för fosfatidylserin. Y-axeln visar fibrinogenfluorescens. Det kan ses att vid aktivering bildas 2 subpopulationer av blodplättar, varav den ena är storleksordningar högre än den andra vad gäller fosfatidylserinnivåer, men är lika sämre i fibrinogenbindning. Återges från
Stoppa tillväxten av en blodpropp. Ovan undersökte vi sekvensen av händelser som inträffar under tillväxten av en trombocyttrombus. Ett av de största problemen som fortfarande är olösta är frågan om att stoppa denna tillväxt: varför går det i vissa fall så långt som att kärlet täpps till fullständigt, medan kärlet i andra förblir fritt? Nu finns det ett dussintal hypoteser som förklarar blodproppens begränsade storlek. En av de mest aktivt diskuterade är antagandet att med periodisk förstörelse av den övre, instabila delen av tromben, exponeras fibrinet som bildas inuti. Ändå är denna fråga fortfarande långt ifrån löst. Med hög sannolikhet kan det finnas mer än en stoppmekanism, och för olika kärl kan dessa mekanismer vara olika.
Trombocyter och kontaktvägen. För ganska länge sedan visade forskare att blodplättar har potential att aktivera blodkoagulation genom kontaktvägen. Huvudkandidaterna för rollen som aktivatorer anses vara polyfosfater som frigörs från täta granuler vid aktivering, även om det finns motbevisningar av denna synvinkel. Det verkar som om genom denna aktivering är kontaktvägen för koagulationsaktivering viktig för trombocyttillväxt, vilket har visats i nyare arbete. Denna upptäckt gör att vi kan hoppas på skapandet av nya antitrombotiska läkemedel.
Mikrovesiklar. När de aktiveras frigör blodplättarna lipidmikropartiklar, även kallade mikrovesiklar. Receptorerna på deras yta är koncentrerade, och därför har dessa partiklar en enorm prokoagulerande aktivitet: deras yta är 50-100 gånger mer aktiv än ytan på aktiverade blodplättar. Varför blodplättar gör detta är oklart. Men i blodet hos även friska människor är antalet sådana vesiklar signifikant, och det ökar signifikant hos patienter med olika kardiovaskulära och hematologiska sjukdomar, vilket korrelerar med risken för trombos. Studerar dessa
vesiklar hämmas av sin lilla storlek (30-300 nm), mycket mindre än ljusets våglängd.
Blodplättar i onkologi. Blodplättar spelar en dubbel roll vid cancer. Å ena sidan ökar de risken och svårighetsgraden av venös trombos, karakteristisk för patienter med tumörer. Å andra sidan påverkar de direkt sjukdomsförloppet genom att reglera angiogenes, tumörtillväxt och metastaser genom ett antal mekanismer. Mekanismerna för interaktion mellan blodplättar och cancerceller är komplexa och dåligt förstådda, men deras exceptionella betydelse är nu utom tvivel.
Slutsats
Blodplättar är de viktigaste deltagarna i både normal hemostas och den patologiska trombotiska processen, vars tillstånd är avgörande för en mängd olika sjukdomar och tillstånd. För närvarande har betydande framsteg gjorts mot att förstå hur blodplättar fungerar och korrigera blodplättshemostas, men antalet vetenskapliga mysterier är fortfarande mycket stort: interaktionen mellan blodplättar och plasmahemostas, komplexiteten i signalering, mekanismer för att reglera tillväxt och stopp av trombocyttrombos. Nyligen har information dykt upp om interaktionen mellan blodplättar och andra kroppssystem, vilket indikerar deras viktiga roller i immunitet och morfogenes. De huvudsakliga praktiska svårigheterna är bristen på adekvata integrerade tester av trombocytfunktion och svårigheten att normalisera denna funktion.
Erkännanden
Författarnas arbete stöddes av ett anslag från den ryska stiftelsen för grundforskning 14-04-00670, såväl som av anslag från de grundläggande forskningsprogrammen vid den ryska vetenskapsakademin "Molecular and Cellular Biology" och " Grundforskning för utvecklingen av biomedicinsk teknik."
LITTERATUR
1. Sixma J.J., van den Berg A. Den hemostatiska pluggen vid hemofili A:
en morfologisk studie av hemostatisk proppbildning i hudsår vid blödningstid hos patienter med svår hemofili A. Br J Haematol 1984;58(4):741-53.
2. Maxwell M.J., Westein E., Nesbitt W.S.
et al. Identifiering av en 2-stegs trombocytaggregationsprocess som förmedlar skjuvberoende trombbildning. Blood 2007;109(2):566-76.
3. Mazurov A.V. Trombocyternas fysiologi och patologi. M.: GEOTAR-Media, 2011. 480 sid.
4. Michelson A.D. Blodplättar. 3:e upplagan, 2013. London; Waltham, MA: Academic Press, xliv, 1353 sid.
5. Ohlmann P., Eckly A., Freund M. et al. ADP inducerar partiell trombocytaggregation utan formförändring och potentierar kollageninducerad aggregation i frånvaro av Galphaq. Blood 2000;96(6):2134-9.
6. Vit J.G. Elektronmikroskopimetoder för att studera trombocytstruktur och funktion. Metoder Mol Biol 2004;272:47-63.
7.van Nispen tot Pannerden H., de Haas F., Geerts W. et al. Blodplättsinredningen återbesökt:
elektrontomografi avslöjar tubulära alfa-granula subtyper. Blood 2010;116(7):1147-56.
8. Blair P., Flaumenhaft R. Blodplätt alfa-granulat: grundläggande biologi och kliniska korrelat. Blood Rev 2009;23(4):177-89.
9. Abaeva A.A., Canault M., Kotova Y.N. et al. Prokoagulerande blodplättar bildar en alfa-granulproteintäckt "hatt" på sin yta som främjar deras vidhäftning
till aggregat. J Biol Chem 2013;288(41):29621-32.
10. Kaplan Z.S., Jackson S.P. Rollen
av blodplättar vid aterotrombos. Hematologi
Am Soc Hematol Educ Program 2011;2011:51-61.
11. Tanaka K.A., Key N.S., Levy J.H. Blodkoagulation: hemostas och trombinreglering. Anesth Analg 2009;108(5): 1433-46.
12. Panteleev M.A., Ananyeva N.M., Greco N.J. et al. Två delpopulationer
av trombinaktiverade blodplättar skiljer sig åt i deras bindning av komponenterna i det inre faktor X-aktiverande komplexet. J Thromb Haemost 2005;3(11):2545-53.
13. Topalov N.N., Kotova Y.N., Vasil"ev S.A., Panteleev M.A. Identifiering av signaltransduktionsvägar involverade i bildandet av trombocytsubpopulationer vid aktivering. Br J Haematol 2012;157(1):105-15.
14. Yakimenko A.O., Verholomova F.Y., Kotova Y.N. et al. Identifiering av olika proaggregatoriska förmågor hos aktiverade trombocytsubpopulationer. Biophys J 2012;102(10):2261-9.
15. Kotova Y.N., Ataullakhanov F.I., Panteleev M.A. Bildning av belagda blodplättar regleras av den täta granulutsöndringen av adenosin 5"-difosfat som verkar via P2Y12-receptorn. J Thromb Haemost 2008;6(9):1603-5.
16. Uijttewaal W.S., Nijhof E.J., Bronkhorst P.J. et al. Överskott av blodplättar nära väggen inducerat av lateral migration av erytrocyter i strömmande blod. Am J Physiol 1993;264(4 Pt 2):H1239-44.
17. Tokarev A.A., Butylin A.A., Ataullakhanov F.I. Trombocytvidhäftning från skjuvblodflöde kontrolleras av studsande kollisioner nära väggen med erytrocyter. Biophys J 2011;100(4):799-808.
18. Turitto V.T., Weiss H.J. Röda blodkroppar: deras dubbla roll i trombbildning. Science 1980;207(4430):541-3.
19. Nieswandt B., Brakebusch C., Bergmeieret W. et al. Glykoprotein VI men inte alfa2beta1-integrin är väsentligt för blodplättsinteraktion med kollagen. EMBO J 2001;20(9):2120-30.
20. Westein E., de Witt S., Lamers M. et al. Övervakning av trombbildning in vitro med nya mikrofluidiska enheter. Blodplättar 2012;23(7):501-9.
21. Favaloro E.J., Bonar R. Extern kvalitetsbedömning/kompetensprovning och intern kvalitetskontroll för PFA-100 och PFA-200: en uppdatering. Semin Thromb Hemost 2014;40(2):239-53.
22. Kristensen S.D., Würtz M., Grove E.L. et al., Samtida användning av glykoprotein IIb/IIIa-inhibitorer. Thromb Haemost 2012;107(2):215-24.
23. Ferri N., Corsini A.,
Bellosta S. Farmakologi av de nya P2Y12-receptorhämmarna: insikter om farmakokinetiska och farmakodynamiska egenskaper. Drugs 2013;73(15):1681-709.
24. Bode A.P., Fischer T.H. Lyofiliserade blodplättar: femtio år på väg. Artif Cells Blood Substit Immobil Biotechnol 2007;35(1):125-33.
25. Heemskerk J.W., Mattheij N.J., Cosemans J.M. Trombocytbaserad koagulation: olika populationer, olika funktioner.
J Thromb Haemost 2013;11(1):2-16.
26. Tosenberger A., Ataullakhanov F., Bessonov N. et al. Modellering av trombtillväxt i flöde med en DPD-PDE-metod. J Theor Biol 2013;337:30-41.
27. Bäck J., Sanchez J., Elgue G. et al. Aktiverade humana blodplättar inducerar faktor XIIa-medierad kontaktaktivering. Biochem Biophys Res Commun 2010;391(1):11-7.
28. Müller F., Mutch N.J., Schenk W.A. et al. Trombocytpolyfosfater är proinflammatoriska och prokoagulerande mediatorer in vivo. Cell 2009; 139(6):1143-56.
29. Faxälv L., Boknäs N., Ström J.O. et al. Att sätta polyfosfater på prov: bevis mot trombocytinducerad aktivering av faktor XII. Blood 2013;122(23):3818-24.
30. Hagedorn I., Schmidbauer S., Pleines I. et al. Faktor XIIa-hämmare rekombinant humant albumin Infestin-4 upphäver ocklusiv arteriell trombbildning utan att påverka blödningen. Upplaga 2010;121(13):1510-7.
31. Sinauridze E.I., Kireev D.A., Popenko N.Y. et al. Trombocytmikropartikelmembran har 50 till 100 gånger högre specifik prokoagulerande aktivitet än aktiverade blodplättar. Thromb Haemost 2007;97(3):425-34.
32. Hargett L.A., Bauer N.N. Om mikropartiklarnas ursprung: Från "trombocytdamm"
till förmedlare av intercellulär kommunikation. Pulm Circ 2013;3(2):329-40.
33. Riedl J., Pabinger I., Ay C. Blodplättar vid cancer och trombos. Hamostaseologie 2014;34(1):54-62.
34. Sharma D., Brummel-Ziedins K.E., Bouchard B.A., Holmes C.E. Blodplättar i tumörprogression: en värdfaktor som erbjuder flera potentiella mål vid behandling av cancer. J Cell Physiol 2014;229(8):1005-15.
- I kontakt med 0
- Google+ 0
- OK 0
- Facebook 0