Kuumutamisel reageerib väävel vesinikuga. Tekib terava lõhnaga mürgine gaas - vesiniksulfiid. Teisel viisil nimetatakse seda vesiniksulfiidiks, vesiniksulfiidiks, divesiniksulfiidiks.
Struktuur
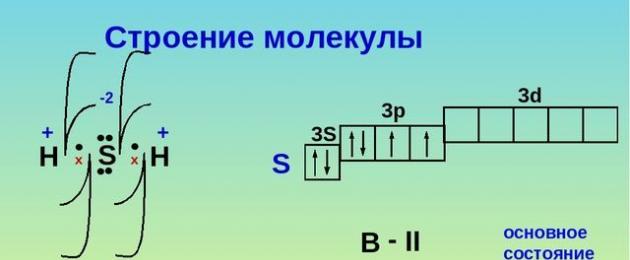
Vesiniksulfiid on väävli ja vesiniku kahekomponentne ühend. Vesiniksulfiidi valem on H 2 S. Molekuli ehitus sarnaneb veemolekuli ehitusega. Väävel ei moodusta aga vesinikuga mitte vesinikku, vaid kovalentset polaarset sidet. See on tingitud asjaolust, et erinevalt hapnikuaatomist on väävliaatom mahult suurem, sellel on väiksem elektronegatiivsus ja väiksem laengutihedus.

Riis. 1. Vesiniksulfiidi struktuur.
Kviitung
Vesiniksulfiidi leidub looduses harva. Väikestes kontsentratsioonides on see osa seotud looduslikest vulkaanilistest gaasidest. Mered ja ookeanid sisaldavad suurel sügavusel vesiniksulfiidi. Näiteks vesiniksulfiidi leidub Mustas meres 200 meetri sügavusel. Lisaks eraldub väävlit sisaldavate valkude lagunemisel vesiniksulfiid.
Tööstuses saadakse seda mitmel viisil:
- hapete reaktsioon sulfiididega:
FeS + 2HCl → FeCl2 + H2S;
- vee mõju alumiiniumsulfiidile:
Al2S3 + 6H20 → 2Al (OH)3 + 3H2S;
- väävli sulatamine parafiiniga:
C18H38 + 18S → 18H2S + 18C.
Puhtaim gaas saadakse vesiniku ja väävli otsesel interaktsioonil. Reaktsioon kulgeb temperatuuril 600 °C.
Füüsikalised omadused
Dihüdrosulfiid on mädamunalõhna ja magusa maitsega värvitu gaas. See on mürgine aine, suurtes kontsentratsioonides ohtlik. Oma molekulaarstruktuuri tõttu ei vedeldu vesiniksulfiid tavatingimustes.
Vesiniksulfiidi üldised füüsikalised omadused:
- vees halvasti lahustuv;
- avaldab ülijuhi omadusi temperatuuril -70°C ja rõhul 150 GPa;
- tuleohtlik;
- lahustub etanoolis;
- veeldub -60,3°C juures;
- muutub tahkeks aineks temperatuuril -85,6 °C;
- sulab temperatuuril -86 °C;
- keeb temperatuuril -60 ° C;
- laguneb 400°C juures lihtaineteks (väävel ja vesinik).
Tavatingimustes saate valmistada vesiniksulfiidi (vesiniksulfiidvesi) lahuse. Vesiniksulfiid aga ei reageeri veega. Õhus lahus oksüdeerub kiiresti ja muutub väävli eraldumise tõttu häguseks. Vesiniksulfiidveel on nõrgad happelised omadused.

Riis. 2. Vesiniksulfiidvesi.
Keemilised omadused
Vesiniksulfiid on võimas redutseerija. Aine peamised keemilised omadused on kirjeldatud tabelis.
|
Reaktsioon |
Kirjeldus |
Võrrand |
|
Hapnikuga |
Põleb õhus sinise leegiga, moodustades vääveldioksiidi. Hapnikupuuduse korral moodustub väävel ja vesi |
2H2S + 4O2 → 2H20 + 2SO2; 2H2S + O2 → 2S + 2H2O |
|
Oksüdeerijatega |
Oksüdeerub vääveldioksiidiks või väävliks |
3H2S + 4HClO3 → 3H2SO4 + 4HCl; 2H2S + SO2 → 2H20 + 3S; 2H2S + H2SO3 → 3S + 3H2O |
|
Leelistega |
Leelise liia korral moodustuvad keskmised soolad, suhtega 1: 1 - happelised |
H2S + 2NaOH → Na2S + 2H2O; H 2 S + NaOH → NaHS + H 2 O |
|
dissotsiatsioonid |
Dissotsieerub lahuses astmeliselt |
H 2 S ⇆ H + + HS – ; HS - ⇆ H + + S 2- |
|
kvaliteet |
Musta sademe moodustumine - pliisulfiid |
H 2 S + Pb(NO 3) 2 → PbS↓ + 2HNO 3 |

Riis. 3. Vesiniksulfiidi põletamine.
Vesiniksulfiid on mürgine gaas, mistõttu selle kasutamine on piiratud. Suurem osa toodetud vesiniksulfiidist kasutatakse tööstuslikus keemias väävli, sulfiidi, väävelhappe tootmiseks.
Mida me õppisime?
Tunni teemast saime teada vesiniksulfiidi ehk vesiniksulfiidi ehitusest, valmistamisest ja omadustest. See on värvitu ebameeldiva lõhnaga gaas. See on mürgine aine. Moodustab vesiniksulfiidvett, ilma veega suhtlemata. Reaktsioonides on sellel redutseerija omadused. Reageerib õhuhapnikuga, tugevate oksüdeerivate ainetega (oksiidid, hapnikhapped), leelistega. Dissotsieerub lahuses kahes etapis. Vesiniksulfiidi kasutatakse keemiatööstuses derivaatide valmistamiseks.
Teemaviktoriin
Aruande hindamine
Keskmine hinne: 4.4. Kokku saadud hinnanguid: 66.
- (vesiniksulfiid) H2S, mädamuna lõhnaga värvitu gaas; tsulama? 85,54 .С, keema? 60,35 .С; temperatuuril 0 .C see veeldub rõhul 1 MPa. Redutseeriv aine. Nafta rafineerimise, kivisöe koksimise jms kõrvalsaadus; lagunemisel tekkinud... Suur entsüklopeediline sõnaraamat
- (H2S), värvitu, mädamuna lõhnaga mürgine gaas. Tekib lagunemisprotsesside käigus, leidub toornaftas. Saadakse väävelhappe toimel metallide sulfiididele. Kasutatakse traditsioonilises KVALITATIIVSES ANALÜÜSIS. Omadused: temperatuur ...... Teaduslik ja tehniline entsüklopeediline sõnastik
Vesiniksulfiid, vesiniksulfiid, pl. ei, abikaasa. (keemia). Valguainete lagunemisel tekkiv gaas, mis eritab mädamunade lõhna. Ušakovi seletav sõnaraamat. D.N. Ušakov. 1935 1940 ... Ušakovi seletav sõnaraamat
Vesiniksulfiid, a, abikaasa. Terava ebameeldiva lõhnaga värvitu gaas, mis tuleneb valkude lagunemisest. | adj. vesiniksulfiid, oh, oh. Ožegovi selgitav sõnastik. S.I. Ožegov, N. Yu. Švedova. 1949 1992 ... Ožegovi selgitav sõnastik
Olemas., Sünonüümide arv: 1 gas (55) ASIS sünonüümide sõnastik. V.N. Trishin. 2013... Sünonüümide sõnastik
Värvitu ebameeldiva spetsiifilise lõhnaga mürgine gaas H2S. Omab kergelt happelisi omadusi. 1 liiter C. temperatuuril t 0 ° C ja rõhul 760 mm on 1,539 g. Seda leidub õlides, looduslikes vetes, biokeemilise päritoluga gaasides, nagu ... ... Geoloogiline entsüklopeedia
vesiniksulfiid- Vesiniksulfiid, H2S (molekulmass 34,07), värvitu gaas, millel on iseloomulik mädamuna lõhn. Liiter gaasi normaaltingimustes (0°, 760 mm) kaalub 1,5392 g Temperatuur, keemistemperatuur 62°, sulamistemperatuur 83°; S. on osa gaasilistest eritistest ...... Suur meditsiiniline entsüklopeedia
vesiniksulfiid- — Biotehnoloogia teemad ET vesiniksulfiid … Tehnilise tõlkija käsiraamat
vesiniksulfiid- VESINIK SULFIID, a, m Terava ebameeldiva lõhnaga värvitu gaas, mis moodustub valguliste ainete lagunemisel ja esindab väävli ja vesiniku kombinatsiooni. Vesiniksulfiidi leidub mõnes mineraalvees ja ravimudas ning seda kasutatakse ... ... Vene nimisõnade seletav sõnastik
Raamatud
- Kuidas suitsetamisest loobuda! (DVD), Pelinskiy Igor. "Pole midagi lihtsamat kui suitsetamisest loobumine – ma olen juba kolmkümmend korda maha jätnud" (Mark Twain). Miks inimesed suitsetama hakkavad? Lõõgastumiseks, lõõgastumiseks, mõtete kogumiseks, stressist vabanemiseks või…
- Vestimentifera - süvamere kõhuta selgrootud, V. V. Malakhov. Monograafia on pühendatud uuele rühmale hiiglaslikke (kuni 2,5 m) süvamereloomi, kes elavad süvamere hüdrotermilise aktiivsuse ja külma süsivesinike imbumise piirkondades. Enamik… elektrooniline raamat
- Praktiku mõtteid gaasitööstuse töötajate tervisest, IV Fomitšev. Svetlana Vladimirovna Fomitševa – Ph.D. kallis. Teadused, vanemteadur Venemaa Teaduste Akadeemia Uurali filiaali raku- ja intratsellulaarse sümbioosi instituut. Fomitšev Ilja Vladimirovitš – gastroenteroloog, meditsiiniosakonna juhataja…
MÄÄRATLUS
vesiniksulfiid See on värvitu gaas, millel on iseloomulik mädanenud valgu lõhn.
See on õhust veidi raskem, -60,3 o C juures veeldub ja -85,6 o C juures tahkub. Õhus põleb vesiniksulfiid sinaka leegiga, moodustades vääveldioksiidi ja vett:
2H2S + 3O2 \u003d 2H2O + 2SO2.
Kui vesiniksulfiidi leeki tuuakse mõni külm ese, näiteks portselantops, langeb leegi temperatuur oluliselt ja vesiniksulfiid oksüdeerub ainult vabaks väävliks, mis settib tassil kollase katte kujul:
2H 2S + O 2 \u003d 2H 2O + 2S.
Vesiniksulfiid on väga tuleohtlik; selle segu õhuga plahvatab. Vesiniksulfiid on väga mürgine. Seda gaasi sisaldava õhu pikaajaline ohkamine isegi väikestes kogustes põhjustab tõsist mürgistust.
Temperatuuril 20 °C lahustab üks osa vett 2,5 mahuosa vesiniksulfiidi. Vesiniksulfiidi lahust vees nimetatakse vesiniksulfiidveeks. Õhus seistes, eriti valguse käes, muutub vesiniksulfiidvesi eralduvast väävlist peagi häguseks. See tekib vesiniksulfiidi oksüdeerumise tagajärjel atmosfäärihapniku toimel.
Vesiniksulfiidi saamine
Kõrgel temperatuuril reageerib väävel vesinikuga, moodustades gaasilise vesiniksulfiidi.
Praktikas saadakse vesiniksulfiid tavaliselt lahjendatud hapete toimel väävelmetallidele, näiteks raudsulfiidile:
FeS + 2HCl \u003d FeCl 2 + H 2 S.
Puhtamat vesiniksulfiidi saab saada CaS, BaS või A12S3 hüdrolüüsil. Puhtaim gaas saadakse vesiniku ja väävli otsesel reaktsioonil temperatuuril 600 °C.
Vesiniksulfiidi keemilised omadused
Vesiniksulfiidi lahusel vees on happe omadused. Vesiniksulfiid on nõrk kahealuseline hape. See dissotsieerub etapiviisiliselt ja peamiselt esimeses etapis:
H 2 S↔H + + HS - (K 1 \u003d 6 × 10 -8).
Dissotsiatsioon teisel etapil
HS - ↔H + + S 2- (K 2 \u003d 10 -14)
tulu väga väikesel määral.
Vesiniksulfiid on tugev redutseerija. Tugevate oksüdeerivate ainete toimel oksüdeeritakse see vääveldioksiidiks või väävelhappeks; oksüdatsiooni sügavus oleneb tingimustest: temperatuur, lahuse pH, oksüdeeriva aine kontsentratsioon. Näiteks reaktsioon klooriga kulgeb tavaliselt väävelhappe moodustumiseni:
H2S + 4Cl2 + 4H2O \u003d H2SO4 + 8HCl.
Vesiniksulfiidi keskmisi sooli nimetatakse sulfiidideks.
Vesiniksulfiidi kasutamine
Vesiniksulfiidi kasutamine on üsna piiratud, mis on eelkõige tingitud selle kõrgest toksilisusest. See on leidnud rakendust laboripraktikas raskmetallide sadendajana. Vesiniksulfiid on väävelhappe, elementaarväävli ja sulfiidide tootmise tooraine
Näited probleemide lahendamisest
NÄIDE 1
| Harjutus | Määrake, mitu korda on õhust raskem vesiniksulfiid H 2 S. |
| Otsus | Teatud gaasi massi ja teise samas mahus, samal temperatuuril ja samal rõhul võetud gaasi massi suhet nimetatakse esimese gaasi suhteliseks tiheduseks teise suhtes. See väärtus näitab, mitu korda on esimene gaas teisest raskem või kergem. Õhu suhteline molekulmass on võrdne 29-ga (võttes arvesse lämmastiku, hapniku ja muude gaaside sisaldust õhus). Tuleb märkida, et mõistet "õhu suhteline molekulmass" kasutatakse tingimuslikult, kuna õhk on gaaside segu. D õhk (H 2 S) = M r (H 2 S) / M r (õhk); D õhk (H2S) = 34/29 = 1,17. M r (H 2 S) = 2 × A r (H) + A r (S) = 2 × 1 + 32 = 2 + 32 = 34. |
| Vastus | Vesiniksulfiid H 2 S on õhust 1,17 korda raskem. |
NÄIDE 2
| Harjutus | Leidke gaasisegu vesiniku tihedus, milles hapniku mahuosa on 20%, vesinikku 40% ja ülejäänu on vesiniksulfiid H 2 S. |
| Otsus | Gaaside mahuosad langevad kokku molaarfraktsioonidega, st. ainete koguste murdosadega on see Avogadro seaduse tagajärg. Leidke segu tingimuslik molekulmass: M r tingimuslik (segu) = φ (O 2) × M r (O 2) + φ (H 2) × M r (H 2) + φ (H 2 S) × M r (H 2 S); |
Vesiniksulfiid - H2S - värvitu gaas, millel on terav mädamunade lõhn. Vees halvasti lahustuv Mürgine. Vesiniksulfiidi molekulil on nurkne kuju. Molekul on polaarne. Tänu sellele, et vesiniksulfiid ei moodusta tugevaid vesiniksidemeid, on vesiniksulfiid tavatingimustes gaas Vesilahuses moodustab vesiniksulfiid nõrga vesiniksulfiidhappe.
Kviitung
Tugevate hapete poolt väljatõrjumine sooladest:
FeS + 2HCl = FeCl2 + H2S (Kippi aparaat)
Vesiniksulfiidi reaktsioonid: oksüdeeritakse õhuhapniku toimel väävliks või vääveldioksiidiks
2H2S + O2 = 2S(SO2) + 2H2O
Vesinikväävelhape - nõrk, kahealuseline
Vesinikväävelhape
Vesiniksulfiidhappe lahustumatud keskmised soolad (sulfiidid) saadakse väävli interaktsioonil metallidega või soolalahuste vahetusreaktsioonides:
Na2S + CuSO4 = CuS↓ + Na2SO4
K2S + FeCl2 = FeS↓ + 2KCl
Lahustuvad sulfiidid moodustuvad leelis- ja leelismuldmetallidest. Neid saab saada happelahuste koostoimel metallide või leelistega. Sel juhul võib olenevalt lähteainete molaarsuhtest moodustuda nii happelised (hüdrosulfiidid) kui ka keskmised soolad.
H2S + NaOH = NaHS + H2O (leelise puudumisega)
H2S + 2NaOH = Na2S + 2H2O (leelise liias)
Mõned sulfiidid (CuS, HgS, Ag2S, PbS) ei lagune tugevate hapete lahustes. Seetõttu võib vesiniksulfiidhape nende metallide moodustatud soolade vesilahustest tugevad happed välja tõrjuda:
CuSO4 + H2S = CuS↓ + H2SO4
HgCl2 + H2S = HgS↓ +2HCl
Vesinikväävelhape õhus oksüdeerub aeglaselt hapniku toimel väävli vabanemisega:
2H2S + O2 = 2S↓ + 2H2O
Seetõttu muutuvad H2S-lahendused ladustamise ajal aja jooksul häguseks.
Leelismuldmetallide sulfiidid vesilahuses hüdrolüüsitakse esimeses etapis peaaegu 100% ja esinevad lahustuvate happesoolade kujul:
2CaS + 2HOH = Ca(HS)2 + Ca(OH)2
Mõnede metallide (Al2S3, Fe2S3, Cr2S3) sulfiidid hüdrolüüsitakse H2O-s täielikult:
Al2S3 + 6 H2O = 2Al(OH)3 + 3 H2S
Enamik raskmetallide sulfiide lahustuvad vees väga halvasti.
50) Fosfor. Fosfori allotroopsed modifikatsioonid……
Fosfor on taimsete ja loomsete valkude lahutamatu osa. Taimedes on fosfor koondunud seemnetesse, loomadel - närvikoes, lihastes ja luustikus. Inimkeha sisaldab umbes 1,5 kg fosforit: 1,4 kg - luudes,
130 g - lihastes ja 13 g närvikoes. Looduses leidub fosforit seotud kujul.
Kõige olulisemad mineraalid:
apatiit Ca5(PO4)3F ja fosforiit Ca3(PO4)2.
Fosforit saab fosforiidi segu kuumutamisel,
kivisüsi ja liiv spetsiaalses ahjus:
Ca3(PO4)2 + 5C + 3SiO2 2P + 3CaSiO3 + 5CO
Fosfiin on mürgine küüslaugulõhnaline gaas, mida saab tsinkfosfiidist hapete või vee toimel:
Zn3P2 + 6HCl → 2PH3 + 3ZnCl2
Fosfiini peamised omadused on nõrgemad kui ammoniaagil:
PH3 + HCl → PH4Cl
Vesilahustes olevad fosfooniumisoolad on ebastabiilsed:
PH4 + H2O → PH3 + H3O
Fosfiinil on redutseeriv (fosfori madalaim oksüdatsiooniaste), põleb õhus:
2PH3 + 4O2 → P2O5 + 3H2O
Fosfiin on mädanenud kala lõhnaga värvitu mürgine gaas. Isesüttib õhu käes
2РН3 + 4О2 → P2O5 + 2Н2О
Vees vähelahustuv ja erinevalt NH3-st ei reageeri sellega.
Väga tugevate ja hapnikuvabade hapetega moodustab see sarnaselt ammoniaagiga fosfooniumsooli.
PH3 + HI= PH4I
fosfooniumjodiid
Difosfiin (analoogne hüdrasiiniga) (P2H4) - on vedelik,
isesüttiv õhu käes.
Saamine: Fosfaatkivimitest sulandamise teel süsiniku ja ränioksiidiga
Ca3(PO4)2 + C +SiO2 → P4 + CaSiO3 + CO
Ca fosfaadist, temperatuuril üle 1500°C: Ca3(PO4)2 + C → CaO + P4 + CO
Keemilised omadused: P + O2 = P2O3; P + O2 = P2O5; P + S = P2S3; P + Cl2 = PCl3; P + H2 ei lähe
Allotroopsed modifikatsioonid: Valge fosfor on tugev mürk, isegi väikestes annustes on see surmav. Tahkes olekus saadakse see fosfori aurude kiirel jahutamisel. Puhtal kujul on see täiesti värvitu, läbipaistev, välimuselt sarnaneb vahaga: külmas on see rabe, temperatuuril üle 15 ° C on see pehme, kergesti lõigatav noaga.
Punane fosfor on punakaspruun pulber, mittetoksiline, mittelenduv, vees ja paljudes orgaanilistes lahustites ja süsinikdisulfiidis lahustumatu; ei sütti õhu käes ega helenda pimedas. See süttib ainult siis, kui seda kuumutatakse temperatuurini 260 °C. Tugeva kuumutamisega, ilma juurdepääsuta õhule, sulamata (vedelast olekust mööda minnes) aurustub - sublimeerub. Jahtudes muutub see valgeks fosforiks.
Must fosfor saadakse valge fosfori tugeval kuumutamisel ja kõrgel rõhul. Must fosfor on teistest modifikatsioonidest raskem. Seda kasutatakse väga harva - pooljuhina galliumi ja indiumfosfaadi koostises metallurgias.
Reageerib hapetega P + HNO3 = HPO4 + NO + H2O; P + H2SO4 = H3PO4 + SO2 + H2O
Reageerib leelistega P + KOH + H2O = KH 2PO2 + PH3
MÄÄRATLUS
Vesinikväävelhape(vesiniksulfiid, monosulfaan) on tavatingimustes värvitu gaas.
Termiliselt ebastabiilne. Külmas vees halvasti lahustuv. Küllastunud lahust (0,1 M) nimetatakse "vesiniksulfiidveeks", mis õhuga kokkupuutel muutub häguseks. Näitab nõrku happelisi omadusi. OVR-is on see tugev redutseerija.
Vesiniksulfiidhappe keemiline valem
Vesiniksulfiidhappe keemiline valem on H 2 S. See näitab, et see molekul sisaldab kahte vesinikuaatomit (Ar = 1 amu) ja ühte väävliaatomit (Ar = 32 amu). Keemilise valemi järgi saate arvutada vesiniksulfiidhappe molekulmassi:
Mr(H2S) = 2 x Ar(H) + Ar(S);
Hr (H 2 S) \u003d 2 × 1 + 32 = 2 + 32 \u003d 34.
Vesiniksulfiidhappe graafiline (struktuurne) valem
Vesiniksulfiidhappe struktuurne (graafiline) valem on visuaalsem. See näitab, kuidas aatomid on molekulis üksteisega seotud (joonis 1).
Riis. 1. Vesiniksulfiidi molekuli struktuur, mis näitab sidemete vahelist sidenurka ja keemiliste sidemete pikkust.
Iooniline valem
Vesinikväävelhape on elektrolüüt, st. vesilahuses on see võimeline dissotsieeruma ioonideks vastavalt järgmisele võrrandile:
H 2S ↔ 2H + + S 2-.
Näited probleemide lahendamisest
NÄIDE 1
| Harjutus | Määrake 49,4% kaaliumi, 20,2% väävlit ja 30,4% hapnikku sisaldava ühendi molekulvalem, kui selle ühendi suhteline molekulmass on 3,95 korda suurem kaltsiumi suhtelisest aatommassist. |
| Otsus |
Tähistagem ühendit moodustavate elementide moolide arvu "x" (kaalium), "y" (väävel) ja "z" (hapnik). Seejärel näeb molaarsuhe välja selline (D.I. Mendelejevi perioodilisest tabelist võetud suhteliste aatommasside väärtused ümardatakse täisarvudeks): x:y:z = ω(K)/Ar(K): ω(S)/Ar(S): ω(O)/Ar(O); x:y:z = 49,4/39: 20,2/32: 30,4/16; x:y:z= 1,3: 0,63:1,9 = 2:1:3. See tähendab, et kaaliumi, väävli ja hapniku ühendi lihtsaim valem on kujul K 2 SO 3 ja molaarmass on 158 g / mol. Leidke selle ühendi tegelik molaarmass: M aine = Ar (Ca) × 3,95 = 40 × 3,95 \u003d 158 g / mol. Orgaanilise ühendi tõelise valemi leidmiseks leiame saadud molaarmasside suhte: M aine / M (K 2 SO 3) = 158 / 158 = 1. Seega on kaaliumi, väävli ja hapniku ühendi valem kujul K2SO3. |
| Vastus | K2SO3 |
NÄIDE 2
| Harjutus | Aine koostis sisaldab 32,5% naatriumi, 22,5% väävlit ja 45% hapnikku. Tuletage aine keemiline valem. |
| Otsus | Elemendi X massiosa HX-kompositsiooni molekulis arvutatakse järgmise valemiga: ω (X) = n × Ar (X) / M (HX) × 100%. Tähistagem ühendit moodustavate elementide moolide arvu "x" (naatrium), "y" (väävel) ja "z" (hapnik). Seejärel näeb molaarsuhe välja selline (D.I. Mendelejevi perioodilisest tabelist võetud suhteliste aatommasside väärtused ümardatakse täisarvudeks): x:y:z = ω(Na)/Ar(Na): ω(S)/Ar(S): ω(O)/Ar(O); x:y:z = 32,5/23: 22,5/32: 45/16; x:y:z = 1,4: 0,7: 2,8 = 2: 1: 4. Seega näeb naatriumi, väävli ja hapniku ühendi valem välja nagu Na 2 SO 4. See on naatriumsulfaat. |
| Vastus | Na2SO4 |
- Kokkupuutel 0
- Google Plus 0
- Okei 0
- Facebook 0