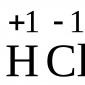Den vanligaste kunskapen handlar om tre aggregationstillstånd: flytande, fast, gasformig; ibland minns de plasma, mer sällan flytande kristallin. Nyligen En lista med 17 faser av materia, hämtad från den berömda () Stephen Fry, har cirkulerat på Internet. Därför kommer vi att berätta om dem mer i detalj, eftersom... du borde veta lite mer om materia, om så bara för att bättre förstå de processer som sker i universum.
Listan över aggregattillstånd av materia som ges nedan ökar från de kallaste tillstånden till de hetaste osv. kan fortsätta. Samtidigt bör det förstås att från det gasformiga tillståndet (nr 11), det mest "okomprimerade", till båda sidor av listan, graden av kompression av ämnet och dess tryck (med vissa reservationer för sådana ostuderade hypotetiska tillstånd som kvant, stråle eller svagt symmetriska) ökar Efter texten visas en visuell graf över fasövergångar av materia.
1. Kvantum- tillståndet för aggregation av ett ämne, som uppnås när temperaturen sjunker till absolut noll, som ett resultat av vilket de försvinner intern kommunikation och materia smulas sönder till fria kvarkar.
2. Bose-Einstein-kondensat- ett tillstånd av aggregation av materia, vars grund är bosoner, kylda till temperaturer nära absolut noll (mindre än en miljondels grad över absolut noll). I ett så väldigt svalt tillstånd räcker det stort antal atomer befinner sig i sina minsta möjliga kvanttillstånd och kvanteffekter börjar manifestera sig på makroskopisk nivå. Ett Bose-Einstein-kondensat (ofta kallat ett Bose-kondensat, eller helt enkelt "beck") uppstår när du kyler ett kemiskt element till extremt låga temperaturer (vanligtvis strax över absoluta nollpunkten, minus 273 grader Celsius). , är den teoretiska temperaturen vid vilken allting slutar röra sig).
Det är här det börjar hända helt konstiga saker med ämnet. Processer som vanligtvis bara observeras på atomnivå sker nu på skalor som är tillräckligt stora för att kunna observeras med blotta ögat. Till exempel, om du placerar "tillbaka" i en laboratoriebägare och ger önskad temperatur, kommer ämnet att börja krypa uppför väggen och så småningom komma ut av sig själv.
Tydligen har vi här att göra med ett meningslöst försök från ett ämne att sänka sin egen energi (som redan är på den lägsta av alla möjliga nivåer).
Att sakta ner atomer med hjälp av kylutrustning producerar ett singulärt kvanttillstånd som kallas ett Bose- eller Bose-Einstein-kondensat. Detta fenomen förutspåddes 1925 av A. Einstein, som ett resultat av en generalisering av S. Boses arbete, där statistisk mekanik byggdes för partiklar som sträckte sig från masslösa fotoner till massbärande atomer (Einsteins manuskript, som anses vara förlorat, upptäcktes i biblioteket vid Leiden University 2005). Resultatet av Bose och Einsteins ansträngningar var Bose-konceptet med en gas som är föremål för Bose–Einstein-statistik, som beskriver den statistiska fördelningen av identiska partiklar med heltalsspinn som kallas bosoner. Bosoner, som till exempel är individuella elementarpartiklar - fotoner och hela atomer, kan vara i samma kvanttillstånd med varandra. Einstein föreslog att kylning av bosonatomer till mycket låga temperaturer skulle få dem att omvandlas (eller, med andra ord, kondensera) till lägsta möjliga kvanttillstånd. Resultatet av sådan kondensering blir uppkomsten ny formämnen.
Denna övergång sker under den kritiska temperaturen, som är för en homogen tredimensionell gas bestående av icke-interagerande partiklar utan några inre frihetsgrader.
3. Fermionkondensat- ett tillstånd av aggregering av ett ämne, som liknar underlaget, men har olika struktur. När de närmar sig absolut noll, beter sig atomer olika beroende på storleken på deras eget rörelsemängd (spin). Bosoner har heltalsspinn, medan fermioner har snurr som är multiplar av 1/2 (1/2, 3/2, 5/2). Fermioner följer Paulis uteslutningsprincip, som säger att inga två fermioner kan ha samma kvanttillstånd. Det finns inget sådant förbud för bosoner, och därför har de möjlighet att existera i ett kvanttillstånd och därigenom bilda det så kallade Bose-Einstein-kondensatet. Processen för bildning av detta kondensat är ansvarig för övergången till det supraledande tillståndet.
Elektroner har spin 1/2 och klassas därför som fermioner. De kombineras till par (kallade Cooper-par), som sedan bildar ett Bose-kondensat.
Amerikanska forskare har försökt få fram ett slags molekyler från fermionatomer genom djupkylning. Skillnaden mot riktiga molekyler var att det inte fanns någon kemisk bindning– de flyttade precis ihop, på ett korrelerat sätt. Bindningen mellan atomer visade sig vara ännu starkare än mellan elektroner i Cooper-par. De resulterande paren av fermioner har en total spin som inte längre är en multipel av 1/2, därför beter de sig redan som bosoner och kan bilda ett Bose-kondensat med ett enda kvanttillstånd. Under experimentet kyldes en gas av kalium-40 atomer till 300 nanokelvin medan gasen inneslutes i en så kallad optisk fälla. Sedan applicerades ett externt magnetfält, med hjälp av vilket det var möjligt att ändra karaktären av interaktioner mellan atomer - istället för stark repulsion började en stark attraktion observeras. När man analyserade påverkan av magnetfältet var det möjligt att hitta ett värde vid vilket atomerna började bete sig som Cooper-elektronpar. I nästa steg av experimentet förväntar sig forskarna att få supraledningseffekter för fermionkondensatet.
4. Superflytande ämne- ett tillstånd där ett ämne praktiskt taget inte har någon viskositet och under flödet inte upplever friktion med en fast yta. Konsekvensen av detta är till exempel en så intressant effekt som att superfluid helium helt spontant "kryper ut" från kärlet längs dess väggar mot tyngdkraften. Naturligtvis finns det inget brott mot lagen om bevarande av energi här. I frånvaro av friktionskrafter påverkas helium endast av gravitationskrafter, krafterna för interatomisk interaktion mellan helium och kärlets väggar och mellan heliumatomer. Så krafterna för interatomisk interaktion överstiger alla andra krafter tillsammans. Som ett resultat tenderar helium att spridas så mycket som möjligt över alla möjliga ytor och därför "färdas" längs kärlets väggar. 1938 bevisade den sovjetiska forskaren Pyotr Kapitsa att helium kan existera i ett superfluid tillstånd.
Det är värt att notera att många av heliums ovanliga egenskaper har varit kända under ganska lång tid. Dock även i senaste åren detta kemiska element skämmer bort oss med intressanta och oväntade effekter. Sålunda, 2004, fascinerade Moses Chan och Eun-Syong Kim från University of Pennsylvania vetenskapliga världen tillkännagivande om att de hade lyckats få ett helt nytt tillstånd av helium - ett superfluid fast ämne. I detta tillstånd kan vissa heliumatomer i kristallgittret strömma runt andra, och helium kan därmed strömma genom sig själv. Effekten av "superhårdhet" förutspåddes teoretiskt redan 1969. Och sedan 2004 verkade det finnas experimentell bekräftelse. Senare och mycket intressanta experiment visade dock att allt inte är så enkelt, och kanske är denna tolkning av fenomenet, som tidigare accepterats som superfluiditeten av fast helium, felaktig.
Experimentet av forskare ledd av Humphrey Maris från Brown University i USA var enkelt och elegant. Forskare placerade ett uppochnervänt provrör i en stängd tank som innehöll flytande helium. De frös en del av heliumet i provröret och i reservoaren på ett sådant sätt att gränsen mellan vätska och fast inuti provröret var högre än i reservoaren. Med andra ord, i den övre delen av provröret fanns flytande helium, i den nedre delen fanns det fast helium, det passerade smidigt in i den fasta fasen av reservoaren, över vilken lite flytande helium hälldes - lägre än vätskan nivån i provröret. Om flytande helium började läcka genom fast helium, skulle skillnaden i nivåer minska, och då kan vi prata om fast superfluid helium. Och i princip, i tre av de 13 experimenten, minskade faktiskt skillnaden i nivåer.
5. Superhårt ämne- ett tillstånd av aggregation där materia är transparent och kan "flyta" som en vätska, men i själva verket saknar viskositet. Sådana vätskor har varit kända i många år, de kallas superfluids. Faktum är att om en supervätska rörs om kommer den att cirkulera nästan för evigt, medan en normal vätska så småningom kommer att lugna ner sig. De två första supervätskorna skapades av forskare som använde helium-4 och helium-3. De kyldes till nästan absolut noll - minus 273 grader Celsius. Och från helium-4 lyckades amerikanska forskare få en supersolid kropp. De komprimerade fruset helium med mer än 60 gånger trycket och placerade sedan glaset fyllt med ämnet på en roterande skiva. Vid en temperatur på 0,175 grader Celsius började skivan plötsligt snurra mer fritt, vilket forskare säger tyder på att helium har blivit en superkropp.
6. Fast- ett tillstånd av aggregering av ett ämne, kännetecknat av stabilitet i form och karaktär termisk rörelse atomer som utför små vibrationer runt jämviktspositioner. Stabilt läge fasta ämnenär kristallint. Det finns fasta ämnen med joniska, kovalenta, metalliska och andra typer av bindningar mellan atomer, vilket bestämmer mångfalden av deras fysikaliska egenskaper. Elektriska och vissa andra egenskaper hos fasta ämnen bestäms huvudsakligen av arten av rörelsen hos de yttre elektronerna i dess atomer. Baserat på deras elektriska egenskaper delas fasta ämnen in i dielektrikum, halvledare och metaller; baserat på deras magnetiska egenskaper delas fasta ämnen in i diamagnetiska, paramagnetiska och kroppar med en ordnad magnetisk struktur. Studier av fasta ämnens egenskaper har smält samman till ett stort fält - fasta tillståndets fysik, vars utveckling stimuleras av teknikens behov.
7. Amorft fast ämne- ett kondenserat tillstånd av aggregering av ett ämne, kännetecknat av isotropi av fysikaliska egenskaper på grund av det oordnade arrangemanget av atomer och molekyler. I amorfa fasta ämnen vibrerar atomer runt slumpmässigt placerade punkter. Till skillnad från det kristallina tillståndet sker övergången från fast amorft till flytande gradvis. Olika ämnen är i amorft tillstånd: glas, hartser, plaster etc.
8. Flytande kristallär ett specifikt aggregationstillstånd för ett ämne där det samtidigt uppvisar egenskaperna hos en kristall och en vätska. Det bör genast noteras att inte alla ämnen kan vara i flytande kristallint tillstånd. Dock några organiskt material Med komplexa molekyler kan de bilda ett specifikt aggregationstillstånd - flytande kristallin. Detta tillstånd uppstår när kristaller av vissa ämnen smälter. När de smälter bildas en flytande kristallin fas som skiljer sig från vanliga vätskor. Denna fas existerar i intervallet från kristallens smälttemperatur till någon högre temperatur, vid upphettning till vilken den flytande kristallen förvandlas till en vanlig vätska.
Hur skiljer sig en flytande kristall från en flytande och en vanlig kristall och hur liknar den dem? Liksom en vanlig vätska har en flytande kristall flytbarhet och tar formen av behållaren i vilken den placeras. Det är så det skiljer sig från de kristaller som alla känner till. Men trots denna egenskap, som förenar den med en vätska, har den en egenskap som är karakteristisk för kristaller. Detta är ordningen i rymden av molekylerna som bildar kristallen. Det är sant att denna ordning inte är lika komplett som i vanliga kristaller, men ändå påverkar den avsevärt egenskaperna hos flytande kristaller, vilket skiljer dem från vanliga vätskor. Ofullständig rumslig ordning av molekylerna som bildar en flytande kristall manifesteras i det faktum att det i flytande kristaller inte finns någon komplett beställning i det rumsliga arrangemanget av molekylernas tyngdpunkter, även om det kan finnas partiell ordning. Det betyder att de inte har ett styvt kristallgitter. Därför har flytande kristaller, liksom vanliga vätskor, egenskapen att flyta.
En obligatorisk egenskap hos flytande kristaller, som för dem närmare vanliga kristaller, är närvaron av en ordning av rumslig orientering av molekylerna. Denna orienteringsordning kan till exempel visa sig i det faktum att alla molekylernas långa axlar i ett flytande kristallint prov är orienterade på samma sätt. Dessa molekyler måste ha en långsträckt form. Förutom den enklaste namngivna ordningen av molekylära axlar, kan en mer komplex orienteringsordning av molekyler förekomma i en flytande kristall.
Beroende på typen av ordning av de molekylära axlarna delas flytande kristaller in i tre typer: nematiska, smektiska och kolesteriska.
Forskning om flytande kristallers fysik och deras tillämpningar bedrivs för närvarande på bred front i alla världens mest utvecklade länder. Den inhemska forskningen är koncentrerad till både akademiska och industriella forskningsinstitutioner och har en lång tradition. Verken av V.K., färdigställda på trettiotalet i Leningrad, blev allmänt kända och erkända. Fredericks till V.N. Tsvetkova. Under de senaste åren har den snabba studien av flytande kristaller sett att inhemska forskare också ger ett betydande bidrag till utvecklingen av studiet av flytande kristaller i allmänhet och, i synnerhet, optiken för flytande kristaller. Sålunda har verken av I.G. Chistyakova, A.P. Kapustina, S.A. Brazovsky, S.A. Pikina, L.M. Blinov och många andra sovjetiska forskare är allmänt kända för det vetenskapliga samfundet och fungerar som grunden för ett antal effektiva tekniska tillämpningar av flytande kristaller.
Förekomsten av flytande kristaller etablerades för länge sedan, nämligen 1888, det vill säga nästan ett sekel sedan. Även om forskare stötte på detta tillstånd före 1888, upptäcktes det officiellt senare.
Den första som upptäckte flytande kristaller var den österrikiske botanikern Reinitzer. När han studerade det nya ämnet kolesterylbensoat som han syntetiserade upptäckte han att vid en temperatur på 145°C smälter kristallerna av detta ämne och bildar en grumlig vätska som starkt sprider ljus. När uppvärmningen fortsätter, efter att ha uppnått en temperatur på 179°C, blir vätskan klar, d.v.s. den börjar bete sig optiskt som en vanlig vätska, till exempel vatten. Kolesterylbensoat visade oväntade egenskaper i den grumliga fasen. Genom att undersöka denna fas under ett polariserande mikroskop upptäckte Reinitzer att den uppvisar dubbelbrytning. Detta betyder att ljusets brytningsindex, det vill säga ljusets hastighet i denna fas, beror på polarisationen.
9. Vätska- tillståndet för aggregation av ett ämne, som kombinerar egenskaperna hos ett fast tillstånd (bevarande av volym, en viss draghållfasthet) och ett gasformigt tillstånd (formvariabilitet). Vätskor kännetecknas av kort räckvidd i arrangemanget av partiklar (molekyler, atomer) och en liten skillnad i rörelseenergi termisk rörelse hos molekyler och deras potentiella interaktionsenergi. Den termiska rörelsen hos vätskemolekyler består av svängningar runt jämviktspositioner och relativt sällsynta hopp från en jämviktsposition till en annan; vätskans flytbarhet är förknippad med detta.
10. Superkritisk vätska(SCF) är ett tillstånd av aggregering av ett ämne där skillnaden mellan vätske- och gasfasen försvinner. Varje ämne vid en temperatur och ett tryck över sin kritiska punkt är en superkritisk vätska. Egenskaperna hos ett ämne i superkritiskt tillstånd ligger mellan dess egenskaper i gas- och vätskefasen. Således har SCF en hög densitet, nära en vätska, och låg viskositet, som gaser. Diffusionskoefficienten har i detta fall ett värde mellan vätska och gas. Ämnen i superkritiskt tillstånd kan användas som substitut för organiska lösningsmedel i laboratorie- och industriprocesser. Superkritiskt vatten och superkritisk koldioxid har fått störst intresse och spridning på grund av vissa egenskaper.
En av de viktigaste egenskaperna hos det superkritiska tillståndet är förmågan att lösa upp ämnen. Genom att ändra temperaturen eller trycket på vätskan kan du ändra dess egenskaper över ett brett område. Således är det möjligt att erhålla en vätska vars egenskaper är nära antingen en vätska eller en gas. Således ökar upplösningsförmågan hos en vätska med ökande densitet (vid en konstant temperatur). Eftersom densiteten ökar med ökande tryck kan en förändring av trycket påverka vätskans upplösningsförmåga (vid konstant temperatur). När det gäller temperatur är beroendet av vätskans egenskaper något mer komplext - vid konstant densitet ökar också vätskans upplösningsförmåga, men nära den kritiska punkten kan en liten temperaturökning leda till ett kraftigt fall i densitet och följaktligen upplösningsförmågan. Superkritiska vätskor blandas med varandra utan begränsning, så när den kritiska punkten för blandningen nås kommer systemet alltid att vara enfas. Den ungefärliga kritiska temperaturen för en binär blandning kan beräknas som det aritmetiska medelvärdet av de kritiska parametrarna för ämnena Tc(mix) = (molfraktion A) x TcA + (molfraktion B) x TcB.
11. Gasformig- (franska gaz, från grekiska kaos - kaos), tillståndet för aggregering av ett ämne där den kinetiska energin för den termiska rörelsen av dess partiklar (molekyler, atomer, joner) avsevärt överstiger potentiell energi interaktioner mellan dem, på grund av vilka partiklarna rör sig fritt, och jämnt fyller hela volymen som tillhandahålls dem i frånvaro av yttre fält.
12. Plasma- (från grekiskans plasma - skulpterad, formad), ett materiatillstånd som är en joniserad gas där koncentrationerna av positiva och negativa laddningar är lika (kvasineutralitet). Den stora majoriteten av materia i universum är i plasmatillståndet: stjärnor, galaktiska nebulosor och det interstellära mediet. Nära jorden finns plasma i form av solvinden, magnetosfären och jonosfären. Högtemperaturplasma (T ~ 106 - 108K) från en blandning av deuterium och tritium studeras i syfte att implementera kontrollerad termonukleär fusion. Lågtemperaturplasma (T Ј 105K) används i olika gasurladdningsanordningar ( gaslasrar, jonanordningar, MHD-generatorer, plasmatroner, plasmamotorer, etc.), samt inom teknik (se Plasmametallurgi, Plasmaborrning, Plasmateknologi).
13. Degenererad materia— är ett mellanstadium mellan plasma och neutronium. Det observeras i vita dvärgar och lekar viktig roll i stjärnornas utveckling. När atomer utsätts för extremt höga temperaturer och tryck förlorar de sina elektroner (de blir elektrongas). Med andra ord är de helt joniserade (plasma). Trycket hos en sådan gas (plasma) bestäms av elektronernas tryck. Om densiteten är mycket hög tvingas alla partiklar närmare varandra. Elektroner kan existera i tillstånd med specifika energier, och inga två elektroner kan ha samma energi (om inte deras snurr är motsatta). I en tät gas är alltså alla lägre energinivåer fyllda med elektroner. En sådan gas kallas degenererad. I detta tillstånd uppvisar elektroner ett degenererat elektrontryck, vilket motverkar gravitationskrafterna.
14. Neutronium- ett aggregationstillstånd där materia passerar vid ultrahögt tryck, som fortfarande är ouppnåeligt i laboratoriet, men som finns inuti neutronstjärnor. Under övergången till neutrontillståndet interagerar ämnets elektroner med protoner och förvandlas till neutroner. Som ett resultat består materia i neutrontillståndet helt av neutroner och har en densitet i storleksordningen kärnkraft. Temperaturen på ämnet bör inte vara för hög (i energiekvivalent, inte mer än hundra MeV).
Med en kraftig temperaturökning (hundratals MeV och uppåt) börjar olika mesoner att födas och förintas i neutrontillståndet. Med en ytterligare ökning av temperaturen uppstår avgränsning, och ämnet övergår i tillståndet av kvark-gluonplasma. Den består inte längre av hadroner, utan av att ständigt födas och försvinna kvarkar och gluoner.
15. Quark-gluon plasma(kromoplasma) - ett tillstånd av aggregation av materia i högenergifysik och elementarpartikelfysik, där hadronisk materia övergår i ett tillstånd som liknar det tillstånd där elektroner och joner finns i vanlig plasma.
Typiskt är ämnet i hadroner i det så kallade färglösa (”vita”) tillståndet. Det vill säga kvarkar av olika färg tar ut varandra. Ett liknande tillstånd finns i vanlig materia - när alla atomer är elektriskt neutrala, dvs.
positiva laddningar de kompenseras av negativa. Vid höga temperaturer kan jonisering av atomer inträffa, under vilken laddningarna separeras, och ämnet blir, som de säger, "kvasineutralt". Det vill säga, hela materiamolnet som helhet förblir neutralt, men dess individuella partiklar upphör att vara neutrala. Samma sak kan tydligen hända med hadronisk materia - vid mycket höga energier frigörs färg och gör ämnet "kvasifärglöst".
Förmodligen var universums materia i ett tillstånd av kvarg-gluonplasma under de första ögonblicken efter Big Bang. Nu kan kvarg-gluonplasma bildas under en kort tid vid kollisioner av partiklar med mycket hög energi.
Quark-gluonplasma producerades experimentellt vid RHIC-acceleratorn vid Brookhaven National Laboratory 2005. Den maximala plasmatemperaturen på 4 biljoner grader Celsius erhölls där i februari 2010.
16. Konstig substans- ett aggregationstillstånd där materia komprimeras till maximala densitetsvärden; det kan existera i form av "kvarksoppa". Kubikcentimeterämnen i detta tillstånd kommer att väga miljarder ton; dessutom kommer den att omvandla alla normala ämnen som den kommer i kontakt med till samma "märkliga" form med frigörande av en betydande mängd energi.
Energin som kan frigöras när stjärnans kärna förvandlas till "konstig materia" kommer att leda till en superkraftig explosion av en "kvarknova" - och enligt Leahy och Uyed är det precis vad astronomer observerade i september 2006.
Processen för bildandet av detta ämne började med en vanlig supernova, till vilken en massiv stjärna vände. Som ett resultat av den första explosionen bildades en neutronstjärna. Men enligt Leahy och Uyed var den mycket kortlivad eftersom dess rotation verkade bromsas av sig själv magnetiskt fält, började den komprimeras ännu mer, med bildandet av en klump av "konstig materia", vilket ledde till en ännu kraftigare frigöring av energi än under en normal supernovaexplosion - och de yttre lagren av materia från den tidigare neutronstjärnan spreds in i det omgivande utrymmet med en hastighet nära ljusets hastighet.
17. Starkt symmetrisk substans- detta är ett ämne som är komprimerat till en sådan grad att mikropartiklarna inuti det läggs på varandra och kroppen själv kollapsar till ett svart hål. Termen "symmetri" förklaras på följande sätt: Låt oss ta de aggregerade materiantillstånden som är kända för alla från skolan - fast, flytande, gasformig. För visshetens skull, låt oss betrakta en ideal oändlig kristall som en fast substans. Det finns en viss, så kallad diskret symmetri med avseende på överföring. Det betyder att om du flyttar kristallgittret med ett avstånd som är lika med intervallet mellan två atomer kommer ingenting att förändras i det - kristallen kommer att sammanfalla med sig själv. Om kristallen smälts kommer symmetrin hos den resulterande vätskan att vara annorlunda: den kommer att öka. I en kristall, endast punkter som är avlägsna från varandra på vissa avstånd, var de så kallade noderna i kristallgittret, i vilka identiska atomer fanns, likvärdiga.
Vätskan är homogen genom hela sin volym, alla dess punkter går inte att skilja från varandra. Detta innebär att vätskor kan förskjutas med vilka som helst godtyckliga avstånd (och inte bara några diskreta sådana, som i en kristall) eller roteras av vilka som helst godtyckliga vinklar (vilket inte kan göras i kristaller alls) och det kommer att sammanfalla med sig själv. Dess grad av symmetri är högre. Gas är ännu mer symmetrisk: vätskan upptar en viss volym i kärlet och det finns en asymmetri inuti kärlet där det finns vätska och punkter där det inte är det. Gas upptar hela volymen som den tillhandahålls, och i denna mening är alla dess punkter omöjliga att skilja från varandra. Ändå skulle det här vara mer korrekt att inte tala om punkter, utan om små, men makroskopiska element, för på mikroskopisk nivå finns det fortfarande skillnader. Vid några punkter i det här ögonblicket tid det finns atomer eller molekyler, men andra gör det inte. Symmetri observeras endast i genomsnitt, antingen över vissa makroskopiska volymparametrar eller över tid.
Men det finns fortfarande ingen omedelbar symmetri på mikroskopisk nivå. Om ett ämne komprimeras mycket kraftigt, till tryck som är oacceptabla i vardagen, komprimeras så att atomerna krossas, deras skal tränger in i varandra och kärnorna börjar beröra, uppstår symmetri på mikroskopisk nivå. Alla kärnor är identiska och pressade mot varandra, det finns inte bara interatomära, utan även internukleära avstånd, och substansen blir homogen (konstig substans).
Men det finns också en submikroskopisk nivå. Kärnor är uppbyggda av protoner och neutroner som rör sig inuti kärnan. Det finns också lite utrymme mellan dem. Om du fortsätter att komprimera så att kärnorna krossas kommer nukleonerna att trycka hårt mot varandra. Då, på submikroskopisk nivå, kommer symmetri att uppstå, som inte finns ens inuti vanliga kärnor.
Av det sagda kan man urskilja en mycket bestämd trend: ju högre temperatur och ju högre tryck, desto mer symmetrisk blir ämnet. Baserat på dessa överväganden kallas ett ämne som komprimerats till dess maximalt mycket symmetriskt.
18. Svagt symmetrisk materia- ett tillstånd som är motsatt till starkt symmetrisk materia i dess egenskaper, närvarande i det mycket tidiga universum vid en temperatur nära Plancks, kanske 10-12 sekunder efter Big Bang, då de starka, svaga och elektromagnetiska krafterna representerade en enda superkraft. I detta tillstånd komprimeras ämnet i en sådan utsträckning att dess massa förvandlas till energi, som börjar blåsa upp, det vill säga expandera på obestämd tid. Det är ännu inte möjligt att uppnå energierna för att experimentellt erhålla superkraft och överföra materia till denna fas under jordiska förhållanden, även om sådana försök gjordes vid Large Hadron Collider för att studera det tidiga universum. På grund av frånvaron av gravitationsinteraktion i superkraften som bildar detta ämne, är superkraften inte tillräckligt symmetrisk i jämförelse med den supersymmetriska kraften som innehåller alla 4 typer av interaktioner. Därför fick detta aggregationstillstånd ett sådant namn.
19. Strålämne– detta är faktiskt inte längre materia alls, utan energi i sin rena form. Men det är just detta hypotetiska aggregationstillstånd som en kropp som har nått ljusets hastighet kommer att ta. Det kan också erhållas genom att värma upp kroppen till Planck-temperaturen (1032K), det vill säga accelerera ämnets molekyler till ljusets hastighet. Som följer av relativitetsteorin, när en hastighet når mer än 0,99 s, börjar kroppens massa att växa mycket snabbare än med "normal" acceleration; dessutom förlängs kroppen, värms upp, det vill säga den börjar att växa stråla i det infraröda spektrumet. När tröskeln på 0,999 s passerar förändras kroppen radikalt och börjar en snabb fasövergång upp till stråltillståndet. Som följer av Einsteins formel, taget i sin helhet, består den växande massan av det slutliga ämnet av massor separerade från kroppen i form av termisk, röntgenstrålning, optisk och annan strålning, vars energi beskrivs av nästa term i formeln. Således kommer en kropp som närmar sig ljusets hastighet att börja sända ut i alla spektra, växa i längd och sakta ner med tiden, tunnas ut till Plancklängden, det vill säga när den når hastighet c, kommer kroppen att förvandlas till en oändligt lång och tunn stråle, som rör sig med ljusets hastighet och består av fotoner som inte har någon längd, och dess oändliga massa kommer att omvandlas fullständigt till energi. Därför kallas ett sådant ämne stråle.
Presentation om ämnet "Alkoholer" i kemi i powerpoint-format. Presentationen för skolbarn innehåller 12 bilder, som ur kemisk synvinkel talar om alkoholer, deras fysikaliska egenskaper och reaktioner med vätehalogenider.
Fragment från presentationen
Från historien
Visste du det redan på 300-talet. före Kristus e. visste folk hur man gör drycker som innehåller etylalkohol? Vin framställdes genom jäsning av frukt- och bärjuice. Men de lärde sig att extrahera den berusande komponenten från den långt senare. På 1000-talet alkemister upptäckte ångor av ett flyktigt ämne som frigjordes när vin värmdes upp.
Fysikaliska egenskaper
- Lägre alkoholer är vätskor som är mycket lösliga i vatten, färglösa och luktfria.
- Högre alkoholer är fasta ämnen som är olösliga i vatten.
Funktion hos fysikaliska egenskaper: aggregeringstillstånd
- Metylalkohol (den första representanten homolog serie alkoholer) – flytande. Han kanske har en stor molekylär massa? Nej. Mycket mindre än koldioxid. Vad är det då?
- Det visar sig att hela poängen ligger i vätebindningarna som bildas mellan alkoholmolekyler och hindrar enskilda molekyler från att flyga iväg.
Funktion av fysikaliska egenskaper: löslighet i vatten
- Lägre alkoholer är lösliga i vatten, högre alkoholer är olösliga. Varför?
- Vätebindningar är för svaga för att hålla alkoholmolekylen, som har en stor olöslig del, mellan vattenmolekyler.
Funktion av fysiska egenskaper: sammandragning
- Varför använder människor aldrig volym, utan bara massa, när de löser beräkningsproblem?
- Blanda 500 ml alkohol och 500 ml vatten. Vi får 930 ml lösning. Vätebindningarna mellan alkohol- och vattenmolekylerna är så starka att lösningens totala volym minskar, dess "kompression" (från latinets contractio - kompression).
Är alkoholer syror?
- Alkoholer reagerar med alkaliska metaller. I detta fall ersätts väteatomen i hydroxylgruppen med en metall. Ser ut som syra.
- Men alkoholernas sura egenskaper är för svaga, så svaga att alkoholer inte påverkar indikatorer.
Vänskap med trafikpolisen.
- Är alkoholer vänliga med trafikpolisen? Men hur!
- Har du någonsin blivit stoppad av en trafikpolisinspektör? Har du någonsin andats in i ett rör?
- Om du har otur genomgår alkoholen en oxidationsreaktion, vilket gör att färgen ändras och du får betala böter.
Vi ger vatten 1
Avlägsnande av vatten - uttorkning kan vara intramolekylär om temperaturen är mer än 140 grader. I detta fall behövs en katalysator - koncentrerad svavelsyra.
Ge tillbaka vatten 2
Om temperaturen sänks och katalysatorn förblir densamma, kommer intermolekylär dehydrering att inträffa.
Reaktion med vätehalogenider.
Denna reaktion är reversibel och kräver en katalysator - koncentrerad svavelsyra.
Att vara vän eller inte vara vän med alkohol.
Intressant fråga. Alkohol är främlingsfientligt - ett ämne som inte finns i människokropp men påverkar hans liv. Allt beror på dosen.
- Alkoholär ett näringsämne som förser kroppen med energi. Under medeltiden fick kroppen cirka 25 % av sin energi genom alkoholkonsumtion.
- Alkohol är medicin, som har en desinficerande och antibakteriell effekt.
- Alkohol är ett gift som stör det naturliga biologiska processer, som förstör inre organ och psyket och, om det konsumeras överdrivet, leder till döden.
Frågor om hur aggregationstillståndet är, vilka egenskaper och egenskaper fasta ämnen, vätskor och gaser har, tas upp i flera träningskurser. Det finns tre klassiska materiatillstånd, med sina egna karakteristiska strukturella drag. Deras förståelse är en viktig punkt för att förstå jordens vetenskaper, levande organismer och industriella aktiviteter. Dessa frågor studeras av fysik, kemi, geografi, geologi, fysikalisk kemi och andra. vetenskapliga discipliner. Ämnen som under vissa förhållanden befinner sig i en av tre grundtyper av tillstånd kan förändras med en ökning eller minskning av temperatur och tryck. Låt oss överväga möjliga övergångar från ett tillstånd av aggregering till ett annat, eftersom de förekommer i naturen, tekniken och vardagen.
Vad är ett aggregationstillstånd?
Ordet av latinskt ursprung "aggrego" översatt till ryska betyder "att gå med". Den vetenskapliga termen syftar på tillståndet hos samma kropp, substans. Förekomsten av fasta ämnen, gaser och vätskor vid vissa temperaturer och olika tryck är karakteristisk för alla jordens skal. Utöver de tre grundläggande aggregeringstillstånden finns det också ett fjärde. Vid förhöjd temperatur och konstant tryck förvandlas gasen till plasma. För att bättre förstå vad ett aggregationstillstånd är, är det nödvändigt att komma ihåg de minsta partiklarna som utgör ämnen och kroppar.
Diagrammet ovan visar: a - gas; b—vätska; c är en solid kropp. I sådana bilder indikerar cirklar de strukturella elementen i ämnen. Detta är en symbol; i själva verket är atomer, molekyler och joner inte solida bollar. Atomer består av en positivt laddad kärna runt vilken negativt laddade elektroner rör sig med hög hastighet. Kunskap om materiens mikroskopiska struktur hjälper till att bättre förstå de skillnader som finns mellan olika aggregatformer.
Idéer om mikrokosmos: från antikens Grekland till 1600-talet
Den första informationen om partiklarna som utgör fysiska kroppar, dök upp i antikens Grekland. Tänkarna Demokrit och Epikuros introducerade ett sådant koncept som atomen. De trodde att dessa minsta odelbara partiklar av olika ämnen har en form, vissa storlekar och kan röra sig och interagera med varandra. Atomism blev den mest avancerade läran i det antika Grekland för sin tid. Men dess utveckling avtog under medeltiden. Sedan dess har vetenskapsmän förföljts av den romerska inkvisitionen Katolsk kyrka. Fram till modern tid fanns det därför ingen klar uppfattning om vad materiens tillstånd var. Först efter 1600-talet formulerade forskarna R. Boyle, M. Lomonosov, D. Dalton, A. Lavoisier bestämmelserna i den atommolekylära teorin, som inte har förlorat sin betydelse idag.
Atomer, molekyler, joner - mikroskopiska partiklar av materiens struktur
Ett betydande genombrott för att förstå mikrovärlden inträffade på 1900-talet, när elektronmikroskopet uppfanns. Med hänsyn till de upptäckter som tidigare gjorts av forskare, var det möjligt att sätta ihop en sammanhängande bild av mikrovärlden. Teorier som beskriver tillståndet och beteendet hos de minsta materiens partiklar är ganska komplexa; de relaterar till området För att förstå egenskaperna hos olika aggregattillstånd av materia räcker det att känna till namnen och egenskaperna hos de huvudsakliga strukturella partiklarna som bildas olika ämnen.
- Atomer är kemiskt odelbara partiklar. De bevaras i kemiska reaktioner, men förstörs i kärnreaktioner. Metaller och många andra ämnen med atomstruktur har ett fast aggregationstillstånd under normala förhållanden.
- Molekyler är partiklar som bryts ner och bildas i kemiska reaktioner. syre, vatten, koldioxid svavel. Det fysiska tillståndet för syre, kväve, svaveldioxid, kol, syre under normala förhållanden är gasformigt.
- Joner är de laddade partiklar som atomer och molekyler blir när de får eller förlorar elektroner - mikroskopiska negativt laddade partiklar. Många salter har en jonstruktur, till exempel bordssalt, järnsulfat och kopparsulfat.
Det finns ämnen vars partiklar finns i rymden på ett visst sätt. Den ordnade inbördes positionen för atomer, joner och molekyler kallas ett kristallgitter. Typiskt är joniska och atomära kristallgitter karakteristiska för fasta ämnen, molekylära - för vätskor och gaser. Diamant kännetecknas av sin höga hårdhet. Dess atomära kristallgitter bildas av kolatomer. Men mjuk grafit består också av atomer av detta kemiskt element. Bara de är placerade annorlunda i rymden. Det vanliga tillståndet för aggregation av svavel är fast, men vid höga temperaturer förvandlas ämnet till en vätska och en amorf massa.

Ämnen i fast aggregationstillstånd
Fasta ämnen behåller under normala förhållanden sin volym och form. Till exempel ett sandkorn, ett sockerkorn, salt, en stenbit eller metall. Om du värmer socker börjar ämnet smälta och förvandlas till en trögflytande brun vätska. Låt oss sluta värma så får vi en solid igen. Detta betyder att ett av huvudvillkoren för övergången av ett fast ämne till en vätska är dess uppvärmning eller en ökning av den inre energin hos ämnets partiklar. Det fasta tillståndet för aggregation av salt, som används för mat, kan också ändras. Men för att smälta bordssalt behövs en högre temperatur än vid uppvärmning av socker. Faktum är att socker består av molekyler, och bordssalt består av laddade joner som är starkare attraherade av varandra. Fasta ämnen i flytande form behåller inte sin form eftersom kristallgittren förstörs.
Det flytande aggregerade tillståndet för saltet vid smältning förklaras av brytningen av bindningar mellan jonerna i kristallerna. Laddade partiklar frigörs som kan bära elektriska laddningar. Smälta salter leder elektricitet och är ledare. I den kemiska, metallurgiska och verkstadsindustrin omvandlas fasta ämnen till vätskor för att få nya föreningar från dem eller för att ge dem olika former. Metallegeringar har blivit utbredda. Det finns flera sätt att få dem, förknippade med förändringar i tillståndet för aggregering av fasta råvaror.

Vätska är ett av de grundläggande aggregationstillstånden
Om du häller 50 ml vatten i en rundbottnad kolv kommer du att märka att ämnet omedelbart tar formen av ett kemikaliekärl. Men så fort vi häller vattnet ur kolven kommer vätskan omedelbart att spridas över bordets yta. Volymen vatten kommer att förbli densamma - 50 ml, men dess form kommer att förändras. De listade egenskaperna är karakteristiska för den flytande formen av existens av materia. Många organiska ämnen är vätskor: alkoholer, vegetabiliska oljor, syror.
Mjölk är en emulsion, det vill säga en vätska som innehåller fettdroppar. En användbar flytande resurs är olja. Det utvinns ur brunnar med hjälp av borriggar på land och i havet. Havsvatten är också en råvara för industrin. Dess skillnad från färskvatten floder och sjöar ligger i innehållet av lösta ämnen, främst salter. Vid avdunstning från ytan av reservoarer går bara H 2 O-molekyler över i ett ångtillstånd, lösta ämnen kvarstår. Metoder för att erhålla användbara ämnen från havsvatten och metoder för att rengöra den.
När salterna är helt avlägsnade erhålls destillerat vatten. Det kokar vid 100°C och fryser vid 0°C. Saltlaken kokar och förvandlas till is vid andra temperaturer. Till exempel fryser vatten i Ishavet vid en yttemperatur på 2 °C.
Det fysiska tillståndet för kvicksilver under normala förhållanden är flytande. Denna silvergrå metall används ofta för att fylla medicinska termometrar. Vid upphettning stiger kvicksilverkolonnen på skalan och ämnet expanderar. Varför används alkohol tonad med röd färg och inte kvicksilver? Detta förklaras av egenskaperna hos flytande metall. Vid 30-graders frost förändras kvicksilverets aggregationstillstånd, ämnet blir fast.
Om den medicinska termometern går sönder och kvicksilvret rinner ut, är det farligt att samla silverkulorna med händerna. Det är skadligt att andas in kvicksilverånga, detta ämne är mycket giftigt. I sådana fall måste barn vända sig till sina föräldrar och vuxna för att få hjälp.

Gasformigt tillstånd
Gaser kan inte behålla sin volym eller form. Fyll kolven till toppen med syre (dess kemisk formel O 2). Så fort vi öppnar kolven kommer ämnets molekyler att börja blandas med luften i rummet. Detta sker på grund av Brownsk rörelse. Till och med den antika grekiske vetenskapsmannen Demokritos trodde att partiklar av materia är i konstant rörelse. I fasta ämnen, under normala förhållanden, har atomer, molekyler och joner inte möjlighet att lämna kristallgittret eller frigöra sig från bindningar med andra partiklar. Detta är endast möjligt när en stor mängd energi tillförs utifrån.
I vätskor är avståndet mellan partiklar något större än i fasta ämnen, de kräver mindre energi att bryta intermolekylära bindningar. Till exempel observeras syrets flytande tillstånd endast när gastemperaturen sjunker till -183 °C. Vid -223 °C bildar O 2 -molekyler ett fast ämne. När temperaturen stiger över dessa värden förvandlas syre till gas. Det är i denna form som det finns under normala förhållanden. Industriföretag driver speciella installationer för att separera atmosfärisk luft och få kväve och syre från den. Först kyls och flytande luften, och sedan höjs temperaturen gradvis. Kväve och syre förvandlas till gaser under olika förhållanden.
Jordens atmosfär innehåller 21 volymprocent syre och 78 % kväve. Dessa ämnen finns inte i flytande form i planetens gashölje. Flytande syre är ljusblå till färgen och används för att fylla cylindrar vid högt tryck för användning i medicinska institutioner. Inom industri och byggnation behövs flytande gaser för att utföra många processer. Syre behövs för gassvetsning och skärning av metaller, och inom kemin för oxidationsreaktioner av oorganiska och organiska ämnen. Om du öppnar ventilen på en syrgasflaska minskar trycket och vätskan förvandlas till gas.
Flytande propan, metan och butan används i stor utsträckning inom energi, transport, industri och hushållsverksamhet. Dessa ämnen erhålls från naturgas eller under krackning (splittring) av petroleumråvara. Kolvätskor och gasblandningar spelar en viktig roll i många länders ekonomier. Men olje- och naturgasreserverna är kraftigt uttömda. Enligt forskare kommer denna råvara att hålla i 100-120 år. En alternativ energikälla är luftflöde (vind). Snabbströmmande floder och tidvatten vid stranden av hav och oceaner används för att driva kraftverk.

Syre, liksom andra gaser, kan vara i det fjärde tillståndet av aggregation, vilket representerar ett plasma. Ovanlig övergång från fast till gasformigt tillstånd - karakteristisk kristallint jod. Det mörklila ämnet genomgår sublimering - det förvandlas till en gas som kringgår det flytande tillståndet.
Hur görs övergångar från en aggregerad form av materia till en annan?
Förändringar i ämnens aggregerade tillstånd är inte förknippade med kemiska omvandlingar, det är dessa fysiska fenomen. När temperaturen ökar smälter många fasta ämnen och förvandlas till vätskor. En ytterligare ökning av temperaturen kan leda till avdunstning, det vill säga till ämnets gasformiga tillstånd. I naturen och ekonomin är sådana övergångar karakteristiska för ett av de viktigaste ämnena på jorden. Is, vätska, ånga är vattentillstånd under olika yttre förhållanden. Föreningen är densamma, dess formel är H 2 O. Vid en temperatur på 0 ° C och under detta värde kristalliseras vatten, det vill säga förvandlas till is. När temperaturen stiger förstörs de resulterande kristallerna - isen smälter och flytande vatten erhålls igen. När den värms upp bildas avdunstning - omvandlingen av vatten till gas - sker även kl låga temperaturer. Till exempel försvinner frusna pölar gradvis eftersom vattnet avdunstar. Även i frostigt väder torkar våt tvätt, men denna process tar längre tid än på en varm dag.
Alla de listade övergångarna av vatten från ett tillstånd till ett annat är av stor betydelse för jordens natur. Atmosfäriska fenomen, klimat och väder är förknippade med avdunstning av vatten från världshavets yta, överföring av fukt i form av moln och dimma till land och nederbörd (regn, snö, hagel). Dessa fenomen utgör grunden för världens vattenkretslopp i naturen.

Hur förändras svavelets aggregerade tillstånd?
Under normala förhållanden är svavel ljusa glänsande kristaller eller ljusgult pulver, dvs det är ett fast ämne. Det fysiska tillståndet för svavel förändras vid upphettning. Först, när temperaturen stiger till 190 °C, smälter det gula ämnet och förvandlas till en rörlig vätska.
Om du snabbt häller flytande svavel i kallt vatten får du en brun amorf massa. Med ytterligare uppvärmning av svavelsmältan blir den mer och mer trögflytande och mörknar. Vid temperaturer över 300 °C ändras svavelets aggregationstillstånd igen, ämnet får egenskaperna hos en vätska och blir rörligt. Dessa övergångar uppstår på grund av förmågan hos ett elements atomer att bilda kedjor av olika längd.
Varför kan ämnen vara i olika fysiska tillstånd?
Aggregeringstillståndet för svavel, ett enkelt ämne, är fast under vanliga förhållanden. Svaveldioxid är en gas, svavelsyra är en oljig vätska tyngre än vatten. Till skillnad från salt och salpetersyror det är inte flyktigt, molekyler avdunstar inte från dess yta. Vilket aggregationstillstånd har plastsvavel, som erhålls genom att värma upp kristaller?
I sin amorfa form har ämnet strukturen av en vätska, med obetydlig flytbarhet. Men plastsvavel behåller samtidigt sin form (som ett fast ämne). Det finns flytande kristaller som har ett antal karakteristiska egenskaper hos fasta ämnen. Ett ämnes tillstånd under olika förhållanden beror alltså på dess natur, temperatur, tryck och andra yttre förhållanden.

Vilka egenskaper finns i strukturen hos fasta ämnen?
De befintliga skillnaderna mellan materiens grundläggande aggregerade tillstånd förklaras av interaktionen mellan atomer, joner och molekyler. Varför leder till exempel materiens fasta tillstånd till kropparnas förmåga att behålla volym och form? I kristallgittret av en metall eller ett salt attraheras strukturella partiklar till varandra. I metaller interagerar positivt laddade joner med vad som kallas en "elektrongas", en samling fria elektroner i en metallbit. Saltkristaller uppstår på grund av attraktionen av motsatt laddade partiklar - joner. Avståndet mellan ovanstående strukturella enheter av fasta ämnen är mycket mindre än storleken på själva partiklarna. I det här fallet verkar elektrostatisk attraktion, den ger styrka, men avstötningen är inte tillräckligt stark.
För att förstöra det fasta tillståndet av aggregering av ett ämne måste ansträngning göras. Metaller, salter och atomära kristaller smälter vid mycket höga temperaturer. Till exempel blir järn flytande vid temperaturer över 1538 °C. Volfram är eldfast och används för att tillverka glödtrådar för glödlampor. Det finns legeringar som blir flytande vid temperaturer över 3000 °C. Många på jorden är i fast tillstånd. Dessa råvaror utvinns med hjälp av teknik i gruvor och stenbrott.

För att separera ens en jon från en kristall måste en stor mängd energi förbrukas. Men det räcker med att lösa salt i vatten för att kristallgittret ska sönderfalla! Detta fenomen förklaras av de fantastiska egenskaperna hos vatten som ett polärt lösningsmedel. H 2 O-molekyler interagerar med saltjoner och förstör den kemiska bindningen mellan dem. Upplösning är alltså inte en enkel blandning av olika ämnen, utan en fysikalisk-kemisk interaktion mellan dem.
Hur interagerar flytande molekyler?
Vatten kan vara en vätska, ett fast ämne och en gas (ånga). Dessa är dess grundläggande aggregeringstillstånd under normala förhållanden. Vattenmolekyler består av en syreatom till vilken två väteatomer är bundna. Polarisering av den kemiska bindningen i molekylen sker, och en partiell negativ laddning uppträder på syreatomerna. Väte blir den positiva polen i molekylen, attraherad av syreatomen i en annan molekyl. Detta kallas "vätebindning".
Det flytande tillståndet av aggregation kännetecknas av avstånd mellan strukturella partiklar jämförbara med deras storlekar. Attraktion finns, men den är svag, så vattnet behåller inte sin form. Förångning uppstår på grund av förstörelsen av bindningar som sker på ytan av vätskan även vid rumstemperatur.

Finns intermolekylära interaktioner i gaser?
Ett ämnes gasformiga tillstånd skiljer sig från flytande och fast i ett antal parametrar. Det finns stora luckor mellan de strukturella partiklarna i gaser, mycket större än molekylernas storlek. I det här fallet verkar inte attraktionskrafterna alls. Det gasformiga aggregationstillståndet är karakteristiskt för ämnen som finns i luften: kväve, syre, koldioxid. På bilden nedan är den första kuben fylld med gas, den andra med vätska och den tredje med fast substans.

Många vätskor är flyktiga, molekyler av ämnet bryter av från deras yta och går ut i luften. Om du till exempel tar med en bomullstuss doppad i ammoniak till öppningen på en öppen flaska med saltsyra, uppstår vit rök. En kemisk reaktion mellan saltsyra och ammoniak sker direkt i luften och producerar ammoniumklorid. I vilket tillstånd av aggregation befinner sig detta ämne? Dess partiklar som bildar vit rök är små fasta saltkristaller. Detta experiment måste utföras under huva, ämnena är giftiga.
Slutsats
Tillståndet för aggregation av gas studerades av många framstående fysiker och kemister: Avogadro, Boyle, Gay-Lussac, Clayperon, Mendeleev, Le Chatelier. Forskare har formulerat lagar som förklarar gasformiga ämnens beteende i kemiska reaktioner när yttre förhållanden förändras. Öppna mönster fanns inte bara med i skol- och universitetsläroböcker om fysik och kemi. Många kemiska industrier bygger på kunskap om ämnens beteende och egenskaper i olika aggregationstillstånd.
Föreläsning 4. Aggregat tillstånd av materia
1. Fast tillståndämnen.
2. Materias flytande tillstånd.
3. Materiens gasformiga tillstånd.
Ämnen kan vara i tre aggregationstillstånd: fast, flytande och gasformig. Vid mycket höga temperaturer uppstår en typ av gasformigt tillstånd - plasma (plasmatillstånd).
1. Materiens fasta tillstånd kännetecknas av att energin för interaktion mellan partiklar är högre än den kinetiska energin för deras rörelse. De flesta ämnen i fast tillstånd har en kristallin struktur. Varje ämne bildar kristaller av en viss form. Till exempel har natriumklorid kristaller i form av kuber, alun i form av oktaedrar och natriumnitrat i form av prismor.
Den kristallina formen av ämnet är den mest stabila. Arrangemanget av partiklar i ett fast ämne avbildas i form av ett gitter, vid vars noder det finns vissa partiklar förbundna med imaginära linjer. Det finns fyra huvudtyper av kristallgitter: atomära, molekylära, joniska och metalliska.
Atomkristallgitter bildas av neutrala atomer som är bundna kovalenta bindningar(diamant, grafit, kisel). Molekylärt kristallgitter har naftalen, sackaros, glukos. De strukturella elementen i detta gitter är polära och opolära molekyler. Jonisk kristallgitter bildas av positivt och negativt laddade joner (natriumklorid, kaliumklorid) som regelbundet alternerar i rymden. Alla metaller har ett metallkristallgitter. Dess noder innehåller positivt laddade joner, mellan vilka det finns elektroner i ett fritt tillstånd.
Kristallina ämnen har ett antal egenskaper. En av dem är anisotropi - olikheten mellan de fysiska egenskaperna hos en kristall i olika riktningar inuti kristallen.
2. I materiens flytande tillstånd är energin för intermolekylär interaktion mellan partiklar i proportion till den kinetiska energin för deras rörelse. Detta tillstånd är mellanliggande mellan gasformigt och kristallint. Till skillnad från gaser verkar stora krafter av ömsesidig attraktion mellan flytande molekyler, vilket bestämmer arten av molekylär rörelse. En vätskemolekyls termiska rörelse inkluderar vibrations- och translationsrörelse. Varje molekyl svänger runt en viss jämviktspunkt under en tid, för att sedan röra sig och återigen inta en jämviktsposition. Detta bestämmer dess flytbarhet. Krafterna av intermolekylär attraktion hindrar molekyler från att röra sig långt från varandra när de rör sig.
Vätskors egenskaper beror också på molekylernas volym och formen på deras yta. Om vätskans molekyler är polära, kombineras (associeras) de till ett komplext komplex. Sådana vätskor kallas associerade (vatten, aceton, alkohol). Οʜᴎ har högre t kip, har lägre volatilitet och högre dielektricitetskonstant.
Som ni vet har vätskor ytspänning. Ytspänning- ϶ᴛᴏ ytenergi per ytenhet: ϭ = E/S, där ϭ – ytspänning; E – ytenergi; S – yta. Ju starkare de intermolekylära bindningarna i en vätska, desto större är dess ytspänning. Ämnen som minskar ytspänningen kallas ytaktiva ämnen.
En annan egenskap hos vätskor är viskositet. Viskositet är det motstånd som uppstår när vissa lager av en vätska rör sig i förhållande till andra när den rör sig. Vissa vätskor har hög viskositet (honung, mala), medan andra har låg viskositet (vatten, etylalkohol).
3. I ett ämnes gasformiga tillstånd är energin för intermolekylär interaktion mellan partiklar mindre än deras kinetiska energi. Av denna anledning hålls inte gasmolekyler samman, utan rör sig fritt i volymen. Gaser kännetecknas av följande egenskaper: 1) likformig fördelning över hela volymen av kärlet i vilket de är belägna; 2) låg densitet jämfört med vätskor och fasta ämnen; 3) lätt kompressibilitet.
I en gas finns molekyler på mycket stort avstånd från varandra, attraktionskrafterna mellan dem är små. På stora avstånd mellan molekyler är dessa krafter praktiskt taget frånvarande. En gas i detta tillstånd brukar kallas ideal. Verkliga gaser vid höga tryck och låga temperaturer följer inte tillståndsekvationen idealisk gas(Mendeleev-Clapeyron-ekvationen), eftersom under dessa förhållanden börjar interaktionskrafter mellan molekyler uppstå.
- I kontakt med 0
- Google+ 0
- OK 0
- Facebook 0