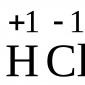1) reacción de biuret(para todas las proteínas)
Proteína + CuSO 4 + NaOH color púrpura brillante
CuSO 4 + 2NaOH Cu(OH) 2 + Na 2 SO 4
sedimento azul
C = O: Cu: O = C C = O: N
NHOHN:O=C
complejo soluble
morado brillante
2) Reacción de xantoproteína(para proteínas que contienen AA con un radical aromático)
proteína + HNO 3 (k) precipitado amarillo
| || -- H2O | ||
N CH C─ + HONO 2 N CH C─
|
color amarillo
Si agrega una solución concentrada de amoníaco, aparece un color naranja porque la densidad electrónica cambia en el nitrobenceno.
3) reacción de cisteína- reacción a un residuo de AK que contiene S
Proteína + NaOH + Pb(CH 3 COO) 2 PbS + proteína
De color negro
| Pb + PbS
BIOCATÁLISIS
Una de las características importantes de las reacciones químicas que ocurren en los organismos vivos es su naturaleza catalítica. Celula viva Puede considerarse como un reactor catalítico en miniatura. La diferencia entre una celda y un matraz de químico es que si en un matraz todas las reacciones se desarrollan de forma independiente (se implementa el principio fundamental de independencia de las reacciones), entonces en una celda todo sucede interconectado.
Esto no sucede porque se violen las leyes físicas o porque la célula obedezca otras leyes; no, sólo se aplican leyes en la materia viva. Simplemente, en el proceso de evolución, la naturaleza creó un aparato eficaz para regular todas las reacciones celulares, que permite a toda la célula controlar la proporción de productos de tal manera que todas las reacciones funcionen de manera óptima.
entonces todo es bio reacciones químicas- estas son reacciones catalítico.
Los catalizadores biológicos se llaman enzimas o enzimas.
En principio, en la celda tienen lugar las mismas reacciones químicas que en un laboratorio químico, pero se imponen restricciones estrictas a las condiciones para las reacciones en la celda, a saber, T = 37 ◦ C y P = 1 atm.
Por lo tanto, a menudo los procesos que ocurren en una etapa en el laboratorio se llevan a cabo en varias etapas en las células vivas.
La esencia de las reacciones catalíticas, a pesar de su diversidad, se reduce al hecho de que los materiales de partida se forman con el catalizador. conexión intermedia, que se convierte relativamente rápidamente en productos de reacción, regenerando el catalizador.
A veces los intermedios se pueden aislar en forma pura, pero normalmente consisten en moléculas inestables que sólo pueden detectarse mediante instrumentos espectrales muy sensibles.
El proceso que involucra un catalizador es cíclico o circular.

Una medida de la actividad enzimática - velocidad(número de moles de sustrato que sufren un cambio en 1 minuto por 1 mol de enzima)
El número de revoluciones puede llegar a 10 8.
Muy a menudo, los ciclos de varios catalizadores se combinan formando un proceso circular.

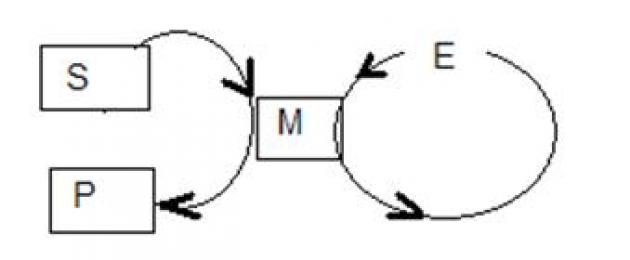
Las sustancias S1 y S2 se convierten en los productos P1 y P2. Durante esta transformación, el primer S1 reacciona con una tercera sustancia X y el catalizador E1, formando el producto intermedio M1, que a su vez es convertido por el catalizador E2 en el producto intermedio M2, etc.
El efecto acelerador de un catalizador está asociado con una disminución en la energía de activación (esta es la energía adicional que se debe impartir a un mol de una sustancia para que las partículas de la sustancia se vuelvan reactivas y puedan superar la barrera energética del reacción).
Las principales propiedades de las enzimas incluyen:
Eficiencia, que radica en el grado de aceleración (aceleración de 100 millones de veces).
Mayor especificidad del sustrato. Las enzimas distinguen el sustrato mediante reconocimiento biológico (complementariedad).
Mayor especificidad de la reacción catalizada. La mayoría de las enzimas aceleran un tipo de reacción.
Mayor especificidad para los isómeros ópticos (puede reconocer isómeros diestros y zurdos).
La razón de todas las propiedades únicas de las enzimas es su estructura espacial. Por lo general, se trata de proteínas globulares, mucho más grandes que el tamaño del sustrato. Esta circunstancia lleva al hecho de que en el proceso de evolución se formó un centro activo en la superficie de la enzima, que es complementario al sustrato. Esto es un candado y una llave.
Los centros condicionalmente activos se dividen en: vinculantes y catalíticos.
El centro de unión une el sustrato y lo orienta de manera óptima en relación con el grupo catalizado, mientras que todos los grupos activos se concentran en el centro catalítico.
Si para llevar a cabo una reacción es necesaria la hidrólisis (de proteínas, lípidos), entonces el centro catalizado está formado por radicales laterales de residuos de AA.
En este caso, la enzima consta únicamente de cadenas polipeptídicas. Sin embargo, además de las reacciones hidrolíticas, también ocurren otras: reacciones redox, reacciones de transferencia de cualquier grupo.
En estos casos, las enzimas contienen una parte no proteica. Esta parte es coenzima(factor r, grupo protésico). La parte proteica proporciona el efecto aglutinante y la coenzima proporciona el efecto catalítico. Parte proteica - apoenzima.
Apoenzima + coenzima ↔holoenzima
La importancia de las reacciones cromáticas es que permiten detectar la presencia de proteínas en fluidos y soluciones biológicos y establecer la composición de aminoácidos de diversas proteínas naturales. Estas reacciones se utilizan para la determinación tanto cualitativa como cuantitativa de proteínas y los aminoácidos que contienen. Algunas reacciones son inherentes no sólo a las proteínas, sino también a otras sustancias, por ejemplo, el fenol, como la tirosina, da un color rojo rosado con el reactivo de Millon, por lo que realizar una reacción no es suficiente para determinar la presencia de una proteína.
Hay dos tipos de reacciones de color: 1) universal: biuret (para todas las proteínas) y ninhidrina (para todas A-aminoácidos y proteínas); 2) específico: solo para ciertos aminoácidos tanto en la molécula de proteína como en soluciones de aminoácidos individuales, por ejemplo, la reacción de Foll (para aminoácidos que contienen azufre débilmente unido), la reacción de Millon (para tirosina), la reacción de Sakaguchi ( para arginina), etc.
Al realizar reacciones de color para proteínas y aminoácidos, primero se debe elaborar la siguiente tabla:
Reacciones de color a proteínas (reacciones cualitativas)
Reacciones de color a proteínas Experimento 1. Reacción de Biuret.
reacción de biuret– calidad para todo sin excepción ardillas, así como productos de su incompleto. hidrólisis, que contienen al menos dos enlaces peptídicos.
Principio del método. La reacción de biuret es causada por la presencia en proteínas. enlaces peptídicos(- CO – NH -), que en ambiente alcalino forman sales de cobre de color rojo violeta con sulfato de cobre (II) complejos. La reacción de biuret también la producen algunas sustancias no proteicas, por ejemplo biuret(NH 2 -CO-NH-CO-NH 2), oxamida(NH 2 CO-CO-NH 2), serie aminoácidos (histidina, serina, treonina, esparragina).
Reacción de biuret con glicina
El orden de trabajo.
Se añade un volumen igual de una solución al 10% a 1 ml de la solución de proteína al 1% de prueba. hidróxido de sodio(NaOH) álcali y luego 2-3 gotas de solución al 1% sulfato de cobre(CuSO4). Solución diluida, casi incolora, de sulfato de cobre.
Si la reacción es positiva, aparece un color violeta con un tinte rojo o azul.
Experiencia 2.Reaccióna "azufre débilmente unido".
Principio del método. Esta es una reacción a la cisteína y la cistina. Durante la hidrólisis alcalina, el "azufre débilmente unido" en la cisteína y la cistina se separa con bastante facilidad, lo que da como resultado la formación de sulfuro de hidrógeno que, al reaccionar con el álcali, produce sulfuros de sodio o potasio. Cuando se añade acetato de plomo (II), se forma un precipitado gris oscuro de sulfuro de plomo (II).
El orden de trabajo.
Se vierte 1 ml de proteína de pollo sin diluir en un tubo de ensayo y se añaden 2 ml de solución de hidróxido de sodio al 20%. La mezcla se hierve con cuidado (para evitar que se tire la mezcla).
En este caso, se libera amoníaco, que se detecta por el color azul del papel tornasol húmedo que se lleva a la abertura del tubo de ensayo (no toque la pared). El ligero precipitado que se forma se disuelve al hervir y luego se añaden 0,5 ml de solución de acetato de plomo (II). Se observa un precipitado gris negruzco de sulfuro de plomo (II):


Química de la reacción:

|
sedimento negro |
Se vierte 1 ml en un tubo de ensayo. agregue 2 ml de proteína de pollo sin diluir. Solución alcalina concentrada, poner varias calderas. Se agrega una solución de plumbita de sodio a la solución caliente; se forma un color amarillo-marrón o negro. (La plumbita de sodio se prepara de la siguiente manera: se agrega gota a gota una solución alcalina a 1 ml de acetato de plomo hasta que se disuelva el precipitado de hidróxido de plomo que inicialmente forma un precipitado).
Si una molécula de proteína contiene aminoácidos que contienen azufre (cistina, cisteína), el azufre se escinde gradualmente de estos aminoácidos en forma de un ion en estado de oxidación – 2, cuya presencia es detectada por el ion plomo, que forma negro. sulfuro de plomo insoluble con el ion azufre:
Pb(CH3COO)2 + 2NaOH Pb(OH)2 + 2 CH3COONa,
Pb(OH)2 + 2NaOH Na2PbO2 + H2O,
Na 2 S + Na 2 PbO 2 + 2H 2 O PbS + 4NaOH.
Experimento 3. Reacción xantoproteica de proteínas.
Principio del método. Esta reacción se utiliza para detectar a-aminoácidos que contienen radicales aromáticos. La tirosina, el triptófano y la fenilalanina, al interactuar con el ácido nítrico concentrado, forman derivados nitro que son de color amarillo. En un ambiente alcalino, los nitroderivados de estos a-aminoácidos dan sales de color naranja. La gelatina, por ejemplo, que no contiene aminoácidos aromáticos, no da una prueba de xantoproteína.
El orden de trabajo.
A 1 ml de una solución de clara de huevo de gallina al 10% se le añaden 0,5 ml de concentrado Ácido nítrico. Como resultado de la coagulación de proteínas, se forma un precipitado blanco o turbidez en el contenido del tubo de ensayo. Cuando se calienta, la solución y el precipitado se vuelven de color amarillo brillante. En este caso, el precipitado se disuelve casi por completo como resultado de la hidrólisis. Después de enfriar, agregue 1 a 2 ml de solución de hidróxido de sodio al 20% (hasta que la solución se vuelva naranja).
Consideremos el mecanismo de la reacción de las xantoproteínas en el radical tirosina:


química de reacción:

Diseño del experimento: sacar una conclusión y escribir la ecuación de reacción.
Experimento 4. Reacción de Adamkiewicz (ante la presencia de triptófano en proteínas).
Principio del método. Las proteínas que contienen triptófano dan un color rojo violeta en presencia de ácidos glioxílico y sulfúrico. La reacción se basa en la capacidad del triptófano para interactuar en un ambiente ácido con los aldehídos del ácido glioxílico (que es una impureza en el ácido acético concentrado) para formar productos de condensación coloreados. La reacción se desarrolla según la ecuación:

La gelatina no da esta reacción, es decir. no contiene triptófano. El color se produce debido a la reacción del triptófano con el ácido glioxílico, que siempre está presente en el ácido acético como impureza.
La misma reacción con triptófano se puede llevar a cabo utilizando formaldehído en lugar de ácido acético, una solución al 2,5% de H 2 SO 4 concentrado. Agite la solución y después de 2-3 minutos. agregue 10 gotas de nitrito de sodio al 5% mientras agita. Se desarrolla un color violeta intenso, esta es la base. principio del método reacciones.
El orden de trabajo.
Vierta unas gotas de proteína sin diluir en un tubo de ensayo y agregue 2 ml. Ácido acético glacial y unas gotas de ácido glioxílico. Se calienta ligeramente la mezcla hasta que se disuelve el precipitado formado, se enfría y, inclinando fuertemente el tubo de ensayo, se vierte con cuidado H 2 SO 4 concentrado a lo largo de la pared para que los dos líquidos no se mezclen.
Después de 5 a 10 minutos, se observa la formación de un anillo rojo violeta en la interfaz entre las dos capas.
Experimento 5. Reacción de ninhidrina.
Principio del método. Los a-aminoácidos reaccionan con la ninhidrina formando un complejo azul-violeta (púrpura de Ruemann), cuya intensidad de color es proporcional a la cantidad de aminoácido. La reacción se desarrolla según el siguiente esquema:

química de reacción :


La reacción con ninhidrina se utiliza para la detección visual de a-aminoácidos en cromatogramas (en papel, en una capa fina), así como para la determinación colorimétrica de la concentración de aminoácidos en función de la intensidad del color del producto de reacción.
El producto de esta reacción contiene el radical (R) del aminoácido original, lo que provoca diferentes colores: azul, rojo, etc. Compuestos que surgen de la reacción de aminoácidos con ninhidrina.
Actualmente, la reacción de la ninhidrina se utiliza ampliamente tanto para descubrir aminoácidos individuales como para determinar su cantidad.
El orden de trabajo.
En un tubo de ensayo se vierten 1 ml de una solución diluida al 1-10% de clara de huevo de gallina y 1-2 ml de una solución al 1% de ninhidrina en acetona. El contenido del tubo de ensayo se mezcla y se calienta cuidadosamente en un baño de agua durante 2-3 minutos hasta que aparece un color azul violeta, lo que indica la presencia de proteínas. α -aminoácidos.
Diseño del experimento: sacar una conclusión y escribir la ecuación de reacción.
Experimento 6. Reacción de Sakaguchi.
Principio del método. Esta reacción al aminoácido arginina se basa en la interacción de la arginina con el a-naftol en presencia de un agente oxidante. Su mecanismo aún no ha sido completamente dilucidado. Al parecer, la reacción se lleva a cabo según la siguiente ecuación:

Dado que los derivados de las quinonaiminas (en este caso, la naftoquinona), en los que el hidrógeno del grupo imino –NH– se sustituye por un radical alquilo o arilo, siempre tienen un color amarillo-rojo, entonces, aparentemente, el color rojo anaranjado de La solución durante la reacción de Sakaguchi se explica por la aparición del derivado de naftoquinona imina. Sin embargo, no se puede excluir la posibilidad de que se forme un compuesto aún más complejo debido a una mayor oxidación de los grupos NH restantes del residuo de arginina y del anillo de benceno del a-naftol:
El orden de trabajo.
A 2 ml. Agregue 2 ml de una solución de clara de huevo de gallina diluida al 1%. Hidróxido de sodio (NaOH) al 10% y unas gotas de solución de alcohol al 0,2% α -naftol. Se mezcla bien el contenido del tubo de ensayo. Luego agregue 0,5 ml. hipobromito de sodio (NaBrO) o hipoclorito de sodio (hipoclorito de sodio - NaOCl), mezclar. Inmediatamente aparece un color rojo que se intensifica gradualmente.
Agregue inmediatamente 1 ml de solución de urea al 40% para estabilizar el color rojo anaranjado que se desarrolla rápidamente.
Esta reacción es típica de compuestos que contienen un residuo de guanidina.
NH = C –NH 2 ,
e indica la presencia del aminoácido arginina en la molécula de proteína:
NH = C –NH – (CH 2) 3 –CH –COOH
Diseño del experimento: sacar una conclusión y escribir la ecuación de reacción.
proteínas a partir de las cuales... se construyen.
En la estructura de una proteína, hay... estructuras.
Funciones de las proteínas en el organismo...
Proteínas; Residuos de α-aminoácidos.
S, N, O, N, S.
Diez mil, millones.
Agua, soluciones de sales, ácidos; álcalis.
Tejidos de organismos vivos: piel, tendones, músculos, uñas, cabello.
Primaria, secundaria, terciaria, cuaternaria.
Construcción, catalítica, propulsión, transporte, protección, energía.
Criterios de evaluación:
"5" - todas las respuestas son correctas; "3" - 3 respuestas incorrectas;
"4" - 1-2 respuestas incorrectas; "2" - 4 o más respuestas incorrectas.
Resumen básico:
Las proteínas son compuestos naturales complejos de alto peso molecular formados a partir de residuos de aminoácidos α conectados por enlaces peptídicos (amida) - CO - NH -.
El número de residuos de aminoácidos incluidos en las moléculas de proteínas es diferente: insulina - 51, mioglobina - 140. Mr (proteína) = de 10.000 a varios millones.
Sr (clara de huevo) = 36.000; Mr (proteína muscular) = 1.500.000.
Hemoglobina (C738H1166O208N203S2Fe) 4.
Estructuras proteicas.
Primario- secuencia de alternancia de residuos de aminoácidos (todos los enlaces son covalentes, fuertes).
Secundario- la forma de la cadena polipeptídica en el espacio (normalmente en espiral). La cadena de proteínas está retorcida en espiral (debido a muchos enlaces de hidrógeno). Terciario- la configuración tridimensional real que toma una hélice retorcida en el espacio (debido a enlaces hidrofóbicos), algunas tienen enlaces S - S - (enlaces bisulfuro).
Cuaternario- macromoléculas de proteínas conectadas entre sí.
Propiedades químicas
1) hidrólisis(cuando se calienta con soluciones de ácidos, álcalis, bajo la acción de enzimas)
H2N ― CH2 ― C ―: N ― CH ― C ―: N ― CH ― C = O → H2N ― CH2 ― C = O +
H2O CH2 H2O CH2 OH OH
| | glicina
tripéptido
H2N – CH – C = O + H2N – CH – C = O
serina cisteína
La hidrólisis de proteínas se reduce a la hidrólisis de enlaces polipeptídicos. La digestión de las proteínas también se reduce a esto:
proteína ↔ aminoácidos → sangre en todas las células y tejidos del cuerpo.
2) desnaturalización - violación de los derechos naturales estructura proteica(bajo la influencia del calor y reactivos químicos)
3) anfotericidad:
Propiedades de los ácidos
|__________ propiedades de las bases
4) reacciones de color de proteínas- reacciones cualitativas
a) reacción de xantoproteína.
Proteína + HNO3 conc. → color amarillo
b) reacción de biuret.
Proteína + Cu (OH) 2 ↓ → solución violeta.
c) combustión- el olor a plumas quemadas.
Conclusión: las reacciones cualitativas de las proteínas son reacciones con ácido nítrico concentrado (color amarillo), con hidróxido de cobre (II) recién precipitado (solución violeta) y quema de proteínas (olor a plumas quemadas).
El papel de las proteínas en la célula.
1. Material de construcción: la formación de la capa, orgánulos y membranas de la célula. Se forman los vasos sanguíneos, los tendones y el cabello.
2. Función catalítica: todos los catalizadores celulares son proteínas.
3. Función motora: las proteínas contráctiles provocan cualquier movimiento.
4. Función de transporte: la proteína sanguínea hemoglobina transporta oxígeno y lo distribuye a todos los tejidos.
5. Función protectora: la producción de cuerpos proteicos de anticuerpos para neutralizar sustancias extrañas.
6. Papel energético: 1 g de proteína → 17,6 kJ.
Directrices para profesores
2. Las preguntas sobre química para prepararse para el seminario deben entregarse a los estudiantes a más tardar dos semanas antes de la lección.
4. El profesor de química motiva la lección, considera la composición y propiedades de las proteínas. Un profesor de biología generaliza y actualiza conocimientos sobre la estructura de las moléculas de proteínas, sus funciones y aplicaciones.
5. Al final de la lección, los profesores evalúan el trabajo de los estudiantes en esta lección. Equipo: películas de código, retroproyector, pantalla, retroproyector, diapositivas, productos químicos, mesa de demostración, mesas.
Plan de lección (escrito en la pizarra)
1. Composición y estructura de las proteínas.
2. Propiedades de las proteínas (desnaturalización, renaturalización, hidrólisis, reacciones de color).
3. Funciones de las proteínas y su síntesis en la célula.
4. Aplicación de proteínas, síntesis artificial de péptidos.
Profesor de química. Hoy impartimos una lección inusual: cubre los problemas de la química y la biología al mismo tiempo. El propósito de nuestra lección es sistematizar y profundizar conocimientos sobre el tema “Proteínas”. Prestamos especial atención al estudio de las proteínas, porque las proteínas son las principales parte integral de toda la vida en la Tierra. Recuerde la afirmación de F. Engels sobre lo que es la vida: “Dondequiera que encontramos vida, encontramos que está asociada con algún tipo de cuerpo proteico, y dondequiera que encontramos algún cuerpo proteico que no esté en proceso de descomposición, nosotros, sin excepción. , encontrar los fenómenos de la vida. La vida es una forma de existencia de cuerpos proteicos”. Ninguna sustancia realiza funciones tan específicas y diversas en el organismo como las proteínas.
Recordemos qué compuestos se llaman proteínas. ( Polímeros naturales cuyos monómeros son aminoácidos.)
¿El estudio de qué proceso ayudó a establecer la estructura de las proteínas? ( Estudio de la hidrólisis de proteínas.)
¿Qué proceso se llama hidrólisis?
¿Qué compuestos se forman durante la hidrólisis de las proteínas?
¿Qué compuestos se llaman aminoácidos?
¿Cuántos aminoácidos se conocen en la naturaleza?
¿Cuántos aminoácidos se encuentran en las proteínas?
Un profesor de química muestra una película de códigos.

Profesor de química. Preste atención a la posición del grupo amino en los aminoácidos. De acuerdo con la posición del grupo amino, los aminoácidos que forman las proteínas se denominan a-aminoácidos. La fórmula general de cualquiera de estos aminoácidos se puede escribir de la siguiente manera:
En la película del código se ven dos aminoácidos, uno de los cuales contiene dos grupos carboxilo (COOH) y el otro dos grupos amino (NH2). Estos ácidos se denominan ácidos aminodicarboxílicos o diaminocarboxílicos, respectivamente.
De tu curso de química sabes sobre los isómeros ópticos de compuestos naturales. Casi todas las proteínas contienen sólo L-aminoácidos.
Los aminoácidos son monómeros de proteínas. Pueden conectarse entre sí a través de un enlace amida (péptido), que se forma con la liberación de agua; esta es una reacción de condensación.
Creemos una ecuación para la reacción entre los aminoácidos glicina y alanina.
(Los estudiantes trabajan de forma independiente y luego comparan sus resultados con lo escrito en la pizarra o en la cinta.)
La estructura resultante se llama dipéptido. Un polímero de muchos aminoácidos se llama polipéptido.
Profesor de biologia. Sigamos estudiando las propiedades de las proteínas, pero primero responderemos las siguientes preguntas.
1. ¿Cómo podemos explicar la diversidad de proteínas que existe en la naturaleza? ( Diferencias en la composición de los aminoácidos y su diferente secuencia en la cadena polipeptídica.)
2. ¿Cuáles son los niveles de organización de una molécula de proteína? ( Primario – secuencia de aminoácidos; secundaria – a -espiral o b - estructura plegada de tramos de cadena; terciario: la estructura espacial de una proteína, formada debido a la interacción de residuos de aminoácidos de secciones remotas de la cadena: un glóbulo para proteínas globulares, una estructura filamentosa para proteínas fibrilares; cuaternario: la unión de dos o más moléculas de proteínas separadas.)
3. ¿Qué tipo de enlace se produce entre los aminoácidos en la estructura primaria? ¿Cuál es otro nombre para esta conexión? ( Enlace covalente. Enlace amida o peptídico.)
4. ¿Qué enlaces proporcionan principalmente la estructura secundaria de una molécula de proteína? ( Enlaces de hidrógeno, puentes disulfhidrilo..)
5. ¿Qué conexiones proporcionan la estructura terciaria? ( Enlaces de hidrógeno, interacciones hidrófobas e iónicas..)
6. ¿Qué enlaces proporcionan la estructura cuaternaria de una molécula de proteína? ( Interacciones electrostáticas, hidrofóbicas e iónicas..)
7. Da un ejemplo de una proteína que conozcas y que tenga una estructura cuaternaria. ( ATPasa, hemoglobina.)
Ahora resolvamos el siguiente problema ( el estado de la tarea se proyecta a través de un retroproyector, se muestra una diapositiva con frotis de sangre de una persona sana y un paciente con anemia falciforme).
La anemia falciforme se acompaña de la sustitución del residuo de aminoácido ácido glutámico en la cadena polipeptídica de la molécula de hemoglobina por un residuo de valina. Fragmento de la cadena de hemoglobina normal: – pegamento–pegamento–Liz–. Fragmento de una cadena de hemoglobina anormal: – eje–pegamento–Liz–
(pegamento- ácido glutamico; Liz– lisina; eje– valina). Dibuja estos fragmentos como fórmulas químicas.
Solución.
Fragmento de una cadena de hemoglobina normal:
Fragmento de una cadena de hemoglobina anormal:
Del ejemplo anterior se deduce que la estructura primaria de una molécula de proteína puede determinar todos sus niveles posteriores de organización. Los cambios en la organización estructural de una proteína pueden alterar sus funciones, lo que en algunos casos conduce al desarrollo de patología: enfermedad.
La estructura de una proteína determina sus propiedades fisicoquímicas, como la solubilidad.
Un profesor de química muestra una película de códigos.
Clasificación de proteínas según su solubilidad.

Profesor de química. Para mantener su actividad funcional, las proteínas deben tener una organización estructural natural (nativa) en todos los niveles.
Las alteraciones en la organización primaria, que conducen a la ruptura del enlace amida con la adición de una molécula de agua, se denominan hidrólisis de proteínas. Con una hidrólisis completa, la proteína se descompone en los aminoácidos que la constituyen.
Violación de secundaria y estructuras terciarias s proteína, es decir la pérdida de su estructura nativa se llama desnaturalización de proteínas.
La desnaturalización de las proteínas es causada por varios factores: cambios significativos de temperatura, aumento y disminución del pH del medio ambiente, exposición a iones de metales pesados, algunos compuestos químicos, por ejemplo, fenoles.
Un profesor de química demuestra experimentos.
Experiencia 1. Proteína + calor -->
Experiencia 2. Proteína + fenol --> desnaturalización (precipitación).
Experiencia 3. Proteína + Pb o CH 3 COOH --> desnaturalización (precipitación).
Experiencia 4. Proteína + CuSO4 --> desnaturalización (precipitación).
Profesor de biologia. La desnaturalización se produce como resultado de la destrucción del hidrógeno y el disulfuro. enlaces covalentes(pero no enlaces peptídicos, interacciones iónicas e hidrofóbicas), que aseguran la formación y mantenimiento de las estructuras secundarias y terciarias de la proteína. En este caso, la proteína pierde sus propiedades biológicas inherentes.
Las reacciones utilizadas para determinar la composición de una sustancia se denominan cualitativas.
¿Qué reacciones son cualitativas con las proteínas?
Un profesor de química demuestra los siguientes experimentos..
Experiencia 1. Reacción de xantoproteínas (nitración de anillos de benceno de aminoácidos aromáticos de proteínas):
proteína (enfriada) + HNO 3 (conc.) + calor --> color amarillo
Experiencia 2. Reacción de Biuret (le permite determinar la cantidad de enlaces peptídicos):
proteína + CuSO 4
+ NaOH --> color violeta (la urea da esta reacción);
CuSO 4
+ NaOH --> Cu(OH) 2
+Na 2
ENTONCES 4
;
proteína + Cu(OH) 2
--> coloración violeta.
¿Es posible reconocer glicerol, proteínas y glucosa usando un solo reactivo? ¡Poder! Este reactivo es hidróxido de cobre, da diferentes colores a las soluciones de estas sustancias:
a) glicerol + Cu(OH) 2
--> solución azul brillante;
b) glucosa + Cu(OH) 2
+ calentamiento --> precipitado rojo;
c) proteína + Cu(OH) 2
--> coloración violeta.
Profesor de biologia. Nombra las funciones de los polipéptidos que conoces. ( Construcción Los polipéptidos forman parte de las paredes celulares de hongos y microorganismos y participan en la construcción de membranas. El cabello, las uñas y las garras están hechos de proteína queratina. La proteína de colágeno es la base de tendones y ligamentos. Otra función importante de las proteínas es la enzimática, catalítica..
Las proteínas también proporcionan todo tipo de movilidad biológica. Además, las proteínas realizan funciones de transporte, hormonales o reguladoras, receptoras, hemostáticas, toxigénicas, protectoras y energéticas..)
Definir enzimas. ( Las enzimas son proteínas que tienen actividad catalítica, es decir. reacciones aceleradas.)
Todas las enzimas son muy específicas de su sustrato y, por regla general, catalizan sólo una reacción muy específica. Mire la representación esquemática de la estructura de una enzima. ( Un profesor de biología muestra una película codificada con una representación esquemática de una enzima.) Cada enzima tiene un sitio activo en el que se produce la transformación química del sustrato de reacción. A veces puede haber varios sitios de unión al sustrato. La estructura del sitio de unión es complementaria a la estructura del sustrato, es decir encajan "como una llave encaja en una cerradura".
El trabajo de las enzimas está influenciado por numerosos factores: pH, temperatura, composición iónica del medio, presencia de pequeños moléculas orgánicas, que se unen a la enzima o forman parte de su estructura y también se denominan cofactores (coenzimas). Algunas vitaminas, como la piridoxina (B 6
) y cobalamina (B 12
).
El profesor de biología presenta a los estudiantes aplicación práctica enzimas.
Importancia clínica de las enzimas.
1. Las enfermedades causadas por deficiencia de enzimas son ampliamente conocidas. Ejemplos: indigestibilidad de la leche (ausencia de enzima lactasa); hipovitaminosis (deficiencia de vitaminas): la falta de coenzimas reduce la actividad enzimática (la hipovitaminosis de vitamina B1 conduce a la enfermedad de beriberi); fenilcetonuria (causada por una violación de la conversión enzimática del aminoácido fenilalanina en tirosina).
2. La determinación de la actividad enzimática en fluidos biológicos ha gran importancia para diagnosticar enfermedades. Por ejemplo, la hepatitis viral está determinada por la actividad de las enzimas en el plasma sanguíneo.
3. Las enzimas se utilizan como reactivos en el diagnóstico de determinadas enfermedades.
4. Las enzimas se utilizan para tratar determinadas enfermedades. Ejemplos de algunos medicamentos a base de enzimas: pancreatina, festal, lidasa.
Uso de enzimas en la industria.
1. En la industria alimentaria, las enzimas se utilizan en la preparación de refrescos, quesos, conservas, embutidos y carnes ahumadas.
2. En la ganadería, las enzimas se utilizan en la preparación de piensos.
3. Las enzimas se utilizan en la producción de materiales fotográficos.
4. Las enzimas se utilizan en el procesamiento del lino y el cáñamo.
5. Las enzimas se utilizan para ablandar el cuero en la industria del cuero.
6. Las enzimas forman parte de los detergentes en polvo.
Profesor de biologia. Veamos otras funciones de las proteínas. Las funciones motoras las llevan a cabo proteínas contráctiles especiales, que incluyen, por ejemplo, actina y miosina, que forman parte de las fibras musculares.
Otra función importante de las proteínas es el transporte. Las proteínas, por ejemplo, transportan iones de potasio, aminoácidos, azúcares y otros compuestos a través de la membrana celular hacia el interior de la célula. Las proteínas también son portadoras intersticiales.
Al regular el metabolismo dentro de las células y entre las células y los tejidos de todo el cuerpo, las proteínas desempeñan una función hormonal o reguladora. Por ejemplo, la hormona insulina participa en la regulación del metabolismo de las proteínas y las grasas.
En la superficie de las membranas celulares hay receptores de proteínas que se unen selectivamente a hormonas y mediadores, realizando así una función receptora.
La función homeostática de las proteínas es formar un coágulo al detener el sangrado.
Algunas proteínas y péptidos liberados por organismos, como patógenos o algunos animales venenosos, son tóxicos para otros organismos vivos; ésta es la función toxicogénica de las proteínas.
La función protectora de las proteínas es muy importante. Los anticuerpos son proteínas producidas por el sistema inmunológico del cuerpo cuando es invadido por una proteína, bacteria o virus extraño. Identifican al “extraño” y participan en su destrucción.
Entre las proteínas que sirven como reserva energética se encuentra, por ejemplo, la caseína, la principal proteína de la leche.
Responde las siguientes preguntas.
2. ¿Qué causa el rechazo de órganos y tejidos trasplantados en los pacientes? ( Los anticuerpos, que desempeñan una función protectora, reconocen la proteína extraña de los órganos trasplantados y provocan reacciones de rechazo.)
3. ¿Por qué los huevos duros nunca producen gallina? ( Las claras de huevo han perdido irreversiblemente su estructura nativa debido a la desnaturalización por calor.)
4. ¿Por qué disminuye el peso de la carne y el pescado después de la cocción? ( Durante el tratamiento térmico, se produce la desnaturalización de las proteínas de la carne o el pescado. Las proteínas se vuelven prácticamente insolubles en agua y ceden una parte importante del agua que contienen, mientras que el peso de la carne disminuye entre un 20% y un 40%..)
5. ¿Qué indica la formación de “escamas” o turbidez del caldo al cocinar carne? ( Si la carne se sumerge en agua fría y se calienta, las proteínas solubles de las capas externas de la carne se transfieren al agua. Durante la cocción, se desnaturalizan, lo que da como resultado la formación de escamas, espuma que flota en la superficie del agua o una fina suspensión que enturbia la solución..)
Todas las moléculas de proteínas tienen una vida útil finita: se descomponen con el tiempo. Por tanto, las proteínas se renuevan constantemente en el organismo. En este sentido, recordemos los conceptos básicos de la biosíntesis de proteínas. Responde las siguientes preguntas.
1. ¿Dónde ocurre la síntesis de proteínas en la célula? ( En ribosomas.)
2. ¿En qué orgánulo celular Se almacena información sobre la estructura primaria de la proteína. ( En los cromosomas, el portador de información es el ADN..)
3. ¿Qué se entiende por el término “gen”? ( Secuencia de nucleótidos que codifica la síntesis de una proteína..)
4. ¿Cómo se llaman las principales etapas de la biosíntesis de proteínas? ( Transcripción, difusión.)
5. ¿En qué consiste la transcripción? ( Se trata de leer información del ADN mediante la síntesis de ARN mensajero que es complementario a la región del ADN que se está leyendo..)
6. ¿En qué parte de la célula se produce la transcripción? ( en el nucleo.)
7. ¿En qué consiste la retransmisión? ( Se trata de la síntesis de proteínas a partir de aminoácidos en la secuencia registrada en el ARNm; Ocurre con la participación de ARNt de transporte que entregan los aminoácidos correspondientes al ribosoma..)
8. ¿En qué parte de la célula se produce la traducción? ( En el citosol, en los ribosomas, en las mitocondrias..)
La biosíntesis de proteínas ocurre en el cuerpo durante toda la vida, con mayor intensidad durante la infancia. En algunos casos se puede ajustar la intensidad de la síntesis de proteínas. La acción de muchos antibióticos se basa en la supresión de la síntesis de proteínas, incluso en las bacterias que causan la enfermedad. Por ejemplo, el antibiótico tetraciclina impide que el ARNt se una a los ribosomas.
Vamos a escuchar mensajes cortos sobre preparaciones proteicas utilizadas en la medicina moderna.
Antihistamínicos
El agitado ritmo de vida moderno va acompañado de un aumento en el número de enfermedades, como ataques cardíacos, hipertensión, obesidad y todo tipo de alergias. La alergia es la sensibilidad excesiva del cuerpo a irritantes externos específicos. Todas estas enfermedades se caracterizan por niveles elevados de histamina en la sangre. Las histaminas son sustancias formadas por descarboxilación del aminoácido histidina. Los antihistamínicos interfieren con esta reacción y los niveles de histamina disminuyen.
Interferón
En el proceso de evolución, en la lucha contra los virus, los animales han desarrollado un mecanismo para la síntesis de la proteína protectora interferón. El programa para la formación de interferón, como cualquier proteína, está codificado en el ADN del núcleo celular y se activa después de que las células se infectan con un virus. El enfriamiento, el shock nervioso y la falta de vitaminas en los alimentos provocan una disminución de la capacidad de producir interferón. Actualmente, la preparación de interferón para fines médicos se elabora a partir de leucocitos de sangre de donantes o utilizando Ingeniería genética. El interferón se utiliza para prevenir y tratar infecciones virales: influenza, herpes y neoplasias malignas.
Insulina
La insulina es una proteína que consta de 51 aminoácidos. Se libera en respuesta al aumento de los niveles de glucosa en sangre. La insulina controla el metabolismo de los carbohidratos y provoca los siguientes efectos:
– aumentar la tasa de conversión de glucosa en glucógeno;
– aceleración de la transferencia de glucosa a través de las membranas celulares de los músculos y el tejido adiposo;
– aumento de la síntesis de proteínas y lípidos;
– aumento de velocidad síntesis de ATP, ADN y ARN.
La insulina es necesaria para la vida, porque es la única hormona que reduce la concentración de glucosa en la sangre. La secreción insuficiente de insulina conduce a un trastorno metabólico conocido como diabetes mellitus. Los preparados de insulina se obtienen del páncreas del ganado o mediante ingeniería genética.
Profesor de química. La insulina fue la primera proteína cuya estructura primaria fue descifrada. Fueron necesarios casi 10 años para establecer la secuencia de aminoácidos de la insulina. Actualmente se ha descifrado la estructura primaria de un gran número de proteínas, incluidas aquellas de estructura mucho más compleja.
La síntesis de sustancias proteicas se llevó a cabo por primera vez utilizando el ejemplo de dos hormonas hipofisarias (vasopresina y oxitocina).
Finalmente, los profesores califican a los estudiantes por su trabajo en las clases de química y biología.
Trabajo de laboratorio 15 “Ardillas”
Aminoácidos se llaman nitrógeno compuestos orgánicos, cuyas moléculas contienen grupos amino y grupos carboxilo.
Dependiendo de la posición relativa de los grupos carboxilo y amino, se distinguen -, b-, g-, etc. aminoácidos. Por ejemplo,
Muy a menudo, el término "aminoácido" se utiliza para referirse a ácidos carboxílicos cuyo grupo amino está en la posición -, es decir para - aminoácidos. Formula general- Los aminoácidos se pueden representar de la siguiente manera:
Dependiendo de la naturaleza del radical (R), los aminoácidos se dividen en alifáticos, aromáticos y heterocíclicos.
Los aminoácidos reaccionan entre sí mediante una reacción de policondensación, dando lugar a amidas ácidas. Los productos de dicha condensación se denominan péptidos. Cuando dos aminoácidos interactúan, se forma un dipéptido:
El grupo emergente -CO-NH- llamado enlace peptídico.
Cuando un dipéptido interactúa con una nueva molécula de aminoácido, se obtiene un tripéptido, etc.
Ejemplos de los aminoácidos más simples.
Ardillas - estos son los que contienen nitrógeno Sustancias orgánicas de alto peso molecular con una composición y estructura molecular complejas. Son polímeros naturales (polipéptidos complejos), cuyas moléculas se construyen a partir de residuos de aminoácidos conectados entre sí por un enlace amida (péptido).
Son polipéptidos naturales con valores altos peso molecular (de 5-10 mil a 1 millón o más). Forman parte de las células y tejidos de todos los organismos vivos y son el componente principal de nuestra alimentación.
Las proteínas contienen carbono, hidrógeno, oxígeno y nitrógeno. En cantidades mucho menores, su composición también puede incluir azufre, fósforo y otros elementos. Las proteínas son compuestos muy inestables, lo que dificulta el estudio de sus propiedades físicas y propiedades químicas. Productos finales la degradación de proteínas son
b-aminoácidos. Masa molecular hay muchísimos de ellos.
Todos los procesos de la vida están asociados con proteínas. Sirven como nutrientes, regulan el metabolismo, desempeñan el papel de enzimas: catalizadores metabólicos, promueven la transferencia de oxígeno por todo el cuerpo y su absorción, desempeñan papel importante en funcionamiento sistema nervioso, son la base mecánica de la contracción muscular, participan en la transmisión Información genética etc.
Experimento 1. Coagulación de proteínas cuando se calienta.
Plegamiento de proteínas, es decir desnaturalización - El proceso por el cual una proteína pierde su conformación natural (nativa), generalmente acompañado por la pérdida de su función biológica. Durante la desnaturalización bajo la influencia de factores externos (temperatura, estrés mecánico, acción de reactivos químicos y varios otros factores), se destruyen las estructuras secundarias, terciarias y cuaternarias de la macromolécula proteica. Estructura primaria, y consecuentemente, composición química Las proteínas no cambian. Están cambiando propiedades físicas: la solubilidad, la capacidad de hidratación disminuye, se pierde la actividad biológica. La forma de la macromolécula proteica cambia y se produce un agrandamiento.
Para trabajar, utilice clara de huevo de gallina disuelta en agua (una clara de huevo por 150 ml de agua).
Descripción de la experiencia. Calienta una pequeña cantidad de solución de proteína en un fuego hasta que hierva. Se observa turbidez del líquido. El precipitado resultante no se disuelve ni al enfriar ni al diluir con agua, es decir la reacción es irreversible.
Experimento 2. Reacción de xantoproteínas
La reacción de xantoproteínas indica la presencia de residuos de aminoácidos aromáticos (fenilalanina, tirosina, triptófano) en las proteínas. Cuando se expone al ácido nítrico concentrado, se produce la reacción de nitración de los núcleos aromáticos con la formación de compuestos nitro de color amarillo. Cuando se exponen al amoníaco, los compuestos nitro se isomerizan para formar productos parecidos a la sal de colores intensos.
Descripción de la experiencia. Agregue 5-6 gotas de HNO3 concentrado a 1 ml de solución de proteína hasta que aparezca un precipitado blanco (o turbidez debido a la proteína coagulada bajo la influencia del ácido). Cuando se calienta, la solución y el precipitado se volverán de color amarillo brillante (el precipitado se hidrolizará y disolverá casi por completo).
Enfriar la mezcla, agregar (con cuidado, sin agitar) el exceso de amoníaco acuoso concentrado (o álcali cáustico) gota a gota hasta que se produzca una reacción alcalina. El precipitado de albuminato ácido que caiga primero se disolverá y el líquido se volverá de color naranja brillante.
La reacción de biuret indica la presencia de grupos peptídicos repetidos -CO-NH- en la proteína. Esto se confirma por el hecho de que las proteínas adquieren un color violeta cuando se exponen a pequeña cantidad Solución de sulfato de cobre en presencia de álcali. El color se debe a la formación de complejos de cobre.
Experimento 3. Reacción de Biuret
Descripción de la experiencia. Coloque 1 ml de solución de clara de huevo, 1 ml de solución de hidróxido de sodio y 1-2 gotas de solución de sulfato de cobre (II) en un tubo de ensayo. El líquido se volverá rojo violeta (si el contenido de proteínas es bajo, agregue con cuidado 0,5-1 ml de solución de CuSO4 a su solución en álcali; el color aparecerá en el límite de las capas). Ecuación de reacción:
CuSO4 + 2NaOH > Na2SO4 + Cu(OH)2v
2R - CH - COOH + Cu(OH)2 > (R- CH-COO)2Cu + 2H2O
Experimento 4. Precipitación de proteínas con sales de metales pesados.
Descripción de la experiencia. Tome dos tubos de ensayo y coloque en ellos 1 ml de solución de clara de huevo y lentamente, mientras agita, gota a gota, agregue una solución saturada de sulfato de cobre (II) a un tubo de ensayo y una solución de acetato de plomo al 20% al otro. . Se forman precipitados de compuestos proteicos similares a sales poco solubles. La experiencia ilustra el uso de proteínas como antídoto contra el envenenamiento por sales de metales pesados. Ecuaciones de reacción:
- 2R - CH - COOH + CuSO4 > (R- CH-COO)2Cu + H2SO4
- 2R-CH-COOH + (CH3COO)2Pb> (R-CH-COO)2Pb + CH3COOH
Experimento 4. Descubrimiento de azufre en proteínas.
Descripción de la experiencia. Se vierten aproximadamente 0,5 ml de una solución de acetato de plomo en un tubo de ensayo y se agrega una solución de hidróxido de potasio hasta que se disuelva el precipitado de hidróxido de plomo resultante. Se vierten aproximadamente 2-3 ml de solución de proteína en otro tubo de ensayo y se agrega el mismo volumen de la solución de plumbite resultante. Calienta la mezcla hasta que hierva durante 2-3 minutos. La aparición de un color oscuro indica la formación de sulfito de plomo. Escribe las ecuaciones de reacción.
- En contacto con 0
- Google+ 0
- DE ACUERDO 0
- Facebook 0