Valk on aminohapete järjestus, mis on omavahel seotud peptiidsidemetega.
On lihtne ette kujutada, et aminohapete arv võib olla erinev: vähemalt kahest kuni mis tahes mõistliku väärtuseni. Biokeemikud on nõustunud arvestama, et kui aminohapete arv ei ületa 10, siis nimetatakse sellist ühendit peptiidiks; kui 10 või enamast aminohappest - polüpeptiid. Polüpeptiide, mis võivad spontaanselt moodustada ja säilitada teatud ruumilise struktuuri, mida nimetatakse konformatsiooniks, nimetatakse valkudeks. Sellise struktuuri stabiliseerimine on võimalik ainult siis, kui polüpeptiidid jõuavad teatud pikkuseni (üle 40 aminohappe), seetõttu peetakse tavaliselt valkudeks polüpeptiide, mille molekulmass on üle 5000 Da. (1 Da võrdub 1/12 süsiniku isotoobiga). Ainult teatud ruumilise struktuuriga (natiivse struktuuriga) valk saab oma funktsioone täita.
Valgu suurust saab mõõta daltonites ( molekulmass), sagedamini molekuli suhteliselt suure suuruse tõttu tuletatud ühikutes - kilodaltonites (kDa). Pärmivalgud koosnevad keskmiselt 466 aminohappest ja nende molekulmass on 53 kDa. Suurim praegu teadaolev valk titiin on lihassarkomeeride komponent; selle erinevate isovormide molekulmass varieerub vahemikus 3000 kuni 3700 kDa, see koosneb 38 138 aminohappest (inimese solius lihases).
valgu struktuur
Valgu kolmemõõtmeline struktuur moodustub voltimise protsessis (inglise keelest. kokkupandav-"kokkuklapitavad"). Kolmemõõtmeline struktuur moodustub madalama taseme struktuuride koosmõjul.
Valgu struktuuris on neli taset:
Esmane struktuur- aminohapete järjestus polüpeptiidahelas.
sekundaarne struktuur- see on polüpeptiidahela üksikute osade paigutamine ruumi.
Järgmised on kõige levinumad valgu sekundaarstruktuuri tüübid:
α-heeliksid- tihedad pöörded ümber molekuli pikitelje, üks pööre on 3,6 aminohappejääki ja spiraali samm on 0,54 nm (0,15 nm aminohappejäägi kohta), heeliksit stabiliseerivad vesiniksidemed H ja O peptiidrühmade vahel 4 aminohappejäägi kaugusel. Heeliks on ehitatud ainult ühte tüüpi aminohapete stereoisomeeridest (L). Kuigi see võib olla kas vasaku- või paremakäeline, on valkudes ülekaalus paremakäelised. Spiraal puruneb glutamiinhappe, lüsiini, arginiini elektrostaatilise koostoime tõttu. Asparagiini, seriini, treoniini ja leutsiini jäägid, mis asuvad üksteise lähedal, võivad steeriliselt häirida heeliksi moodustumist, proliinijäägid põhjustavad ahela paindumist ja rikuvad ka α-heeliksi struktuuri.
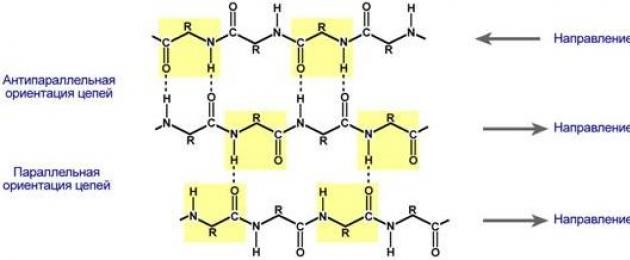
β-volditud kihid- mitmed siksakilised polüpeptiidahelad, milles vesiniksidemed moodustuvad primaarstruktuuris üksteisest suhteliselt kaugel (0,347 nm aminohappejäägi kohta) olevate aminohapete või erinevate valguahelate vahel ja mitte tihedalt asetsevad, nagu α-heeliksi puhul . Need ahelad on tavaliselt suunatud nende N-terminalidega vastassuundades (anti-paralleelorientatsioon). β-volditud kihtide moodustamisel on olulised aminohapete kõrvalrühmade väikesed suurused, enamasti domineerivad glütsiin ja alaniin.

Valgu voltimine β-volditud kihi kujul
Häiritud struktuurid on valguahela korratu paigutus ruumis.
Iga valgu ruumiline struktuur on individuaalne ja selle määrab selle esmane struktuur. Erineva struktuuri ja funktsiooniga valkude konformatsioonide võrdlus näitas aga nendes sarnaste sekundaarstruktuuri elementide kombinatsioonide olemasolu. Sellist spetsiifilist sekundaarstruktuuride moodustumise järjekorda nimetatakse valkude supersekundaarseks struktuuriks. Supersekundaarne struktuur moodustub interradikaalsete interaktsioonide tõttu.
Teatud iseloomulikke α-heeliksite ja β-struktuuride kombinatsioone nimetatakse sageli "struktuurimotiivideks". Neil on spetsiifilised nimetused: "α-helix-turn-α-helix", "α/β-barrel struktuur", "leutsiintõmblukk", "tsink-sõrm" jne.
Tertsiaarne struktuur - see on viis kogu polüpeptiidahela paigutamiseks ruumi. Koos α-heeliksite, β-volditud kihtide ja supersekundaarsete struktuuridega on tertsiaarsel struktuuril korrapäratu konformatsioon, mis võib hõivata olulise osa molekulist.

Valgu tertsiaarseks struktuuriks voltimise skemaatiline esitus.
Kvaternaarne struktuur esineb valkudes, mis koosnevad mitmest polüpeptiidahelast (subühikud, protomeerid või monomeerid), kui nende subühikute tertsiaarsed struktuurid on kombineeritud. Näiteks hemoglobiini molekul koosneb 4 subühikust. Supramolekulaarsed moodustised on kvaternaarse struktuuriga - multiensüümide kompleksid, mis koosnevad mitmest ensüümide ja koensüümide molekulidest (püruvaatdehüdrogenaas) ja isoensüümidest (laktaatdehüdrogenaas - LDH, kreatiinfosfokinaas - CPK).
nii. Ruumiline struktuur ei sõltu polüpeptiidahela pikkusest, vaid igale valgule omaste aminohappejääkide järjestusest, samuti vastavatele aminohapetele iseloomulikest kõrvalradikaalidest. Valgu makromolekulide ruumilise kolmemõõtmelise struktuuri või konformatsiooni moodustavad peamiselt vesiniksidemed, hüdrofoobsed interaktsioonid aminohapete mittepolaarsete külgradikaalide vahel ja ioonsed vastasmõjud aminohappejääkide vastaslaenguga külgrühmade vahel. Vesiniksidemed mängivad tohutut rolli valgu makromolekuli ruumilise struktuuri kujunemisel ja säilitamisel.
Mis puutub hüdrofoobsetesse interaktsioonidesse, siis need tekivad kokkupuutel mittepolaarsete radikaalide vahel, mis ei suuda lõhkuda vesiniksidemeid veemolekulide vahel, mis nihkub valgugloobuli pinnale. Valgu sünteesimisel kogutakse gloobuli sisse mittepolaarsed keemilised rühmad ja polaarsed surutakse selle pinnale välja. Seega võib valgumolekul olla neutraalne, positiivselt või negatiivselt laetud, olenevalt lahusti pH-st ja valgu ioonrühmadest. Lisaks säilitavad valgu konformatsiooni kahe tsüsteiinijäägi vahel moodustunud S-S kovalentsed sidemed. Loodusliku valgustruktuuri moodustumise tulemusena lähenevad paljud polüpeptiidahela kaugemates kohtades asuvad aatomid üksteisele ja omandavad üksteisele toimides uusi omadusi, mis puuduvad üksikutes aminohapetes või väikestes polüpeptiidides.
Oluline on mõista, et voltimine – valkude (ja teiste biomakromolekulide) voltimine voltimata konformatsioonist “natiivseks” vormiks – on füüsikalis-keemiline protsess, mille tulemusena valgud oma loomulikus “elupaigas” (lahuses, tsütoplasmas või membraan) omandavad ainult neile iseloomulikud omadused.ruumiline paigutus ja funktsioon.
Rakud sisaldavad mitmeid katalüütiliselt inaktiivseid valke, mis sellest hoolimata annavad suure panuse ruumiliste valgustruktuuride kujunemisse. Need on nn saatjad. Chaperonid aitavad kaasa kolmemõõtmelise valgu konformatsiooni õigele kokkupanekule, moodustades osaliselt volditud polüpeptiidahelaga pöörduvaid, mittekovalentseid komplekse, inhibeerides samal ajal väärarenenud sidemeid, mis põhjustavad funktsionaalselt inaktiivsete valgustruktuuride moodustumist. Tšaperoonidele omaste funktsioonide loend sisaldab sula (osaliselt volditud) gloobulite kaitset agregatsiooni eest, samuti äsja sünteesitud valkude ülekandmist erinevatesse raku lookustesse.
Tšaperoonid on valdavalt kuumašokivalgud, mille süntees suureneb järsult stressirohke temperatuuriga kokkupuutel, seetõttu nimetatakse neid ka hsp-ks (kuumašokivalgud). Nende valkude perekondi leidub mikroobi-, taime- ja loomarakkudes. Tšaperoonide klassifikatsioon põhineb nende molekulmassil, mis varieerub vahemikus 10 kuni 90 kDa. Need on abistavad valgud valkude kolmemõõtmelise struktuuri kujunemise protsessides. Tšaperoonid hoiavad äsja sünteesitud polüpeptiidahelat voldimata olekus, takistades selle voltimist natiivsest erinevaks vormiks ja loovad tingimused ainsa õige, natiivse valgu struktuuri jaoks.
Valgu voltimise protsessis lükatakse sula gloobuli staadiumis mõned molekuli konformatsioonid tagasi. Selliste molekulide lagunemise algatab valk ubikvitiin.
Valkude lagunemine ubikvitiini raja kaudu hõlmab kahte peamist etappi:
1) ubikvitiini kovalentne seondumine lagundatava valguga jäägi kaudu lüsiin, sellise märgise olemasolu valgus on esmane sorteerimissignaal, mis suunab saadud konjugaadid proteasoomidesse; enamikul juhtudel on valgu külge kinnitatud mitu ubikvitiini molekuli, mis on organiseeritud nöörile helmeste kujul .;
2) valgu hüdrolüüs proteasoomi poolt (proteasoomi põhiülesanne on mittevajalike ja kahjustatud valkude proteolüütiline lagundamine lühikesteks peptiidideks). Ubikvitiini nimetatakse teenitult valgu "surma märgiks".
Domeen n valk? - valgu tertsiaarse struktuuri element, mis on üsna stabiilne ja sõltumatu valgu alamstruktuur, mille voltimine toimub teistest osadest sõltumatult. Domeen sisaldab tavaliselt mitmeid sekundaarstruktuuri elemente. Struktuurilt sarnaseid domeene ei leidu mitte ainult sugulasvalkudes (näiteks erinevate loomade hemoglobiinides), vaid ka täiesti erinevates valkudes. Valgul võib olla mitu domeeni, need piirkonnad võivad samas valguses täita erinevaid funktsioone. Mõnedel ensüümidel ja kõigil immunoglobuliinidel on domeenistruktuur. Pikkade polüpeptiidahelatega (üle 200 aminohappejäägiga) valgud loovad sageli domeenistruktuure.
Bioloogiline keemia Lelevitš Vladimir Valerjanovitš
Valkude struktuurse organiseerituse tasemed
Esmane struktuur- rangelt määratletud lineaarne aminohapete järjestus polüpeptiidahelas.
Valgu primaarstruktuuri uurimise strateegilised põhimõtted on läbi teinud olulisi muutusi koos kasutatavate meetodite arendamise ja täiustamisega. Märkida tuleks nende arengu kolme peamist etappi. Esimene etapp algab F. Sangeri (1953) klassikalise tööga insuliini aminohappejärjestuse loomise kohta, teine - automaatse sekvenaatori laialdase kasutuselevõtuga valgu struktuurianalüüsi (70. aastate algus). 20. sajand), kolmas - kiirete meetodite väljatöötamisega DNA nukleotiidjärjestuse analüüsimiseks (1980ndate alguses).
Valgu esmase struktuuri määravad:
1. Molekulis sisalduvate aminohapete olemus.
2. Iga aminohappe suhteline kogus.
3. Rangelt määratletud aminohapete järjestus polüpeptiidahelas.
Esialgsed uuringud enne valgu primaarstruktuuri määramist
1. Valkude puhastamine
2. Molekulmassi määramine.
3. Proteesirühmade tüübi ja arvu määramine (kui valk on konjugeeritud).
4. Intra- või intermolekulaarsete disulfiidsidemete olemasolu määramine. Tavaliselt määratakse sulfhüdrüülrühmade olemasolu looduslikus valguses samaaegselt.
5. 4. struktuuriga valkude eeltöötlus subühikute dissotsiatsiooni eesmärgil, nende eraldamine ja edasine uurimine.
Valkude ja polüpeptiidide primaarstruktuuri määramise etapid
1. Aminohapete koostise määramine (hüdrolüüs, aminohapete analüsaator).
2. N- ja C-terminaalsete aminohapete identifitseerimine.
3. Polüpeptiidahela lõhustamine fragmentideks (trüpsiin, kümotrüpsiin, tsüaanbromiid, hüdroksüülamiin jne).
4. Peptiidi fragmentide aminohappejärjestuse määramine (sekvenaator).
5. Algse polüpeptiidahela lõhustamine muul viisil ja nende aminohappejärjestuse määramine.
6. Peptiidifragmentide paigutuse järjekorra kehtestamine kattuvatel aladel (peptiidikaartide saamine).
N-terminaalsete aminohapete määramise meetodid
1. Sangeri meetod.
2. Edmani meetod (rakendatud sekventseris).
3. Reaktsioon dansüülkloriidiga.
4. Aminopeptidaasi kasutav meetod.
C-terminaalsete aminohapete määramise meetodid
1. Akabori meetod.
2. Karboksüpeptidaasi kasutav meetod.
3. Naatriumboorhüdriidi kasutav meetod.
Üldised mustrid valkude aminohappejärjestuse kohta
1. Kõigile valkudele pole ühtset ainulaadset järjestust või osaliste järjestuste rühma.
2. Erinevaid funktsioone täitvatel valkudel on erinev järjestus.
3. Sarnaste funktsioonidega valkudel on sarnased järjestused, kuid järjestuste sobivus on tavaliselt väike.
4. Samadel valkudel, mis täidavad samu funktsioone, kuid isoleeritud erinevatest organismidest, on tavaliselt oluline järjestuse sarnasus.
5. Samadel valkudel, mis täidavad samu funktsioone ja mis on eraldatud sama liigi organismidest, on peaaegu alati täpselt sama järjestus.
Valkude struktuuri kõrgeimad tasemed, nende bioloogiline aktiivsus on tihedalt seotud ja tegelikult määratakse aminohappejärjestuse järgi. St esmane struktuur on geneetiliselt määratud ja määrab valkude individuaalsed omadused, nende liigispetsiifilisuse, selle alusel moodustuvad kõik järgnevad struktuurid.
Valgu sekundaarne struktuur on polüpeptiidahela konfiguratsioon, mis tuleneb selle funktsionaalrühmade vastastikmõjudest.
Sekundaarse struktuuri sordid:
1. ?-spiraal.
2. Volditud leht (?-struktuur).
3. Statistiline sasipundar.
Esimesed kaks sorti on järjestatud, kolmas on järjestamata.
Valkude supersekundaarne struktuur.
Erinevate struktuuride ja funktsioonidega valkude konformatsioonide võrdlus näitas, et neil on sarnased sekundaarse struktuuri elementide kombinatsioonid. Sellist spetsiifilist sekundaarstruktuuride moodustamise järjekorda nimetatakse supersekundaarseks struktuuriks. Supersekundaarne struktuur moodustub interradikaalsete interaktsioonide tõttu.
Valkude supersekundaarse struktuuri sordid:
1. ?-tünni tüüpi supersekundaarne struktuur. See meenutab tõesti tünni, kus iga α-struktuur asub sees ja on ühendatud pinnal paikneva ahela α-spiraalse osaga. See on iseloomulik mõnele ensüümile – trioosfosfaadi isomeraasile, püruvaatkinaasile.
2. Struktuurimotiiv "?-heeliks - pööre - ?-heeliks". Leidub paljudes DNA-d siduvates valkudes.
3. Supersekundaarne struktuur "tsink-sõrme" kujul. See on iseloomulik ka DNA-d siduvatele valkudele. "Tsingisõrm" - umbes 20 aminohapet sisaldav valgufragment, milles tsingi aatom on seotud nelja aminohapperadikaaliga: tavaliselt kaks tsüsteiinijääki ja kaks histidiinijääki.
4. Supersekundaarne struktuur "leutsiintõmbluku" kujul. Protomeeride või üksikute valkude kombineerimine kompleksideks viiakse mõnikord läbi struktuursete motiivide abil, mida nimetatakse "leutsiini tõmblukuks". Histoonid on näide sellisest valkude kombinatsioonist. Need on tuumavalgud, mis sisaldavad suurt hulka positiivselt laetud aminohappeid – arginiini ja lüsiini. Histooni molekulid ühendatakse "leutsiini kinnitusvahendite" abil kompleksideks, hoolimata sellest, et kõigil monomeeridel on tugev positiivne laeng.
P-heeliksite ja y-struktuuride olemasolu järgi võib globulaarsed valgud jagada 4 kategooriasse:
Valgu tertsiaarne struktuur on polüpeptiidahela ruumiline orientatsioon või selle paigutamise viis teatud mahus.
Sõltuvalt tertsiaarse struktuuri kujust eristatakse globulaarseid ja fibrillaarseid valke. Kerakujulistes valkudes domineerib sageli α-heeliks, fibrillaarsed valgud tekivad β-struktuuri alusel.
Globulaarse valgu tertsiaarse struktuuri stabiliseerimisel võivad osaleda:
1. spiraalstruktuuriga vesiniksidemed;
2. vesiniksidemete a-struktuurid;
3. külgahelate radikaalide vahelised vesiniksidemed;
4. hüdrofoobsed vastasmõjud mittepolaarsete rühmade vahel;
5. elektrostaatilised vastasmõjud vastaslaenguga rühmade vahel;
6. disulfiidsidemed;
7. metalliioonide koordinatsioonisidemed.
Valgu kvaternaarne struktuur on viis, kuidas paigutada ruumi üksikuid polüpeptiidahelaid, millel on sama (või erinev) primaarne, sekundaarne või tertsiaarne struktuur, ning moodustada struktuurselt ja funktsionaalselt üks makromolekulaarne moodustis.
Kvaternaarne struktuur on iseloomulik mitmest subühikust koosnevatele valkudele. Kvaternaarse struktuuri allüksuste komplementaarsete saitide interaktsioon viiakse läbi vesinik- ja ioonsidemete, van der Waalsi jõudude ja hüdrofoobsete interaktsioonide abil. Harva tekivad kovalentsed sidemed.
Subühikvalgu ehituse eelised võrreldes ühe pika polüpeptiidahelaga.
Esiteks võimaldab subühiku struktuuri olemasolu geneetilist materjali “säästa”. Identsetest subühikutest koosnevate oligomeersete valkude puhul väheneb järsult struktuurgeeni suurus ja vastavalt ka messenger-RNA pikkus.
Teiseks väheneb suhteliselt väikese ahela suuruse korral valgu molekulide biosünteesi käigus tekkida võivate juhuslike vigade mõju. Lisaks on võimalik "valede", ekslike polüpeptiidide täiendav hävitamine subühikute ühendamise protsessis üheks kompleksiks.
Kolmandaks, subühiku struktuuri olemasolu paljudes valkudes võimaldab rakul oma aktiivsust hõlpsasti reguleerida, nihutades assotsiatsiooni-dissotsiatsiooni tasakaalu ühes või teises suunas.
Lõpuks hõlbustab ja kiirendab subühiku struktuur molekulaarse evolutsiooni protsessi. Mutatsioonid, mis põhjustavad ainult väikseid konformatsioonilisi muutusi tertsiaarstruktuuri tasemel nende muutuste mitmekordse võimendamise tõttu kvaternaarsele struktuurile üleminekul, võivad kaasa aidata valgu uute omaduste ilmnemisele.
Raamatust Bioloogia [ Täielik viide eksamiks valmistuda] autor Lerner Georgi Isaakovitš Raamatust The Missing Link autor Edie MaitlandGenealoogiline puu(tõendid valkude kohta) Sugupuu (tõendid valkude kohta) Kahe liigi valkude erinevused peegeldavad nende liikide evolutsioonilisi muutusi pärast nende eraldumist ühisest esivanemast. Analüüs näitab, et šimpansi vereseerumi albumiinide vahel
Raamatust Vestlused elust autor Galaktionov Stanislav GennadievitšPeatükk 2. Valkude molekulaarne arhitektuur. Ärgem varjagem seda: pärast esimese peatükiga kogesid autorid (ja võib-olla ka lugeja) kergendust. Lõppude lõpuks oli selle eesmärk ainult anda lugejale teavet, mis on vajalik järgmiste peatükkide mõistmiseks,
Raamatust Evolution [Klassikalised ideed uute avastuste valguses] autorIidsete valkude universum laieneb jätkuvalt 2010. aastal avaldas Nature huvitava artikli valkude evolutsioonilise liikumise kohta fitnessmaastikel (Povolotskaja ja Kondrašov, 2010). Töö autorid otsustasid võrrelda 572 iidse valgu aminohappejärjestusi,
Raamatust Geenid ja keha areng autor Neifakh Aleksander Aleksandrovitš4. Struktuurihüpoteesi variandid Seega näitavad mitmed katseandmed selliste struktuurimuutuste võimalikkust, mis säilivad mitoosi ja replikatsiooni ajal, mida saab edasi kanda rea rakupõlvkondade kaupa ja pakkuda epigeneetilisi
Raamatust Human Evolution. Raamat 1. Ahvid, luud ja geenid autor Markov Aleksander VladimirovitšValkude muutused Need genoomi osad, mis kodeerivad valke, on üllatavalt vähe muutunud. Inimeste ja šimpanside valkude aminohappejärjestuste erinevused on oluliselt alla 1% ja neist vähestest erinevustest enamik kummalgi pole
Raamatust Bioloogia. Üldbioloogia. 10. klass. Põhitase autor Sivoglazov Vladislav Ivanovitš3. Elusaine organiseerituse tasemed. Bioloogia meetodid Pidage meeles!Milliseid elusaine organiseerituse tasemeid teate?Milliseid teadusliku uurimistöö meetodeid teate Elusaine organiseerituse tasemeid. Meid ümbritsev elusolendite maailm on kogumik bioloogilised süsteemid
Raamatust Antropoloogia ja bioloogia mõisted autor Kurtšanov Nikolai AnatolievitšElukorralduse struktuursed ja funktsionaalsed tasandid Bioloogias on elusaine organiseerimisel mitu struktuurset ja funktsionaalset taset Molekulaarne tasand. Seda iseloomustavad biokeemilised ained, millest koosneb elusorganism.Rakutasand.
Raamatust Bioloogiline keemia autor Lelevitš Vladimir Valerjanovitš2. peatükk. Valkude ehitus ja funktsioonid Valgud on kõrgmolekulaarsed lämmastikku sisaldavad orgaanilised ühendid, mis koosnevad peptiidsidemete abil polüpeptiidahelateks ühendatud aminohapetest, millel on keeruline struktuurne korraldus Valkude uurimise ajalugu 1728. a.
Autori raamatustValkude funktsioneerimine Igal üksikul valgul, millel on ainulaadne esmane struktuur ja konformatsioon, on ka ainulaadne funktsioon, mis eristab seda kõigist teistest valkudest. Üksikute valkude komplekt täidab rakus palju erinevaid ja keerulisi funktsioone.
Autori raamatustTranslatsioonijärgsed muutused valkudes Paljud valgud sünteesitakse inaktiivsel kujul (prekursorid) ja pärast ribosoomidega ühinemist läbivad postsünteetilisi struktuurseid modifikatsioone. Need polüpeptiidahelate konformatsioonilised ja struktuursed muutused
Autori raamatustAinevahetuse uurimise tasemed Ainevahetuse uurimise tasemed: 1. Kogu organism.2. Eraldatud elundid (perfuseeritud).3. Kudede lõiked.4. Rakukultuurid.5. Kudede homogeniseerimine.6. Eraldatud rakuorganellid.7. Molekulaarne tase (puhastatud ensüümid, retseptorid ja
Autori raamatustValkude seedimine seedetraktis Valkude seedimine algab maost maomahla ensüümide toimel. Päevas vabaneb kuni 2,5 liitrit ja see erineb teistest seedemahladest tugevalt happelise reaktsiooni poolest, mis tuleneb selle olemasolust.
Autori raamatustValkude lõhustamine kudedes See viiakse läbi proteolüütiliste lüsosomaalsete ensüümide katepsiinide abil. Aktiivse tsentri struktuuri järgi eristatakse tsüsteiini, seriini, karboksüüli ja metalloproteiini katepsiine. Katepsiinide roll: 1. bioloogiliselt aktiivsete ainete loomine
Autori raamatustMaksa roll aminohapete ja valkude metabolismis Maksal on keskne roll valkude ja teiste lämmastikku sisaldavate ühendite metabolismis. See täidab järgmisi funktsioone: 1. spetsiifiliste plasmavalkude süntees: - maksas sünteesitakse: 100% albumiini, 75 - 90% β-globuliine, 50%
Autori raamatustVereseerumi valkude omadused Komplemendisüsteemi valgud – see süsteem sisaldab 20 veres ringlevat valku mitteaktiivsete prekursorite kujul. Nende aktiveerimine toimub spetsiifiliste proteolüütilise aktiivsusega ainete toimel.
Oravad- α-aminohapete jääkidest koosnevad kõrgmolekulaarsed orgaanilised ühendid.
IN valgu koostis hõlmab süsinikku, vesinikku, lämmastikku, hapnikku, väävlit. Mõned valgud moodustavad komplekse teiste fosforit, rauda, tsinki ja vaske sisaldavate molekulidega.
Valkudel on suur molekulmass: munaalbumiin - 36 000, hemoglobiin - 152 000, müosiin - 500 000. Võrdluseks: alkoholi molekulmass on 46, äädikhappe - 60, benseeni - 78.
Valkude aminohappeline koostis
Oravad- mitteperioodilised polümeerid, mille monomeerid on α-aminohapped. Tavaliselt nimetatakse valgu monomeerideks 20 tüüpi α-aminohappeid, kuigi rakkudest ja kudedest on leitud üle 170 neist.
Sõltuvalt sellest, kas aminohappeid saab inimeste ja teiste loomade kehas sünteesida, on olemas: mitteasendatavad aminohapped- saab sünteesida asendamatud aminohapped- ei saa sünteesida. Asendamatud aminohapped tuleb sisse võtta koos toiduga. Taimed sünteesivad igasuguseid aminohappeid.
Sõltuvalt aminohapete koostisest, valgud on: täielikud- sisaldab kogu aminohapete komplekti; defektne- nende koostises puuduvad mõned aminohapped. Kui valgud koosnevad ainult aminohapetest, nimetatakse neid lihtne. Kui valgud sisaldavad lisaks aminohapetele ka mitteaminohappelist komponenti (proteesirühma), nimetatakse neid nn. keeruline. Proteesirühma võivad esindada metallid (metalloproteiinid), süsivesikud (glükoproteiinid), lipiidid (lipoproteiinid), nukleiinhapped (nukleoproteiinid).
Kõik aminohapped sisaldavad: 1) karboksüülrühm (-COOH), 2) aminorühm (-NH2), 3) radikaal või R-rühm (ülejäänud molekul). Erinevat tüüpi aminohapete radikaali struktuur on erinev. Sõltuvalt aminohappeid moodustavate aminorühmade ja karboksüülrühmade arvust on olemas: neutraalsed aminohapped millel on üks karboksüülrühm ja üks aminorühm; aluselised aminohapped millel on rohkem kui üks aminorühm; happelised aminohapped millel on rohkem kui üks karboksüülrühm.
Aminohapped on amfoteersed ühendid, kuna lahuses võivad nad toimida nii hapete kui alustena. Vesilahustes esinevad aminohapped erinevates ioonsetes vormides.
Peptiidside
Peptiidid- orgaanilised ained, mis koosnevad peptiidsidemega ühendatud aminohappejääkidest.
Peptiidide moodustumine toimub aminohapete kondensatsioonireaktsiooni tulemusena. Kui ühe aminohappe aminorühm interakteerub teise aminohappe karboksüülrühmaga, tekib nende vahele kovalentne lämmastik-süsinik side, mida nimetatakse nn. peptiid. Sõltuvalt peptiidi moodustavate aminohappejääkide arvust on olemas dipeptiidid, tripeptiidid, tetrapeptiidid jne. Peptiidsideme moodustumist võib korrata mitu korda. See viib moodustumiseni polüpeptiidid. Peptiidi ühes otsas on vaba aminorühm (seda nimetatakse N-otsaks) ja teises otsas on vaba karboksüülrühm (seda nimetatakse C-otsaks).

Valgumolekulide ruumiline korraldus
Teatud spetsiifiliste funktsioonide täitmine valkude poolt sõltub nende molekulide ruumilisest konfiguratsioonist, lisaks on rakule energeetiliselt ebasoodne hoida valke laiendatud kujul, ahela kujul, mistõttu polüpeptiidahelad läbivad voltimise, omandades. teatud kolmemõõtmeline struktuur või konformatsioon. Määrake 4 taset valkude ruumiline korraldus.
Valgu esmane struktuur– valgu molekuli moodustava polüpeptiidahela aminohappejääkide järjestus. Aminohapete vaheline side on peptiid.

Kui valgumolekul koosneb vaid 10 aminohappejäägist, siis on teoreetiliselt võimalike aminohapete vaheldumise järjekorra poolest erinevate valgumolekulide variantide arv 10 20 . 20 aminohappega saad teha neist veelgi mitmekesisemaid kombinatsioone. Inimese organismist on leitud umbes kümme tuhat erinevat valku, mis erinevad nii üksteisest kui ka teiste organismide valkudest.
See on valgumolekuli esmane struktuur, mis määrab valgu molekulide omadused ja selle ruumilise konfiguratsiooni. Ainuüksi ühe aminohappe asendamine teisega polüpeptiidahelas toob kaasa muutuse valgu omadustes ja funktsioonides. Näiteks kuuenda glutamiini aminohappe asendamine hemoglobiini β-subühikus valiiniga toob kaasa asjaolu, et hemoglobiini molekul tervikuna ei suuda täita oma põhifunktsiooni - hapniku transporti; sellistel juhtudel tekib inimesel haigus – sirprakuline aneemia.
sekundaarne struktuur- polüpeptiidahela järjestatud voltimine spiraaliks (näeb välja nagu venitatud vedru). Heeliksi pooli tugevdavad vesiniksidemed karboksüülrühmade ja aminorühmade vahel. Peaaegu kõik CO ja NH rühmad osalevad vesiniksidemete moodustamises. Need on nõrgemad kui peptiidsed, kuid korduvalt korrates annavad nad sellele konfiguratsioonile stabiilsuse ja jäikuse. Sekundaarse struktuuri tasemel on valgud: fibroiin (siid, võrk), keratiin (juuksed, küüned), kollageen (kõõlused).



Tertsiaarne struktuur- esinemisest tulenevate polüpeptiidahelate pakkimine gloobulitesse keemilised sidemed(vesinik, ioonne, disulfiid) ja hüdrofoobsete interaktsioonide loomine aminohappejääkide radikaalide vahel. Peamist rolli tertsiaarse struktuuri moodustamisel mängivad hüdrofiilsed-hüdrofoobsed interaktsioonid. Vesilahustes kipuvad hüdrofoobsed radikaalid vee eest peitu pugema, rühmitudes gloobuli sees, hüdrofiilsed radikaalid aga hüdratatsiooni (koostoime vee dipoolidega) tulemusena molekuli pinnale. Mõnedes valkudes stabiliseeritakse tertsiaarne struktuur kovalentsete disulfiidsidemetega, mis moodustuvad kahe tsüsteiinijäägi väävliaatomite vahel. Tertsiaarse struktuuri tasemel on ensüümid, antikehad, mõned hormoonid.

Kvaternaarne struktuur iseloomulik komplekssetele valkudele, mille molekulid moodustavad kaks või enam gloobulit. Alamühikuid hoiavad molekulis ioonsed, hüdrofoobsed ja elektrostaatilised interaktsioonid. Mõnikord tekivad kvaternaarse struktuuri moodustumisel subühikute vahel disulfiidsidemed. Enim uuritud kvaternaarse struktuuriga valk on hemoglobiini. See moodustub kahest α-subühikust (141 aminohappejääki) ja kahest β-subühikust (146 aminohappejääki). Iga subühik on seotud rauda sisaldava heemimolekuliga.
Kui valkude ruumiline konformatsioon mingil põhjusel normaalsest hälbib, ei saa valk oma funktsioone täita. Näiteks "hullu lehma tõve" (spongiformse entsefalopaatia) põhjus on prioonide, närvirakkude pinnavalkude, ebanormaalne konformatsioon.
Valgu omadused
Aminohapete koostis, valgumolekuli struktuur määrab selle omadused. Valgud ühendavad aminohapete radikaalide poolt määratud aluselised ja happelised omadused: mida rohkem happelisi aminohappeid on valgus, seda rohkem väljenduvad selle happelised omadused. Võimalus anda ja kinnitada H + määrata valkude puhveromadused; üks võimsamaid puhvreid on erütrotsüütides leiduv hemoglobiin, mis hoiab vere pH konstantsel tasemel. On lahustuvad valgud (fibrinogeen), on lahustumatud valgud, mis täidavad mehaanilisi funktsioone (fibroiin, keratiin, kollageen). On keemiliselt aktiivseid valke (ensüüme), on keemiliselt inaktiivseid, vastupidavaid erinevatele keskkonnatingimustele ja äärmiselt ebastabiilseid.
Välised tegurid (kuumus, ultraviolettkiirgus, raskmetallid ja nende soolad, pH muutused, kiirgus, dehüdratsioon)
võib põhjustada valgu molekuli struktuurse korralduse rikkumist. Antud valgu molekulile omase kolmemõõtmelise konformatsiooni kaotamise protsessi nimetatakse denatureerimine. Denaturatsiooni põhjuseks on teatud valgu struktuuri stabiliseerivate sidemete katkemine. Esialgu katkevad kõige nõrgemad sidemed ja kui tingimused muutuvad karmimaks, siis veelgi tugevamaks. Seetõttu kaovad esmalt kvaternaar, seejärel tertsiaar- ja sekundaarstruktuurid. Ruumilise konfiguratsiooni muutus toob kaasa valgu omaduste muutumise ja selle tulemusena ei saa valgul täita oma bioloogilisi funktsioone. Kui denaturatsiooniga ei kaasne primaarstruktuuri hävimine, siis võib see nii olla pööratav, sel juhul toimub valgule iseloomuliku konformatsiooni iseparanemine. Selline denatureerimine allutatakse näiteks membraani retseptorvalkudele. Valgu struktuuri taastamise protsessi pärast denatureerimist nimetatakse renaturatsioon. Kui valgu ruumilise konfiguratsiooni taastamine on võimatu, nimetatakse denaturatsiooni pöördumatu.
Valkude funktsioonid
| Funktsioon | Näited ja selgitused |
|---|---|
| Ehitus | Valgud osalevad rakuliste ja rakuväliste struktuuride moodustamises: need on osa rakumembraanidest (lipoproteiinid, glükoproteiinid), juustest (keratiin), kõõlustest (kollageen) jne. |
| Transport | Vere valk hemoglobiin seob hapnikku ja transpordib selle kopsudest kõikidesse kudedesse ja organitesse ning sealt edasi kopsudesse süsinikdioksiid; Rakumembraanide koostis sisaldab spetsiaalseid valke, mis tagavad teatud ainete ja ioonide aktiivse ja rangelt selektiivse ülekande rakust väliskeskkonda ja tagasi. |
| Reguleerivad | Valguhormoonid osalevad ainevahetusprotsesside reguleerimises. Näiteks hormoon insuliin reguleerib vere glükoosisisaldust, soodustab glükogeeni sünteesi ja suurendab rasvade moodustumist süsivesikutest. |
| Kaitsev | Vastuseks võõrvalkude või mikroorganismide (antigeenide) tungimisele organismi moodustuvad spetsiaalsed valgud – antikehad, mis suudavad neid siduda ja neutraliseerida. Fibrinogeenist moodustuv fibriin aitab peatada verejooksu. |
| Mootor | Kokkutõmbuvad valgud aktiin ja müosiin tagavad mitmerakuliste loomade lihaste kontraktsiooni. |
| Signaal | Valkude molekulid on põimitud raku pinnamembraani, mis on võimelised muutma oma tertsiaarset struktuuri vastuseks keskkonnategurite toimele, saades seeläbi väliskeskkonnast signaale ja edastades rakule käsklusi. |
| Reserv | Loomade kehas valke reeglina ei säilitata, välja arvatud munaalbumiin, piimakaseiin. Kuid tänu organismis leiduvatele valkudele saab osa aineid varudesse talletada, näiteks hemoglobiini lagunemise ajal ei väljuta raud organismist, vaid ladestub, moodustades ferritiini valguga kompleksi. |
| Energia | 1 g valgu lagunemisel lõpptoodeteks vabaneb 17,6 kJ. Esiteks lagunevad valgud aminohapeteks ja seejärel lõpptoodeteks - veeks, süsinikdioksiidiks ja ammoniaagiks. Valke kasutatakse energiaallikana aga ainult siis, kui muud allikad (süsivesikud ja rasvad) on ära kasutatud. |
| katalüütiline | Valkude üks olulisemaid funktsioone. Varustatud valkudega – ensüümidega, mis kiirendavad rakkudes toimuvaid biokeemilisi reaktsioone. Näiteks ribuloosbifosfaatkarboksülaas katalüüsib CO2 fikseerimist fotosünteesi käigus. |
Ensüümid
Ensüümid, või ensüümid, on spetsiaalne valkude klass, mis on bioloogilised katalüsaatorid. Tänu ensüümidele kulgevad biokeemilised reaktsioonid tohutu kiirusega. Ensümaatiliste reaktsioonide kiirus on kümneid tuhandeid kordi (ja mõnikord miljoneid) suurem kui anorgaaniliste katalüsaatorite reaktsioonide kiirus. Aine, millel ensüüm toimib, nimetatakse substraat.
Ensüümid on globulaarsed valgud struktuursed omadused Ensüümid võib jagada kahte rühma: lihtsad ja keerulised. lihtsad ensüümid on lihtvalgud, st. koosnevad ainult aminohapetest. Komplekssed ensüümid on kompleksvalgud, st. lisaks valguosale sisaldavad need rühma mittevalgulist laadi - kofaktor. Mõnede ensüümide puhul toimivad vitamiinid kofaktoritena. Ensüümi molekulis eraldatakse spetsiaalne osa, mida nimetatakse aktiivseks keskuseks. aktiivne keskus- ensüümi väike osa (kolm kuni kaksteist aminohappejääki), kus substraadi või substraatide seondumine toimub koos ensüümi-substraadi kompleksi moodustumisega. Reaktsiooni lõppedes laguneb ensüümi-substraadi kompleks ensüümiks ja reaktsiooniprodukti(de)ks. Mõnedel ensüümidel on (peale aktiivse) allosteerilised keskused- kohad, millele on kinnitatud ensüümi töö kiiruse regulaatorid ( allosteerilised ensüümid).

Ensümaatilise katalüüsi reaktsioone iseloomustavad: 1) kõrge efektiivsus, 2) range selektiivsus ja toimesuund, 3) substraadi spetsiifilisus, 4) peen ja täpne reguleerimine. Ensümaatilise katalüüsi reaktsioonide substraadi ja reaktsiooni spetsiifilisus on seletatav E. Fischeri (1890) ja D. Koshlandi (1959) hüpoteesidega.
E. Fisher (klahviluku hüpotees) tegi ettepaneku, et ensüümi aktiivse saidi ja substraadi ruumilised konfiguratsioonid peaksid üksteisele täpselt vastama. Substraati võrreldakse "võtmega", ensüümi - "lukuga".
D. Koshland (hüpotees "käsikinnas") tegi ettepaneku, et substraadi struktuuri ja ensüümi aktiivse tsentri vaheline ruumiline vastavus luuakse ainult nende omavahelisel interaktsiooni hetkel. Seda hüpoteesi nimetatakse ka indutseeritud sobivuse hüpotees.
Ensümaatiliste reaktsioonide kiirus sõltub: 1) temperatuurist, 2) ensüümi kontsentratsioonist, 3) substraadi kontsentratsioonist, 4) pH-st. Tuleb rõhutada, et kuna ensüümid on valgud, on nende aktiivsus kõrgeim füsioloogiliselt normaalsetes tingimustes.
Enamik ensüüme saab töötada ainult temperatuurivahemikus 0–40 °C. Nendes piirides suureneb reaktsioonikiirus ligikaudu 2 korda iga 10 °C temperatuuritõusu korral. Temperatuuril üle 40 °C valk denatureerub ja ensüümi aktiivsus väheneb. Külmumislähedasel temperatuuril ensüümid inaktiveeritakse.
Substraadi koguse suurenemisega suureneb ensümaatilise reaktsiooni kiirus, kuni substraadi molekulide arv on võrdne ensüümi molekulide arvuga. Substraadi koguse edasise suurenemisega kiirus ei suurene, kuna ensüümi aktiivsed saidid on küllastunud. Ensüümi kontsentratsiooni suurenemine toob kaasa katalüütilise aktiivsuse suurenemise, kuna ajaühikus muundub suurem arv substraadi molekule.

Iga ensüümi jaoks on optimaalne pH väärtus, mille juures see avaldab maksimaalset aktiivsust (pepsiin - 2,0, sülje amülaas - 6,8, pankrease lipaas - 9,0). Kõrgemate või madalamate pH väärtuste korral ensüümi aktiivsus väheneb. Järsu pH muutusega ensüüm denatureerub.
Allosteeriliste ensüümide kiirust reguleerivad allosteeriliste tsentrite külge kinnituvad ained. Kui need ained kiirendavad reaktsiooni, nimetatakse neid aktivaatorid kui nad aeglustavad - inhibiitorid.
Ensüümide klassifikatsioon
Katalüüsitud keemiliste muundumiste tüübi järgi jagunevad ensüümid 6 klassi:
- oksüdoreduktaas(vesiniku, hapniku või elektroni aatomite ülekandmine ühelt ainelt teisele - dehüdrogenaas),
- transferaas(metüül-, atsüül-, fosfaat- või aminorühma ülekandmine ühelt ainelt teisele – transaminaas),
- hüdrolaasid(hüdrolüüsireaktsioonid, mille käigus substraadist moodustuvad kaks toodet - amülaas, lipaas),
- lüaasid(mittehüdrolüütiline lisamine substraadile või aatomirühma eemaldamine sellest, samas kui C-C, C-N, C-O, C-S sidemed võivad katkeda - dekarboksülaas),
- isomeraas(molekulaarne ümberkorraldus - isomeraas),
- ligaasid(kahe molekuli ühendus moodustumise tulemusena C-C ühendused, C-N, C-O, C-S - süntetaas).
Klassid jagunevad omakorda alamklassideks ja alamklassideks. Praeguses rahvusvahelises klassifikatsioonis on igal ensüümil konkreetne kood, mis koosneb neljast punktidega eraldatud numbrist. Esimene number on klass, teine on alamklass, kolmas on alamklass, neljas on selle alaklassi ensüümi seerianumber, näiteks arginaasi kood on 3.5.3.1.
Minema loengud number 2"Süsivesikute ja lipiidide struktuur ja funktsioonid"
Minema loengud nr 4"ATP nukleiinhapete struktuur ja funktsioonid"
Valkude keemilist struktuuri esindavad peptiidsideme kaudu ahelas ühendatud alfa-aminohapped. Elusorganismides määrab koostis geneetilise koodi. Sünteesiprotsessis kasutatakse enamikul juhtudel 20 standardtüüpi aminohapet. Paljud nende kombinatsioonid moodustavad mitmesuguste omadustega valgumolekule. Aminohappejäägid läbivad sageli translatsioonijärgseid modifikatsioone. Need võivad ilmneda enne, kui valk hakkab oma funktsioone täitma, ja selle aktiivsuse protsessis rakus. Elusorganismides moodustavad mitmed molekulid sageli kompleksseid komplekse. Näiteks on fotosünteetiline assotsiatsioon.
Ühenduste eesmärk
Valke peetakse inimeste ja loomade toitumise oluliseks komponendiks, kuna nende kehas on kõik asendamatud aminohapped ei saa sünteesida. Mõned neist peaksid tulema valgurikka toiduga. Peamised ühendite allikad on liha, pähklid, piim, kala, teravili. Vähemal määral leidub valke köögiviljades, seentes ja marjades. Ensüümide seedimisel lagunevad tarbitud valgud aminohapeteks. Neid kasutatakse juba organismis oma valkude biosünteesis või lagundatakse edasi – energia saamiseks.

Ajaloo viide
Insuliini valgu struktuurijärjestuse määras esimest korda Frederie Senger. Oma töö eest sai ta 1958. aastal Nobeli preemia. Sanger kasutas järjestusmeetodit. Röntgendifraktsiooni abil saadi seejärel (1950. aastate lõpus) müoglobiini ja hemoglobiini kolmemõõtmelised struktuurid. Töö teostasid John Kendrew ja Max Perutz.
Valgu molekuli struktuur
See sisaldab lineaarseid polümeere. Need koosnevad omakorda alfa-aminohappe jääkidest, mis on monomeerid. Lisaks võib valgu struktuur sisaldada mitteaminohappelisi komponente ja modifitseeritud tüüpi aminohappejääke. Komponentide tähistamisel kasutatakse 1- või 3-tähelisi lühendeid. Ühendit, mis sisaldab kahte kuni mitukümmend jääki, nimetatakse sageli "polüpeptiidiks". Ühe aminohappe alfa-karboksüülrühma ja teise aminohappe alfa-aminorühma interaktsiooni tulemusena tekivad sidemed (valgu struktuuri moodustumise ajal). Ühendis eraldatakse C- ja N-otsad olenevalt sellest, milline aminohappejäägi rühm on vaba: -COOH või -NH2. Valgu sünteesi protsessis ribosoomil toimib reeglina metioniinijääk esimese terminalina; järgnevate kinnitamine toimub eelmiste C-otsa.

Organisatsiooni tasemed
Need pakkus välja Lindrem-Lang. Hoolimata asjaolust, et seda jaotust peetakse mõnevõrra aegunuks, kasutatakse seda endiselt. Tehti ettepanek eraldada neli ühenduste korraldamise taset. Määratakse valgu molekuli esmane struktuur geneetiline kood ja geeni omadused. Lisateabe saamiseks kõrged tasemed moodustub iseloomulikult valgu voltimise käigus. Valgu ruumilise struktuuri määrab üldiselt aminohapete ahel. Siiski on see üsna paindlik. Seda võivad mõjutada välised tegurid. Sellega seoses on õigem rääkida ühendi konformatsioonist, mis on kõige soodsam ja energeetiliselt eelistatavam.
1 tase
Seda esindab polüpeptiidahela aminohappejääkide järjestus. Reeglina kirjeldatakse seda ühe või kolme tähega. Valkude esmast struktuuri iseloomustavad stabiilsed aminohappejääkide kombinatsioonid. Nad täidavad teatud ülesandeid. Sellised "konservatiivsed motiivid" säilivad liikide evolutsiooni käigus. Neid saab sageli kasutada tundmatu valgu probleemi ennustamiseks. Hinnates erinevate organismide aminohapete ahelate sarnasuse (homoloogia) astet, saab määrata evolutsioonilist kaugust, mis moodustub neid organisme moodustavate taksonite vahel. Valkude esmane struktuur määratakse sekveneerimise või selle mRNA esialgse kompleksi abil, kasutades geneetilise koodi tabelit.

Ketiosa kohalik tellimine
See on järgmine organiseerituse tase – valkude sekundaarne struktuur. Seda on mitut tüüpi. Polüpeptiidahela piirkonna lokaalset järjestust stabiliseerivad vesiniksidemed. Kõige populaarsemad tüübid on:

Ruumiline struktuur
Valkude tertsiaarne struktuur sisaldab eelmise taseme elemente. Need stabiliseeruvad erinevad tüübid interaktsioonid. Sel juhul on hüdrofoobsed sidemed ülimalt tähtsad. Stabiliseerimine hõlmab:
- kovalentsed vastasmõjud.
- Ioonsed sidemed, mis tekivad külgmiste aminohapperühmade vahel, millel on vastupidised laengud.
- Vesiniku vastastikmõjud.
- hüdrofoobsed sidemed. Ümbritsevate H 2 O elementidega interaktsiooni käigus volditakse valk nii, et külgmised mittepolaarsed aminohapperühmad eraldatakse vesilahusest. Molekuli pinnale ilmuvad hüdrofiilsed rühmad (polaarsed).
Valkude tertsiaarne struktuur määratakse magnet- (tuuma)resonantsi, teatud tüüpi mikroskoopia ja muude meetoditega.
Paigaldamise põhimõte
Uuringud on näidanud, et 2–3 taseme vahel on mugav välja tuua veel üks. Seda nimetatakse "arhitektuuriks", "ladumise motiiviks". Selle määrab sekundaarse struktuuri komponentide (beeta-ahelad ja alfa-heeliksid) vastastikune paigutus kompaktse gloobuli - valgudomeeni - piirides. See võib eksisteerida iseseisvalt või olla koos teiste sarnaste valkudega kaasatud suuremasse valku. On kindlaks tehtud, et stiilimotiivid on pigem konservatiivsed. Need esinevad valkudes, millel pole ei evolutsioonilisi ega funktsionaalseid seoseid. Arhitektuuri määratlus on ratsionaalse (füüsilise) klassifitseerimise aluseks.

Domeeni korraldus
Mitme polüpeptiidiahela vastastikuse paigutusega ühe valgukompleksi koostises moodustub valkude kvaternaarne struktuur. Selle koostise moodustavad elemendid moodustuvad ribosoomidel eraldi. Alles pärast sünteesi lõppu hakkab see valgu struktuur moodustuma. See võib sisaldada nii erinevaid kui ka identseid polüpeptiidahelaid. Valkude kvaternaarset struktuuri stabiliseerivad samad interaktsioonid, mis eelmisel tasemel. Mõned kompleksid võivad sisaldada mitukümmend valku.
Valgu struktuur: kaitseülesanded
Tsütoskeleti polüpeptiidid, mis toimivad mingil moel tugevdusena, annavad paljudele organellidele kuju ja osalevad selle muutumises. Struktuursed valgud pakuvad kehale kaitset. Sellise valgu näide on kollageen. See moodustab aluse sidekudede rakkudevahelises aines. Keratiinil on ka kaitsefunktsioon. See moodustab sarvede, sulgede, juuste ja muude epidermise derivaatide aluse. Kui toksiinid on seotud valkudega, toimub paljudel juhtudel viimaste detoksikatsioon. Nii täidetakse keha keemilise kaitse ülesannet. Eriti oluline toksiinide neutraliseerimise protsessis Inimkeha mängida maksaensüüme. Nad on võimelised lagundama mürke või muutma need lahustuvaks vormiks. See aitab kaasa nende kiiremale transportimisele kehast. Veres ja teistes kehavedelikes sisalduvad valgud pakuvad immuunkaitset, kutsudes esile vastuse nii patogeenide rünnakule kui ka vigastustele. Immunoglobuliinid (antikehad ja komplemendi süsteemi komponendid) on võimelised neutraliseerima baktereid, võõrvalke ja viirusi.
Reguleerimismehhanism
Valgumolekulid, mis ei toimi ei energiaallika ega ehitusmaterjalina, juhivad paljusid rakusiseseid protsesse. Nii et tänu neile reguleeritakse translatsiooni, transkriptsiooni, viilutamist ja teiste polüpeptiidide aktiivsust. Regulatsioonimehhanism põhineb ensümaatilisel aktiivsusel või avaldub spetsiifilise seondumise kaudu teiste molekulidega. Näiteks võivad transkriptsioonifaktorid, aktivaatorpolüpeptiidid ja repressorvalgud kontrollida geenide transkriptsiooni kiirust. Samal ajal suhtlevad nad geenide regulatoorsete järjestustega. Valgufosfataasidel ja proteiinkinaasidel on kõige olulisem roll rakusiseste protsesside kulgemise kontrollimisel. Need ensüümid käivitavad või pärsivad teiste valkude aktiivsust, lisades või eemaldades neist fosfaatrühmi.

Signaali ülesanne
Sageli kombineeritakse seda regulatiivse funktsiooniga. Seda seetõttu, et paljud rakusisesed ja rakuvälised polüpeptiidid võivad signaale edastada. Seda võimet omavad kasvufaktorid, tsütokiinid, hormoonid ja muud ühendid. Steroidid transporditakse läbi vere. Hormooni interaktsioon retseptoriga toimib signaalina, mille tõttu vallandub raku reaktsioon. Steroidid kontrollivad ühendite sisaldust veres ja rakkudes, paljunemist, kasvu ja muid protsesse. Näiteks on insuliin. See reguleerib glükoosi taset. Rakkude interaktsioon toimub signaalvalguühendite abil, mis edastatakse rakkudevahelise aine kaudu.
Elementide transport
Väikeste molekulide liikumises osalevatel lahustuvatel valkudel on kõrge afiinsus suures kontsentratsioonis oleva substraadi suhtes. Neil on ka võimalus seda kergesti vabastada madala sisaldusega piirkondades. Näiteks on transpordivalk hemoglobiin. See viib hapniku kopsudest teistesse kudedesse ja sealt edasi süsihappegaasi. Mõned membraanivalgud osalevad ka väikeste molekulide transportimisel läbi rakuseinte, muutes neid. Tsütoplasma lipiidikiht on veekindel. See hoiab ära laetud või polaarsete molekulide difusiooni. Membraani transpordiühendused jagunevad tavaliselt kandjateks ja kanaliteks.
Varuühendused
Need valgud moodustavad nn varusid. Need kogunevad näiteks taimede seemnetesse, loomade munadesse. Sellised valgud toimivad aine ja energia varuallikana. Mõnda ühendit kasutab organism aminohapete reservuaarina. Need on omakorda ainevahetuse reguleerimises osalevate toimeainete lähteained.
Raku retseptorid
Sellised valgud võivad paikneda nii otse tsütoplasmas kui ka seina sisse põimituna. Üks ühenduse osa saab signaali. Reeglina on see keemiline aine ja mõnel juhul - mehaaniline mõju (näiteks venitamine), valgus ja muud stiimulid. Molekuli teatud fragmendi - retseptorpolüpeptiidi - signaali kokkupuute protsessis algavad selle konformatsioonilised muutused. Need kutsuvad esile muutuse ülejäänud raku konformatsioonis, mis viib stiimuli edasi raku teistele komponentidele. Signaali saab saata erineval viisil. Mõned retseptorid on võimelised katalüüsima keemiline reaktsioon, toimivad viimased ioonkanalitena, mis sulguvad või avanevad stiimuli mõjul. Mõned ühendid seovad spetsiifiliselt rakus olevaid vahemolekule.
Motoorsed polüpeptiidid
On terve klass valke, mis tagavad keha liikumise. Motoorsed valgud osalevad lihaste kokkutõmbumises, rakkude liikumises, lippude ja ripsmete tegevuses. Tänu neile teostatakse ka suunatud ja aktiivset transporti. Kinesiinid ja düneiinid teostavad molekulide ülekandmist mööda mikrotuubuleid, kasutades energiaallikana ATP hüdrolüüsi. Viimased liigutavad organelle ja muid elemente perifeersetest rakupiirkondadest tsentrosoomi suunas. Kinesiinid liiguvad vastupidises suunas. Dyneiinid vastutavad ka lippude ja ripsmete aktiivsuse eest.
- Kokkupuutel 0
- Google Plus 0
- Okei 0
- Facebook 0