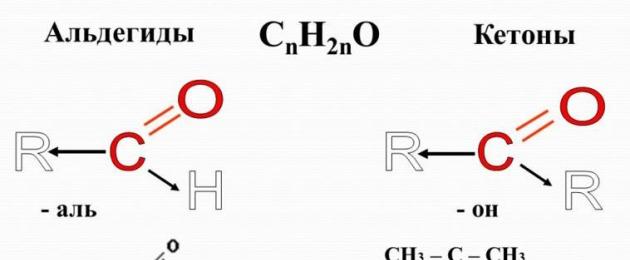
Aldehüüdid – orgaaniline aine, mille molekulid sisaldavad karbonüülrühma C=O, mis on ühendatud vesinikuaatomi ja süsivesiniku radikaaliga.
Aldehüüdid – orgaaniline aine, mille molekulid sisaldavad karbonüülrühma C=O, mis on ühendatud vesinikuaatomi ja süsivesiniku radikaaliga.
Aldehüüdide üldvalem on:

Lihtsaimas aldehüüdis, formaldehüüdis, mängib süsivesiniku radikaali rolli teine vesinikuaatom:

Vesinikuaatomiga seotud karbonüülrühma nimetatakse sageli kui aldehüüd:
Ketoonid- orgaanilised ained, mille molekulides on karbonüülrühm seotud kahe süsivesinikradikaaliga. Ilmselt on ketoonide üldine valem:

Ketoonide karbonüülrühma nimetatakse keto rühm.
Lihtsaimas ketoonis, atsetoonis, on karbonüülrühm seotud kahe metüülradikaaliga:

Aldehüüdide ja ketoonide nomenklatuur ja isomeeria
Sõltuvalt aldehüüdrühmaga seotud süsivesinikradikaali struktuurist eristatakse piiravaid, küllastumata, aromaatseid, heterotsüklilisi ja muid aldehüüde:

Vastavalt IUPAC nomenklatuurile moodustatakse aldehüüdide nimetused molekulis sama arvu süsinikuaatomite arvuga alkaani nimest, kasutades järelliidet -al. Näiteks:

Peaahela süsinikuaatomite numeratsioon algab aldehüüdrühma süsinikuaatomist. Seetõttu asub aldehüüdrühm alati esimese süsinikuaatomi juures ja selle asukohta pole vaja näidata.
Koos süstemaatilise nomenklatuuriga kasutatakse ka laialdaselt kasutatavate aldehüüdide triviaalseid nimetusi. Need nimetused on tavaliselt tuletatud aldehüüdidele vastavate karboksüülhapete nimedest.
Ketoonide nimetuse puhul süstemaatilise nomenklatuuri järgi tähistatakse ketorühma sufiksiga - kas ta on ja number, mis näitab karbonüülrühma süsinikuaatomi arvu (numeratsioon peaks algama ketorühmale lähimast ahela lõpust). Näiteks:
Aldehüüdidele on iseloomulik ainult üht tüüpi struktuurne isomeeria - süsinikskeleti isomeeria, mis on võimalik butanaalist, ja ketoonide puhul ka karbonüülrühma asukoha isomeeria. Lisaks iseloomustab neid ka klassidevaheline isomeeria (propanaal ja propanoon).

Aldehüüdide füüsikalised omadused
Aldehüüdi või ketooni molekulis tekib hapnikuaatomi suurema elektronegatiivsuse tõttu süsinikuaatomiga võrreldes side C=O tugevalt polariseeritud elektrontiheduse nihke tõttu π - sidemed hapnikuga:

Aldehüüdid ja ketoonid on polaarsed ained, mille hapnikuaatomil on liigne elektrontihedus. Aldehüüdide ja ketoonide seeria alumised liikmed (formaldehüüd, atseetaldehüüd, atsetoon) lahustuvad vees piiritult. Nende keemistemperatuurid on madalamad kui vastavatel alkoholidel. See on tingitud asjaolust, et aldehüüdide ja ketoonide molekulides pole erinevalt alkoholidest liikuvaid vesinikuaatomeid ja need ei moodusta vesiniksidemete tõttu assotsiatsioone. Madalamad aldehüüdid on terava lõhnaga; aldehüüdidel, mis sisaldavad ahelas nelja kuni kuut süsinikuaatomit, on ebameeldiv lõhn; kõrgematel aldehüüdidel ja ketoonidel on lillelõhn ja neid kasutatakse parfümeerias .

Aldehüüdide ja ketoonide keemilised omadused
Aldehüüdrühma olemasolu molekulis määrab aldehüüdidele iseloomulikud omadused.
1. Taastumise reaktsioonid.
Vesiniku lisamine aldehüüdi molekulidele toimub karbonüülrühma kaksiksideme kaudu. Aldehüüdide hüdrogeenimise saadus on primaarsed alkoholid, ketoonid on sekundaarsed alkoholid. Niisiis, kui atseetaldehüüdi hüdrogeenitakse nikkelkatalüsaatoril, moodustub etüülalkohol ja atsetooni hüdrogeenimisel propanool-2.

Aldehüüdide hüdrogeenimine- redutseerimisreaktsioon, mille käigus karbonüülrühma kuuluva süsinikuaatomi oksüdatsiooniaste väheneb.
2. Oksüdatsioonireaktsioonid. Aldehüüdid ei suuda mitte ainult taastuda, vaid ka oksüdeerida. Oksüdeerumisel moodustavad aldehüüdid karboksüülhappeid.
Õhu hapniku oksüdatsioon. Näiteks propioonhape moodustub propioonaldehüüdist (propaan):

Oksüdeerimine nõrkade oksüdeerivate ainetega(hõbeoksiidi ammoniaagilahus).

Kui anuma pind, milles reaktsioon läbi viiakse, oli eelnevalt rasvatustatud, katab reaktsiooni käigus tekkinud hõbe selle õhukese ühtlase kilega. Selgub imeline hõbedane peegel. Seetõttu nimetatakse seda reaktsiooni "hõbepeegli" reaktsiooniks. Seda kasutatakse laialdaselt peeglite, hõbeda- ja jõulukaunistuste valmistamiseks.
3. Polümerisatsioonireaktsioon:
n CH 2 \u003d O → (-CH 2 -O-) n paravormid n \u003d 8-12
Aldehüüdide ja ketoonide saamine

Aldehüüdide ja ketoonide kasutamine
Formaldehüüd(metanaal, sipelghape aldehüüd) H 2 C=O:
a) fenoolformaldehüüdvaikude saamiseks;
b) uurea-formaldehüüd (uurea) vaikude saamine;
c) polüoksümetüleenpolümeerid;
d) süntees ravimid(urotropiin);
e) desinfektsioonivahend;
f) bioloogiliste preparaatide säilitusaine (valgu voltimise võime tõttu).
Äädikhappe aldehüüd(etanaal, atseetaldehüüd) CH 3 CH \u003d O:
a) äädikhappe tootmine;
b) orgaaniline süntees.
Atsetoon CH3-CO-CH3:
a) lakkide, värvide, tselluloosatsetaatide lahusti;
b) toorained erinevate orgaaniliste ainete sünteesiks.
Äädikhappe aldehüüdi keemiline valem on CH3COH. Välimuselt on see värvitu, läbipaistev, terava lõhnaga, võib keeda juba toatemperatuuril 20 ° C, lahustub kergesti vees ja orgaanilistes ühendites. Kuna teadus ei seisa paigal, on nüüd atseetaldehüüdi saamine etüülalkoholist üsna lihtne.
Kahe põhiaine olemus

Atsetaldehüüd (etanaal) on looduses levinud, seda leidub toiduainetes ja enamikes taimedes. Etanaal on ka autode heitgaaside ja sigaretisuitsu komponent, seega kuulub see tugevate mürgiste ainete kategooriasse. Seda saab kunstlikult sünteesida erinevatel viisidel. Kõige populaarsem meetod on atseetaldehüüdi saamine etüülalkoholist. Katalüsaatorina kasutatakse vaskoksiidi (või hõbedat). Reaktsiooni käigus tekib aldehüüd, vesinik ja vesi.
Etüülalkohol (etanool) on tavaline toiduainete C2H5OH. Seda kasutatakse laialdaselt alkohoolsete jookide valmistamisel, meditsiinis desinfitseerimiseks, kodukeemia, parfüümide, hügieenitoodete ja muude asjade tootmisel.
Etüülalkoholi looduses ei leidu, seda toodetakse kasutades keemilised reaktsioonid. Peamised meetodid aine saamiseks on järgmised:

- Käärimine: teatud puu- või köögiviljad puutuvad kokku pärmiga.
- Tootmine tööstuslikes tingimustes (väävelhappe kasutamine).
Teine meetod annab suurema etanooli kontsentratsiooni. Esimest võimalust kasutades on võimalik saavutada ainult umbes 16% sellest ainest.
Meetodid atseetaldehüüdi saamiseks etanoolist
Etüülalkoholist atseetaldehüüdi saamise protsess toimub järgmise valemi järgi: C2H5OH + CuO = CH3CHO + Cu + H2O
Sel juhul kasutatakse etanooli ja vaskoksiidi, kõrge temperatuuri mõjul toimub oksüdatsioonireaktsioon ja saadakse atseetaldehüüd.
Aldehüüdi saamiseks on ka teine meetod - alkoholi dehüdrogeenimine. See ilmus umbes 60 aastat tagasi ja on endiselt populaarne. Dehüdrogeenimisel on palju positiivseid omadusi:

- ei eraldu atmosfääri mürgitavaid mürgiseid toksiine;
- mugavad ja ohutud reaktsioonitingimused;
- reaktsiooni käigus eraldub vesinik, mida saab samuti kasutada;
- pole vaja kulutada raha lisakomponentidele - piisab ühest etüülalkoholist.
Aldehüüdi saamine sellel meetodil toimub järgmiselt: etanool kuumutatakse neljasaja kraadini ja vesinik väljub sellest katalüütiliselt. Protsessi valem näeb välja selline: C2H5OH ͢ CH3CHO + H2.
Vesiniku elimineerimine toimub tänu kõrge temperatuur ja madal rõhk. Niipea, kui temperatuur langeb ja rõhk tõuseb, naaseb H2 ja atseetaldehüüd muutub taas alkoholiks.
Dehüdratsioonimeetodi kasutamisel kasutatakse ka vase või tsingi katalüsaatorit. Vask on sel juhul väga aktiivne aine, mis võib reaktsiooni käigus aktiivsust kaotada. Seetõttu valmistatakse segu vasest, koobaltist ja kroomoksiidist ning kantakse seejärel asbestile. See võimaldab reaktsiooni läbi viia temperatuuril 270–300 °C. Sel juhul ulatub etanooli muundumine 34–50%.
Optimaalse meetodi määramine

Kui võrrelda alkoholi oksüdatsiooni meetodit dehüdratsioonimeetodiga, siis teisel on selge eelis, kuna see toodab palju vähem toksilisi aineid ja samal ajal registreeritakse kontaktgaasides kõrge etanaali kontsentratsioon. Need gaasid sisaldavad dehüdreerituna ainult atseetaldehüüdi ja vesinikku ning oksüdeerituna lämmastikuga lahjendatud etanooli. Seetõttu on atseetaldehüüdi lihtsam saada kontaktgaasidest ja selle kaod on palju väiksemad kui oksüdatsiooniprotsessis.

Veel üks oluline dehüdratsioonimeetodi kvaliteet on see, et saadud ainet kasutatakse äädikhappe tootmiseks. Selleks võtke elavhõbesulfaat ja vesi. Reaktsioon saadakse järgmise skeemi järgi: CH3CHO + HgSO4 + H2O = CH3COOH + H2SO4 + Hg.
Reaktsiooni lõpuleviimiseks lisatakse raudsulfaati, mis elavhõbedat oksüdeerib. Äädikhappe eraldamiseks saadud lahus filtreeritakse ja lisatakse leeliseline lahus.
Kui valmis HgSO4 (anorgaaniline ühend metallisoolast ja väävelhappest) pole, siis valmistatakse see iseseisvalt. 4 osale väävelhappele on vaja lisada 1 osa elavhõbedaoksiidi.
Täiendav viis

Atsetaldehüüdi saamiseks on veel üks viis. Seda kasutatakse saadud alkoholi kvaliteedi määramiseks. Selle rakendamiseks vajate: fuksia väävelhapet, etüülalkoholi ja kroomisegu (K2Cr2O7 + H2SO4).
Kroomisegu (2 ml) valatakse kuiva kolbi, asetatakse keemiskivi ja lisatakse etüülalkohol (2 ml). Toru kaetakse gaaside väljalaskmiseks mõeldud toruga ja teine ots sisestatakse fuksia väävelhappega anumasse. Segu kuumutatakse, mille tulemusena muutub selle värvus roheliseks. Reaktsiooni käigus etanool oksüdeerub ja muutub atseetaldehüüdiks, mis läbib toru aurudena ja langedes koos fuksia väävelhappega katseklaasi, muudab selle karmiinpunaseks.
ATSETEKALDEHÜÜD (atseetaldehüüd, etanaal) - alifaatne aldehüüd, CH3CHO; metaboliit, mis tekib alkoholkäärimisel, etüülalkoholi oksüdatsioonil, sh inimkehas, ja muudes metaboolsetes reaktsioonides. W. a. kasutatakse erinevate ravimite (vt.), äädikhappe (vt), peräädikhappe CH 3 COOOH, äädikhappe anhüdriidi (CH 3 CO) 2 O, etüülatsetaadi, samuti sünteetiliste vaikude jms tootmisel. Asjaomastes tööstusharudes on tööalane oht.
W. a. on terava lõhnaga värvitu vedelik, t° pl -123,5°, t° kip 20,2°, suhteline tihedus 20° juures 0,783, murdumisnäitaja 20° juures 1,3316, kontsentratsioon plahvatuspiirid (CEF) 3, 97 - 57%. Vee, etüülalkoholi, eetri ja teiste orgaaniliste lahustitega U. a. segatakse mis tahes vahekorras.
W. a. osaleb kõigis aldehüüdidele iseloomulikes reaktsioonides (vt), eelkõige oksüdeerub äädikhappeks, läbib aldooli ja krotoni kondenseerumist, moodustab Tištšenko reaktsiooni järgi äädikhappe etüülestri ja karbonüülrühmas aldehüüdidele iseloomulikke derivaate. U. hapete ja. polümeriseerub metalldehüüdi või vedela paraldehüüdi tsükliliseks kristalseks tetrameeriks. Tööstuslikus mastaabis U. ja. saada atsetüleeni (vt.) hüdratatsiooni katalüsaatorite - elavhõbeda soolade, etüülalkoholi oksüdeerimise (vt) juuresolekul ja kõige ökonoomsemat viisi - etüleeni oksüdeerimist (vt süsivesinikud) pallaadiumi katalüsaatori juuresolekul.
Kvalitatiivne tuvastamine U. ja. põhineb sinise värvumise ilmnemisel U. a. interaktsiooni tulemusena. naatriumnitroprussiidiga amiinide juuresolekul. Kvantitatiivne määratlus seisneb mis tahes tuletise At. ja vastuvõtmises. karbonüülrühma ja selle massi, mahu (vt Titrimeetriline analüüs) või kolorimeetrilise määramise (vt Kolorimeetria) järgi.
U. haridus ja. ainevahetuse vaheproduktina esineb nii taime- kui ka loomorganismides. Etüülalkoholi muundamise esimene etapp inimese ja looma kehas on selle oksüdeerimine U. a. alkoholdehüdrogenaasi juuresolekul (vt.). W. a. see tekib ka püruvaadi (vt. Püruviinhape) dekarboksüleerimisel (vt.) alkoholkäärimisel ja treoniini lagunemisel (vt) treoniini aldolaasi (EC 4.1.2.5) toimel. Inimkehas U. a. oksüdeeritud äädikhappeks Ch. arr. maksas NAD-sõltuva aldehüüdoksüdaasi (EC 1.2.3. 1), atseetaldehüüdoksüdaasi ja ksantokinaasi toimel. W. a. osaleb treoniini biosünteesis glütsiinist (vt.). Narkootikumides. Praktikas põhineb nende kasutamine (vt) selle ravimi võimel spetsiifiliselt blokeerida atseetaldehüüdoksüdaasi, mis viib U. a. veres akumuleerumiseni. ja selle tulemusena tugev vegetatiivne reaktsioon - perifeersete veresoonte laienemine, südamepekslemine, peavalu, lämbumine, iiveldus.
Äädikhappe aldehüüd töökeskkonna ohuna
Hroni juures. mõju inimesele madala kontsentratsiooniga aurud U. ja. tähele ülemiste hingamisteede ja sidekesta limaskestade mööduvat ärritust. Paarid U. a. sissehingatavas õhus suurtes kontsentratsioonides põhjustavad südame löögisageduse suurenemist, suurenenud higistamist; aurude terava ärritava toime tunnused U. a. nendel juhtudel need intensiivistuvad (eriti öösel) ja võivad kaasneda lämbumise, kuiva, valuliku köha ja peavaluga. Sellise mürgistuse tagajärjed on bronhiit ja kopsupõletik.
Kokkupuude vedelikuga nahaga U. a. võib põhjustada selle hüpereemiat ja infiltraatide ilmnemist.
Esmaabi ja kiirabi
U. paaridega mürgituse korral a. kannatanu tuleb viia värske õhu kätte, võimaldada vajadusel ammoniaagiga veeauru sissehingamist - niisutatud hapniku sissehingamine, südameravimid, hingamist stimulaatorid (lobeliin, tsütotoon), palderjanitinktuur, broomipreparaadid. Hingamisteede limaskestade terava ärrituse korral - leeliselised või õli sissehingamised. Valuliku köhaga - kodeiin, etüülmorfiinvesinikkloriid (dioniin), sinepiplaastrid, purgid. Kui sidekesta on ärritunud, peske silmi rohke vee või isotoonilise naatriumkloriidi lahusega. Mürgistuse korral suu kaudu - koheselt maoloputus veega, millele on lisatud ammoniaagilahust (ammoniaak), 3% naatriumvesinikkarbonaadi lahust. Edasine ravi on sümptomaatiline. Tabamisel U. ja. nahale - kahjustatud ala viivitamatu pesemine veega, kuid parem 5% ammoniaagi lahusega.
Ohver tuleb kahjulike ainetega töölt kõrvaldada kuni paranemiseni (vt Kutsehaigused).
Mürgistuse ennetamise meetmed U. a. seisnevad seadmete tihendamises, ventilatsiooni tõrgeteta töötamises (vt), täitmise ja transpordi tööde mehhaniseerimises ja automatiseerimises U. ja. Kauplus U. a. nõutav hermeetiliselt suletud mahutites. Tööstuses ja laborites, mis on seotud USA-ga kokkupuutumisega, tuleb rangelt järgida isikliku hügieeni meetmeid, kasutada spetsiaalseid riideid ja jalatseid, kaitseprille ja universaalseid respiraatoreid.
Aurude suurim lubatud kontsentratsioon U. a. tööpiirkonna õhus 5 mg / m 3.
Bibliograafia: Kahjulikud ained tööstuses, toim. N. V. Lazareva ja E. N. Levina, 1. kd, L., 1976; Lebedev N. N. Orgaanilise ja naftakeemilise põhisünteesi keemia ja tehnoloogia, M., 1981; White A. jt Biokeemia alused, tlk. inglise keelest, kd 1-3, M., 1981,
A. N. Klimov, D. V. Ioffe; N. G. Budkovskaja (hiiglane).,
Äädikhappe aldehüüd kuulub orgaaniliste ühendite hulka ja kuulub aldehüüdide klassi. Millised omadused sellel ainel on ja milline näeb välja atseetaldehüüdi valem?
üldised omadused
Äädikhappe aldehüüdil on mitu nimetust: atseetaldehüüd, etanaal, metüülformaldehüüd. See ühend on äädikhappe ja etanooli aldehüüd. Selle struktuurivalem on järgmine: CH3-CHO.

Riis. üks. Keemiline valem atseetaldehüüd.
Selle aldehüüdi eripäraks on see, et seda leidub nii looduses kui ka seda toodetakse kunstlikult. Tööstuses võib selle aine tootmismaht olla kuni 1 miljon tonni aastas.
Etanaali leidub toiduainetes nagu kohv, leib, samuti sünteesivad taimed seda ainevahetuse käigus.
Äädikhappe aldehüüd on terava lõhnaga värvitu vedelik. Vees, alkoholis ja eetris lahustuv. On mürgine.

Riis. 2. Äädikhappe aldehüüd.
Vedelik keeb üsna madalal temperatuuril - 20,2 kraadi Celsiuse järgi. Seetõttu on probleeme selle ladustamise ja transportimisega. Seetõttu säilitatakse ainet paraldehüüdina ja sellest saadakse vajadusel atseetaldehüüdi, kuumutades seda väävelhappega (või mõne muu mineraalhappega). Paraldehüüd on äädikhappe tsükliline trimeer.
Kuidas saada
Äädikhappe aldehüüdi võib saada mitmel viisil. Kõige tavalisem variant on etüleeni oksüdeerimine või, nagu seda meetodit nimetatakse ka, Wackeri protsess:
2CH2 = CH2 + O2-2CH3CHO
Selles reaktsioonis on oksüdeerijaks pallaadiumkloriid.
Atsetaldehüüdi võib saada ka atsetüleeni reageerimisel elavhõbedasooladega. See reaktsioon kannab vene teadlase nime ja seda nimetatakse Kutšerovi reaktsiooniks. Keemilise protsessi tulemusena tekib enool, mis isomeriseerub aldehüüdiks
C 2 H 2 + H 2 O \u003d CH 3 CHO

Riis. 3. M. G. Kucherovi portree.
MÄÄRATLUS
Aldehüüdid- karbonüülühendite klassi kuuluvad orgaanilised ained, mis sisaldavad oma koostises funktsionaalset rühma -CH \u003d O, mida nimetatakse karbonüüliks.
Aldehüüdide ja ketoonide piiramise üldvalem on C n H 2 n O. Aldehüüdide nimetuses esineb järelliide –al.
Aldehüüdide lihtsaimad esindajad on formaldehüüd (formaldehüüd) -CH 2 \u003d O, atseetaldehüüd (äädikhappe aldehüüd) - CH 3 -CH \u003d O. On tsüklilisi aldehüüde, näiteks tsükloheksaan-karbaldehüüd; aromaatsetel aldehüüdidel on triviaalsed nimed - bensaldehüüd, vanilliin.
Karbonüülrühma süsinikuaatom on sp 2 hübridisatsiooni olekus ja moodustab 3σ sidet (kaks C-H sidet ja üks C-O side). π-side moodustavad süsiniku- ja hapnikuaatomite p-elektronid. Kaksikside C = O on σ- ja π-sidemete kombinatsioon. Elektroni tihedus nihkub hapnikuaatomi poole.
Aldehüüde iseloomustab süsinikskeleti isomeeria, samuti klassidevaheline isomeeria ketoonidega:
CH3-CH2-CH2-CH \u003d0 (butanaal);
CH3-CH(CH3)-CH = O (2-metüülpentanaal);
CH3-C (CH2-CH3) \u003d O (metüületüülketoon).
Aldehüüdide keemilised omadused
Aldehüüdi molekulides on mitu reaktsioonikeskust: elektrofiilne tsenter (karbonüüli süsinikuaatom), mis osaleb nukleofiilsetes liitumisreaktsioonides; põhikeskus on hapnikuaatom, millel on jagamata elektronpaarid; α-CH happekeskus, mis vastutab kondensatsioonireaktsioonide eest; S-N ühendus oksüdatsioonireaktsioonides rebenenud.
1. Lisamisreaktsioonid:
- kalliskivide dioolide moodustumisega vesi
R-CH = O + H2O ↔ R-CH (OH) -OH;
- alkoholid koos poolatsetaalide moodustumisega
CH3-CH \u003d O + C2H5OH ↔CH3-CH(OH)-O-C2H5;
- tioolid koos ditioatsetaalide moodustumisega (happelises keskkonnas)
CH3-CH \u003d O + C2H5SH↔ CH3-CH (SC2H5)-SC2H5 + H2O;
- naatriumvesiniksulfit koos naatrium-α-hüdroksüsulfonaatide moodustumisega
C2H5-CH \u003d O + NaHS03 ↔ C2H5-CH (OH) -SO3Na;
- amiinid N-asendatud imiinide moodustamiseks (Schiffi alused)
C 6 H 5 CH \u003d O + H 2 NC 6 H 5 ↔ C 6 H 5 CH \u003d NC 6 H 5 + H 2 O;
- hüdrasiinid koos hüdrasoonide moodustumisega
CH3-CH \u003d O + 2 HN-NH2 ↔ CH3-CH = N-NH2 + H2O;
- tsüaniidvesinikhape koos nitriilide moodustumisega
CH3-CH \u003d O + HCN ↔ CH3-CH(N)-OH;
- taastumine. Kui aldehüüdid reageerivad vesinikuga, saadakse primaarsed alkoholid:
R-CH \u003d O + H2 → R-CH2-OH;
2. Oksüdatsioon
- "hõbepeegli" reaktsioon - aldehüüdide oksüdeerimine hõbeoksiidi ammoniaagilahusega
R-CH = O + Ag2O → R-CO-OH + 2Ag ↓;
- aldehüüdide oksüdeerimine vask(II)hüdroksiidiga, mille tulemusena sadestub punase vask(I)oksiidi sade
CH 3 -CH \u003d O + 2Cu (OH) 2 → CH 3 -COOH + Cu 2 O ↓ + 2H 2 O;
Need reaktsioonid on kvalitatiivsed reaktsioonid aldehüüdide jaoks.
Aldehüüdide füüsikalised omadused
Esimene esindaja homoloogne seeria aldehüüdid - formaldehüüd (formaldehüüd) - gaasiline aine (n.o.), hargnemata struktuuri ja koostisega aldehüüdid C 2 -C 12 - vedelikud, C 13 ja pikemad - tahked ained. Mida rohkem süsinikuaatomeid sisaldab sirge ahelaga aldehüüd, seda kõrgem on selle keemispunkt. Koos tõusuga molekulmass aldehüüdid, nende viskoossuse, tiheduse ja murdumisnäitaja väärtused suurenevad. Formaldehüüd ja atseetaldehüüd on võimelised segunema veega piiramatus koguses, kuid süsivesinike ahela kasvades see aldehüüdide võime väheneb. Madalamatel aldehüüdidel on terav lõhn.
Aldehüüdide saamine
Aldehüüdide saamise peamised meetodid:
- alkeenide hüdroformüülimine. See reaktsioon seisneb CO ja vesiniku lisamises alkeenile teatud VIII rühma metallide karbonüülide, näiteks oktakarbonüüldikoobalti (Co 2 (CO) 8) juuresolekul. Reaktsioon viiakse läbi kuumutades temperatuurini 130 °C ja rõhul 300 atm
CH3-CH \u003d CH2 + CO + H2 → CH3-CH2-CH2-CH = O + (CH3)2CHCH = O;
— alküünide hüdratsioon. Alküünide interaktsioon veega toimub elavhõbeda (II) soolade juuresolekul ja happelises keskkonnas:
HC≡CH + H20 → CH3-CH = O;
- primaarsete alkoholide oksüdatsioon (reaktsioon kulgeb kuumutamisel)
CH3-CH2-OH + CuO → CH3-CH \u003d O + Cu + H2O.
Aldehüüdide kasutamine
Aldehüüdid on leidnud laialdast rakendust erinevate toodete sünteesi toorainena. Niisiis toodab formaldehüüd (suurtootmine) mitmesuguseid vaiku (fenoolformaldehüüd jne), ravimeid (urotropiin); atseetaldehüüd on tooraine äädikhappe, etanooli, erinevate püridiini derivaatide jne sünteesiks. Parfümeerias kasutatakse koostisainetena palju aldehüüde (võihape, kaneel jne).
Näited probleemide lahendamisest
NÄIDE 1
| Ülesanne | Broomimine n H 2-ga n +2 andis 9,5 g monobromiidi, mis NaOH lahjendatud lahusega töödeldes muutus hapnikku sisaldavaks ühendiks. Selle aurud koos õhuga juhitakse üle punakuuma vaskvõre. Kui saadud uut gaasilist ainet töödeldi Ag20 ammoniaagilahuse liiaga, eraldus 43,2 g sadet. Millist süsivesinikku ja millises koguses võeti, kui broomimisetapi saagis on 50%, ülejäänud reaktsioonid kulgevad kvantitatiivselt. |
| Lahendus | Kirjutame üles kõigi toimuvate reaktsioonide võrrandid: CnH2n+2 + Br2 = CnH2n+1Br + HBr; C n H 2n+1 Br + NaOH = C n H 2n+1 OH + NaBr; CnH2n+1OH → R-CH = O; R-CH \u003d O + Ag 2 O → R-CO-OH + 2Ag ↓. Viimases reaktsioonis eralduv sade on hõbe, seega leiate hõbeda vabanenud aine koguse: M(Ag) = 108 g/mol; v(Ag) \u003d m / M \u003d 43,2 / 108 \u003d 0,4 mol. Vastavalt probleemi seisukorrale tekkis reaktsioonis 2 saadud aine laskmisel üle kuuma metallvõre gaas, mille ainsaks gaasiks aldehüüdiks on metanaal, seega on lähteaineks metaan. CH 4 + Br 2 \u003d CH 3 Br + HBr. Bromometaani aine kogus: v (CH3Br) \u003d m / M \u003d 9,5/95 \u003d 0,1 mol. Seejärel on 50% bromometaani saagiseks vajalik metaani kogus 0,2 mol. M (CH4) \u003d 16 g/mol. Siit tuleneb metaani mass ja maht: m(CH4) = 0,2 × 16 = 3,2 g; V (CH 4) \u003d 0,2 × 22,4 \u003d 4,48 l. |
| Vastus | Metaani mass - mass 3,2 g, metaani maht - 4,48 l |
NÄIDE 2
| Ülesanne | Kirjutage reaktsioonivõrrandid, mille abil saab läbi viia järgmisi teisendusi: buteen-1 → 1-bromobutaan + NaOH → A - H 2 → B + OH → C + HCl → D. |
| Lahendus | 1-bromobutaani saamiseks buteen-1-st on vaja läbi viia hüdrobroomimisreaktsioon peroksiidühendite R 2 O 2 juuresolekul (reaktsioon kulgeb Markovnikovi reegli kohaselt): CH3-CH2-CH \u003d CH2 + HBr → CH3-CH2-CH2-CH2Br. Leelise vesilahusega suhtlemisel hüdrolüüsub 1-bromobutaan, mille käigus moodustub butanool-1 (A): CH3-CH2-CH2-CH2Br + NaOH → CH3-CH2-CH2-CH2OH + NaBr. Butanool-1 moodustab dehüdrogeenimise ajal aldehüüdi - butanaali (B): CH3-CH2-CH2-CH2OH → CH3-CH2-CH2-CH \u003d O. Hõbeoksiidi ammoniaagilahus oksüdeerib butanaali ammooniumsoolaks - ammooniumbutüraadiks (C): CH3-CH2-CH2-CH \u003d O + OH → CH3-CH2-CH2-COONH4 + 3NH3 + 2Ag ↓ + H2O. Ammooniumbutüraat moodustab vesinikkloriidhappega suhtlemisel või(butaan)happe (D): CH3-CH2-CH2-COONH4 + HCl → CH3-CH2-CH2-COOH + NH4Cl. |
- Kokkupuutel 0
- Google Plus 0
- Okei 0
- Facebook 0