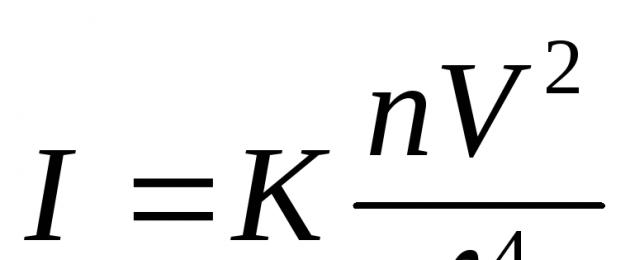Häguses keskkonnas hajuvad kõige rohkem violetne ja sinine valgus, kõige vähem aga oranž ja punane valgus.
Tyndalli efekt avastati tänu teadlastele, kes uurisid valguskiirte koostoimet erinevate meediumitega. Ta leidis, et kui valguskiired läbivad keskkonda, mis sisaldab kõige väiksemate tahkete osakeste suspensiooni – näiteks tolmune või suitsune õhk, kolloidsed lahused, hägune klaas –, siis hajumise efekt väheneb, kui kiirte spektraalvärvus muutub violetsest siniseks. kollakaspunane osa spektrist. Kui seevastu valge valgus, näiteks päikesevalgus, lastakse läbi häguse keskkonna, mis sisaldab kogu värvispektrit, siis spektri sinises osas on valgus osaliselt hajutatud, samas kui rohekaskollase intensiivsus. -punane osa valgusest jääb praktiliselt samaks. Seetõttu, kui vaatame hajutatud valgust pärast seda, kui see on valgusallikast eemal häguse keskkonna läbinud, tundub see meile sinisem kui algne valgus. Kui vaatame valgusallikat mööda hajumisjoont, st läbi häguse keskkonna, tundub allikas meile punasem, kui see tegelikult on. Seetõttu tundub meile näiteks metsatulekahjudest tulenev udu sinakaslillana.
Tyndalli efekt tekib hõljuvate osakeste hajumisel, mille suurus ületab kümneid kordi aatomite suurust. Kui suspensiooni osakesi suurendatakse suurusjärgus 1/20 valguse lainepikkusest (alates umbes 25 nm ja üle selle), muutub hajumine polükroomne, see tähendab, et valgus hakkab ühtlaselt hajuma üle kogu nähtava värvivahemiku violetsest punaseni. Selle tulemusena kaob Tyndalli efekt. Seetõttu tunduvad tihedad udu- või rünkpilved meile valged – need koosnevad tihedast veetolmu suspensioonist, mille osakeste läbimõõt on mikronitest millimeetriteni, mis on tunduvalt üle Tyndalli hajumise künnise.
Võib arvata, et taevas tundub meile Tyndalli efekti tõttu sinine, kuid see pole nii. Pilvede või suitsu puudumisel muutub taevas sinakassiniseks "päevavalguse" hajumise tõttu õhumolekulidele. Seda tüüpi hajumist nimetatakse Rayleighi hajumine(Sir Rayleigh auks; cm. Rayleighi kriteerium). Rayleighi hajumine hajutab sinist ja sinist valgust isegi rohkem kui Tyndalli efekt: näiteks sinine valgus lainepikkusega 400 nm hajub puhtas õhus üheksa korda tugevamini kui punane valgus lainepikkusega 700 nm. Seetõttu paistab taevas meile sinine päikesevalgus hajub üle kogu spektrivahemiku, kuid spektri sinises osas on see peaaegu suurusjärgu võrra tugevam kui punases. Päikesepõletust põhjustavad ultraviolettkiired on veelgi hajutatud. Seetõttu jaotub päevitus üsna ühtlaselt üle keha, kattes ka need nahapiirkonnad, mis otsese päikesevalguse kätte ei puutu.
John Tyndall, 1820-93
Iiri füüsik ja insener. Sündis Laylin Bridge'is, Carlow' krahvkonnas (Leighlin Bridge, Carlow' krahvkond). Lõpus Keskkool töötas topograaf-geodeesina sõjalistes organisatsioonides ja ehituses raudteed. Samal ajal lõpetas ta Prestoni Mehaanikainstituudi. Vallandati sõjaväegeodeetilisest teenistusest halbade töötingimuste vastu protestimise pärast. Ta õpetas Quinwoodi kolledžis (Hampshire), jätkates samal ajal eneseharimist. Aastatel 1848-51. kuulas loenguid Marburgi ja Berliini ülikoolides. Inglismaale naastes sai temast õpetaja ja seejärel professor Londoni Kuninglikus Instituudis (Royal Institution). Teadlase põhitööd on pühendatud magnetismile, akustikale, gaaside ja aurude soojuskiirguse neeldumisele, valguse hajutamisele häguses keskkonnas . Uuris liustike ehitust ja liikumist Alpides.
Tyndall oli teaduse populariseerimise ideest äärmiselt kirglik. Ta pidas regulaarselt avalikke loenguid, sageli kõigile tasuta loengutena: lõuna ajal vabrikuhoovides töötajatele, Kuninglikus Instituudis jõululoenguid lastele. Tyndalli kui populariseerija kuulsus jõudis ka teisele poole Atlandi ookeani – kogu tema raamatu Fragments of Science (Fragments of Science) Ameerika väljaande tiraažini. Teadus, 1871) müüdi läbi ühe päevaga. Hukkus 1893. aastal naeruväärne surm: õhtusööki valmistades kasutas teadlase naine (kes elas ta 47 aasta võrra kauem) eksikombel lauasoola asemel kasutusele ühte köögis hoitud kemikaalidest.
Valguse hajumine. Klassikalisest vaatenurgast on valguse hajumine see
Aine läbivad elektromagnetlained põhjustavad aatomites elektronide võnkumisi. Selgitus: kui osakeste suurus on väike, siis elektronid, mis moodustavad
sunnitud vibratsioonid aatomites on samaväärsed võnkuva dipooliga. See dipool võngub sellele langeva valguslaine sagedusega. Seega hajub spektri lühikese lainepikkusega osa palju intensiivsemalt kui pika lainepikkusega osa. Sinine valgus hajub peaaegu 5 korda intensiivsemalt kui punane. Seetõttu on hajutatud valgus sinine ja läbiv valgus punakas. Väga kõrgel (sadadel kilomeetritel) on atmosfäärimolekulide kontsentratsioon väga madal, hajumine praktiliselt kaob, taevas peaks paistma must ja Päikese juuresolekul on näha tähed. Kell kosmoselennud Kõik need ennustused said täielikult kinnitust.
Rayleigh-Jeansi seadus on musta keha tasakaalulise kiirgustiheduse ja musta keha kiirguse kiirguse seadus.
Tyndalli efekt, Tyndall scattering (ing. Tyndall effect) - optiline efekt, valguse hajumine, kui valguskiir läbib optiliselt ebahomogeenset keskkonda. Tavaliselt nähakse hõõguvat koonust ( Tyndalli koonus) nähtav tumedal taustal.
See on tüüpiline kolloidsüsteemide lahustele (näiteks soolid, metallid, lahjendatud lateksid, tubakasuits), milles osakesed ja nende keskkond erinevad murdumisnäitaja poolest.
Nefelomeetria on meetod aine uurimiseks ja analüüsimiseks antud aine hõljuvate osakeste poolt hajutatud valgusvoo intensiivsuse järgi.
Meetodi olemus
Hajutatud valgusvoo intensiivsus sõltub paljudest teguritest, eelkõige osakeste kontsentratsioonist analüüsitavas proovis. Nefelomeetrias on suur tähtsus valgust hajutavate osakeste mahul. Nefelomeetrias kasutatavate reaktsioonide oluline nõue on, et reaktsiooniprodukt peab olema praktiliselt lahustumatu ja suspensioon (suspensioon). Tahkete osakeste suspensioonis hoidmiseks kasutatakse erinevaid stabilisaatoreid (nt želatiini), mis takistavad osakeste koagulatsiooni.
50. Kehade soojuskiirgus. Musta keha kiirguse seadused (Stefan-Boltzmann, Wien).
Kõigi looduskehade vahel toimub lõputu energiavahetuse protsess. Kehad kiirgavad ja neelavad pidevalt energiat. Kui aatomite ergastumine toimub nende kokkupõrke tagajärjel sama keha teiste aatomitega soojusliikumise protsessis, siis nimetatakse tekkivat elektromagnetkiirgust termiliseks.
Soojuskiirgus tekib igal temperatuuril. Sellisel juhul kiirgab keha olenemata temperatuurist eranditult kõik lainepikkused, s.t. soojuskiirguse spekter on pidev ja ulatub nullist lõpmatuseni. Mida kõrgem on aga temperatuur, seda rohkem on lühilainekiirgus kiirgusspektris põhiline. Elektromagnetlainete emissioon keha poolt toimub samaaegselt ja sõltumatult nende neeldumisega.
Keha, mis neelab täielikult energiat kogu lainepikkuse vahemikus, s.o. mille puhul α = 1 nimetatakse absoluutselt mustaks (mustaks)
STEFAN-BOLTZMANNI SEADUS. Viini nihkeseadus
Stefan ja Boltzmann said musta keha energia heleduse tervikliku avaldise, mis ei võta arvesse energia jaotust lainepikkustel:
R \u003d σT 4, σ on Stefan-Boltzmanni konstant (σ \u003d 5,6696 10 -8 W / (m 2 K 4)).
Hallide kehade puhul lubab Kirchhoffi seadus kirjutada r λ = α λ ε λ , siis hallide kehade energiaheleduse jaoks on meil: .
Kõveraid analüüsides leidis Win, et lainepikkus, mis moodustab energia heleduse maksimaalse spektraaltiheduse, on määratud seosega: .
See on Wieni seadus, kus b = 0,28978·10 -2 m·K on Wieni konstant.
Määrame lainepikkuse väärtuse, mille jaoks ε λ on maksimaalne väärtus antud temperatuuril, suhte alusel. Ekstreemsuse leidmise reeglite kohaselt kehtib see . Arvutused näitavad, et see juhtub, kui λ = b/T.
Seosest on näha, et temperatuuri tõustes nihkub lainepikkus, mis moodustab täiesti musta keha maksimaalse kiirgusvõime, lühikese lainepikkuse piirkonda. Sel põhjusel on suhe teaduskirjanduses tuntud ka kui Wieni nihkeseadus. See seadus kehtib ka hallide kehade kohta.
Stefan-Boltzmanni ja Wieni seadused võimaldavad määrata nende temperatuure keha poolt kiiratava energia mõõtmise põhjal. Seda füüsikaharu nimetatakse optiliseks püromeetriaks.
Sõltuvalt nähtava valguse lainepikkusest ja hajutatud faasi osakeste suhtelisest suurusest omandab valguse hajumine erineva iseloomu.
Kui osakeste suurus on väiksem kui langeva valguse poollainepikkus, täheldatakse difraktsioonivalguse hajumist; valgus justkui möödub (mähkib) teel kohatud osakestest. Sel juhul toimub osaline hajumine igas suunas lahknevate lainetena (joon. 8). Valguse hajumise tulemusena on iga osake uute, vähemintensiivsemate lainete allikaks, st tekib justkui iga osakese iseluminestsents. Väikeste osakeste valguse hajumise nähtust nimetatakse opalestsentsiks. See on iseloomulik peamiselt soolidele (vedel ja tahke aine), seda täheldatakse ainult peegeldunud valguses, st küljelt või tumedal taustal. See nähtus väljendub sooli mõningase hägususes ja selle värvi muutumises (“ülevoolus”) võrreldes läbiva valguse värviga. Värvimine peegeldunud valguses nihutatakse reeglina spektri nähtava osa kõrgema sageduse poole. Niisiis, valged soolid (hõbekloriidsool, kampol jne) opalestseeruvad sinaka värvusega.
Faraday-Tyndalli efekt (joonis 9).
Värvimine.
Hajutatud valguse intensiivsuse sõltuvus ( ma) ülaltoodud efektide jaoks väljendatakse Rayleighi valemiga:  kus: ma– ja hajutatud valguse intensiivsus langeva kiire suunas ┴; TO– konst, sealhulgas keskkonna ja faasi murdumisnäitaja, n on osakeste arv ruumalaühiku kohta,
on langeva valguse lainepikkus,
kus: ma– ja hajutatud valguse intensiivsus langeva kiire suunas ┴; TO– konst, sealhulgas keskkonna ja faasi murdumisnäitaja, n on osakeste arv ruumalaühiku kohta,
on langeva valguse lainepikkus,
V on iga osakese maht.
Seda on valemist näha ma et lühemate lainepikkuste hajumine toimub intensiivsemalt, seetõttu paistavad värvitud soolid läbiva valguse korral punased ja hajutatud valguses sinised.
6. Kolloidsed lahused on suhteliselt vähem stabiilsed kui molekulaarsed lahused. Erinevate tegurite mõjul t 0 , h V, elekter, FROM, mehaaniline mõju, lisandite olemasolu) ja mõnikord, lihtsalt ilma nähtava põhjuseta, toimuvad kolloidsüsteemides pöördumatud protsessid, mis põhjustavad muutusi hajutatud faasi osakestes ja nende sadenemises. Selliseid osakeste spontaanse tugevnemiseni viivaid protsesse nimetatakse vananemine.
Kuigi kolloidsüsteemide puhul saame rääkida ainult N.P suhtelisest stabiilsusest. Peskov tutvustas mõistet kineetiline Ja agregatiivne jätkusuutlikkus.
Kineetiline stabiilsus- hajutatud osakeste võime hoida Browni liikumise mõjul suspensioonis. Lisaks Browni liikumisele on kineetilise stabiilsuse teguriteks dispersioon, dispergeeritud keskkonna viskoossus, dispergeeritud keskkonna ja faasi tiheduse erinevus jne. Kõigist teguritest on kõige olulisem hajumine, kuna see on nii suurim mõju osakeste settimise kiiruse kohta. Nimetatakse süsteeme, milles settimismäär on väga madal kineetiliselt stabiilne.
Agregatiivne stabiilsus– dispergeeritud faasi osakeste võimet seista vastu kokkukleepumist ja seeläbi säilitada teatud dispersiooniaste. Agregatiivse stabiilsuse kaotus põhjustab osakeste adhesiooni koos suuremate agregaatide moodustumisega.
Agregaadi stabiilsus on seletatav sarnaste laengute olemasoluga kolloidosakestes, mis takistavad nende ühendamist, samuti lahustimolekulide solvaatide kestade olemasoluga südamiku ümber. Solvaadi kestade paksuse ja agregatsiooni stabiilsuse vahel on kindlaks tehtud otsene seos.
Kolloidsete lahuste iseloomulik tunnus on osakeste suuruse spontaanse muutumise protsessid: suurus võib väheneda hajutatud faasi osakeste mittetäieliku lahustumise tõttu hajutatud faasi eripinna vähenemise tõttu vaba energia vähenemise tõttu. - protsess lahustumine; või suurendatud - ümberkristallimise protsess.
7. Kolloidsüsteemidel on suur liides ja seetõttu liigne vaba energia. Seetõttu ei ole need süsteemid stabiilsed, nad kipuvad vähendama vaba energiat ja see juhtub enamikul juhtudel kolloidosakeste kogupinna vähenemise tõttu, s.o. neid tugevdades. Seda kolloidosakeste tugevdamise protsessi nimetatakse koagulatsioon. Tahke faasi jämedate osakeste settimise protsessi nimetatakse settimine.
Koagulatsiooniprotsess koosneb kahest etapist: latentne koagulatsioon– hüübimisprotsessi visuaalselt ei tuvastata ja ilmne koagulatsioon- lihtne visuaalselt tuvastada.
Hüdrofoobsete soolide koagulatsiooni kõige olulisem tegur on elektrolüütide toime. Peaaegu kõik piisavas koguses elektrolüüdid võivad põhjustada hüübimist. Koagulatsiooni tekitamiseks on vajalik teatud minimaalne elektrolüüdi kontsentratsioon. Nimetatakse elektrolüüdi minimaalset kontsentratsiooni, mis võib põhjustada koagulatsiooni hüübimislävi. On kindlaks tehtud, et ioonil on koaguleeriv toime, mille laeng on märgilt vastupidine kolloidosakese pinna laengule. Seega on (+) laetud soolide puhul anioonidel koaguleeriv toime, (-) - katioonidel. Lisaks põhjustavad kõrgema laenguga koagulaatoriioonid tavaliselt koagulatsiooni palju madalamatel kontsentratsioonidel kui madalamad ioonid (Schulze-Gatdy reegel).
Sama märgi hüübimisläved erinevad üksteisest ka hüübimisvõime poolest, nende jaoks on nn. lüotroopne seeria:
Katioonid: Cs + >Rb + >NH4 + >K + >Na + >Li +; anioonid: I - >NO 3 - >Fr - >Cl -
Elektrolüütide segu võib samuti põhjustada koaguleerivat toimet. Sel juhul on võimalikud kolm juhtumit:
1) Koagulatsiooni toime on kokku võetud;
2) Koagulatiivne toime kui individuaalselt - antagonism;
3) hüübimistegevuse vastastikune tugevdamine – sünergism.
Koagulatsiooni võib põhjustada hüdrofoobse sooli segamine teatud vahekorras teiste hüdrofoobsete soolidega, mille graanulitel on vastupidine laeng, seda nähtust nimetatakse nn. vastastikune koagulatsioon. Vastastikune koagulatsioon on võimalik vastastikku laetud mitsellide vahelise tõrjumise puudumise tõttu.
8. Nagu teada, on hüdrofoobsed kolloidid isoelektrilises olekus ebastabiilsed, st elektronetraalsed osakesed koaguleeruvad kõige kiiremini.
Joonisel fig. 10 on kujutatud skeemi kolloidosakese laengu eemaldamiseks, kui lisatakse kahekordselt laetud anioonidega elektrolüüt.

Nagu näeme, muutub graanul elektriliselt neutraalseks, kui difuusse kihi vastasioonid, mis on negatiivselt laetud, liiguvad adsorptsioonikihti. Mida suurem on lisatava elektrolüüdi kontsentratsioon, seda rohkem hajutatud kiht kokku surutakse, seda väiksemaks muutub -potentsiaal ja seetõttu hakkab hüübimisprotsess kiiremini käima. Teatud elektrolüüdi kontsentratsiooni korral lähevad peaaegu kõik vastasioonid adsorptsioonikihti, graanuli laeng väheneb nullini ja koagulatsioon toimub maksimaalse kiirusega, kuna hajutatud kihi puudumine põhjustab kiilumise olulise vähenemise. survet.
Elektrolüütide koaguleeriv toime ei taandu ainult hajutatud kihi kokkusurumisele, samal ajal toimub nende elektrolüütide ioonide selektiivne adsorptsioon kolloidsetel osakestel, mille laeng on graanulile vastupidine. Veelgi enam, mida suurem on iooni laeng, seda intensiivsemalt see adsorbeerub. Ioonide kuhjumisega adsorbeerunud kihti kaasneb mitte ainult -potentsiaali, vaid ka hajuskihi vähenemine.
Eelnevast ei tohiks järeldada, et koagulatsiooni peamiseks põhjuseks on teatud konstandi saavutamine kõigil kriitilise -potentsiaali juhtudel. Uuringud on näidanud, et elektrolüütide koaguleeriv toime ei seisne mitte niivõrd kolloidosakeste vaheliste tõukejõudude otseses vähenemises -potentsiaali vähenemise kaudu, kuivõrd elektrilise kaksikkihi struktuuri muutumises ja kokkusurumises. Selle hajutatud osaga kaasneb kolloidosakesi eraldavate difuussete ioonide hüdraatunud (solvaat) kestade kiilumisefekti vähenemine.
9. Mõnel juhul, kui soolidele lisatakse mitmekordselt laetud ioonidega elektrolüüte, mille laeng on vastupidine kolloidosakeste laengule, ei saa täheldada mitte koagulatsiooni, vaid sooli stabiliseerumist ja märgi muutust. x-potentsiaal. Seda nähtust nimetatakse kolloidkeemiaks. laadige uuestisol. Seega, kui plaatinasoolile lisatakse väikeses koguses raudkloriidi FeCl 3, siis täheldatakse kolloidsete plaatinaosakeste negatiivse laengu ja nende koagulatsiooni vähenemist. FeCl3 kontsentratsiooni edasine tõus toob kaasa plaatina kolloidsete osakeste taaslaadimise; nad saavad positiivse laengu.
Laadimise käigus läbib plaatinasool järgmisi muutusi: negatiivselt laetud sool – ei hüübi; laeng on null - koagulatsioon; positiivselt laetud sool – koagulatsioon puudub; laeng on null - koagulatsioon jne. Sellist osakeste elektrilise neutraalsuse ja laengu olekute vaheldumist nimetatakse koagulatsioonitsoonide vaheldumiseks.
Plaatinasooli kolloidsete mitsellide taaslaadimise nähtus FeCl3 mõjul on selgelt näha x-potentsiaali muutumise kõveral (joonis 11).
10. Kuna ühegi sooli hüübimine ei ole hetkeline, vaid nõuab teatud ajaperioodi, siis tekkis küsimus hüübimisprotsessi kiiruse kohta. Hüübimisprotsessi kulgu ajas saab jälgida kolloidlahuse omaduste muutmisel, näiteks värvi muutmisel, hägususe suurendamisel jne.
Paljud uuringud on näidanud, et kõige usaldusväärsem meetod hüübimisprotsessi õigeaegseks jälgimiseks on meetod, mille abil loetakse ultramikroskoobis osakeste arv teatud aja jooksul. Soolide koagulatsiooni teooria järgi loetakse koagulatsiooni alguseks kahe kolloidosakese kokkupuudet ja nende adhesiooni üheks agregaadiks. Need kahekordsed osakesed, mis sooritavad Browni liikumist ja kohtuvad teiste identsete või üksikute osakestega, on võimelised moodustama kolmekordseid, neljakordseid jne osakesi kuni settimise alguseni. Kineetika erinevus keemilistest reaktsioonidest seisneb selles, et tavalise keemilise reaktsiooni korral reageerinud molekulid reaktsioonis enam ei osale ning kokkupõrkel kokku kleepuvad kolloidosakesed jätkavad koagulatsiooniprotsessis osalemist. , moodustades üha keerukamaid komplekse.
Koagulatsiooni alguses toimub kahe-, kolmekordsete jne osakeste moodustumine märkamatult ja aeglasemalt, seejärel koaguleeriva elektrolüüdi kontsentratsiooni suurenedes suureneb hüübimiskiirus oluliselt. Seega eristatakse aeglast ja kiiret hüübimist. Neid mõisteid ei tohiks segi ajada latentse ja ilmse koagulatsiooni mõistetega.
Sooli koagulatsiooni kiiruse muutuste kõver sõltuvalt elektrolüüdi kontsentratsioonist (joonis 12) selgitab hästi neid mõisteid ja nende seost teiste hüübimiskäiku iseloomustavate suurustega.
Aeglase hüübimise protsesse on praegu väga vähe uuritud. Eeldatakse, et koagulatsiooniprotsessi aeglane kulgemine on tingitud asjaolust, et ainult väga väike arv kolloidosakeste kokkupõrkeid viib nende adhesioonini (agregatsioonini). On kindlaks tehtud, et kokku kleepuvad vaid need osakesed, mille x-potentsiaal on mingil põhjusel langenud kriitilise väärtuseni, või osakesed, millel on suur kiirus ja mis kokkupõrkel satuvad vastastikuse tõmbe sfääri.
Kiire koagulatsiooni protsesse on palju paremini uuritud. Kiire koagulatsiooni korral viib iga kolloidosakeste kokkupõrge nende sulandumiseni (ühenduseni). Nendele ideedele tuginedes tuletas M. Smoluchovsky kiire koagulatsiooni kiirust iseloomustava võrrandi:
11. Tüüpilised hüdrofoobsed soolid hüübivad kergesti, kui neile lisatakse väikeses koguses elektrolüüte. Makromolekulaarsete ühendite lahused on seevastu väga vastupidavad elektrolüütide koaguleerivale toimele. Arvukad uuringud on leidnud, et hüdrofoobsetele soolidele lisatuna suurendavad HMS-i lahused neile vastupidavust elektrolüütidele. Seega, kui kullasoolile lisada väike kogus želatiini, muutub kulla hüdrosool stabiilsemaks. Elektrolüütide lisamisel, isegi hüübimisläve oluliselt ületavates kogustes, samuti pikaajalisel seismisel ei toimu sellel soolil praktiliselt mingeid muutusi. Kui see sool aurustatakse, tekib kuiva preparaadi veega segamisel uuesti kolloidne lahus. Seega, kui želatiini lisada tüüpilisele hüdrofoobsele kullasoolile, tundub, et see on omandanud hüdrofiilse sooli omadused ja muutub pöörduvaks. Sellist nähtust nimetatakse kaitsetegevus või lihtsalt kaitse, ja aineid endid, mis suurendavad hüdrofoobsete soolide stabiilsust, nimetatakse kaitsvaks. Lüofiilse iseloomuga makromolekulaarsetel ainetel on reeglina kaitsev toime.
Uuringud on näidanud, et HMS-i lahuste kaitsva toime aste sõltub lahustunud polümeeri olemusest ja kaitstud hüdrofoobse sooli olemusest. IUD-i lahuste kaitsva toime kvantitatiivne mõõt on kulla-, rubiini- ja rauaarv. Kõige rohkem on kasutatud kõige lihtsamat ja hõlpsamini kättesaadavat rauanumbrit, mida võib määratleda kui minimaalset milligrammide arvu kaitsvat kõrgpolümeeri, mis suudab kaitsta 10 ml raudhüdroksiidisooli 1 ml 0,005 N koagulatsiooni eest. Na 2 SO 4 lahus. (Želatiin - 5; tärklis - 20).
Uuringud on näidanud, et suurimat kaitseefekti täheldatakse kõrgemolekulaarse ühendi ja kolloidi samade laengute korral, kuna vastasel juhul neutraliseerivad nad laengu vastastikku ja suure kombineeritud kompleksi stabiilsus väheneb loomulikult.
Kaitsva toime mehhanismi selgitab üsna hästi Zsigmondy teooria, mis põhineb kaitstud ja kaitsvate sooli osakeste vahelise adsorptsiooni interaktsiooni kontseptsioonil. Suurem hüdrofoobse sooli osake adsorbeerib oma pinnale väiksemaid HMW makromolekule koos nende solvaatide kestadega ja omandab selle tulemusena lüofiilsed omadused. Sel juhul on pöördumatu hüdrofoobse sooli kolloidsed mitsellid kaitstud üksteisega otsese kokkupuute ja sellest tulenevalt agregatsiooni eest nii koaguleeriva elektrolüüdi toimel sellisele soolile kui ka sooli kontsentratsiooni korral. Joonisel fig. 13a, b on näidatud sellise kaitsetegevuse skeem.
Mõnel juhul annab väga väikese koguse kõrge polümeeri lisamine hüdrofoobsele soolile täpselt vastupidise tulemuse: sooli stabiilsus väheneb järsult. Seda nähtust nimetatakse sensibiliseerimiseks või stabiliseerimine kolloidne lahus. P. N. Peskovi ja L. D. Landau teooria kohaselt toimub astabiliseerimine, kui hüdrofoobsele soolile lisatakse kaitsvat kõrgpolümeeri väikestes kogustes, mis jäävad alla selle kaitsva toime piirläve, s.t alla kaitsearvu. Teisisõnu, asstabiliseerimine toimub siis, kui kõrgpolümeeri osakesi ei ole piisavalt, et katta ja kaitsta hüdrofoobse sooli kolloidosakeste kogu pinda, kuid need on piisavad, et viimastelt adsorptsiooniga stabiliseerivad ioonid ära võtta. Joonisel fig. 10c on toodud asstabiliseeritud kolloidosakese diagramm. Stabiliseerimine on kõige lihtsam teostada, kui mõlemat tüüpi osakesi laetakse erinevalt.
12. Sageli saab hüdrofoobsete soolide koagulatsiooniprodukti - sademe või koagulatsiooni - muuta teatud elektrolüüdiga töödeldes suspendeeritud olekusse. Seega saab kalgendatud raudhüdroksiidisooli taastada algsesse olekusse, kui Fe(OH)3 sadet töödelda raudkloriidi vesilahusega. Nimetatakse setete üleminekut hõljuvasse olekusse välistegurite mõjul peptiseerimine.
Nimetatakse aineid, mis soodustavad koagulatsiooni üleminekut sooliks peptisaatorid. Tavaliselt on peptisaatorid elektrolüüdid või pigem üks ioonidest. Kuid mõnel juhul võivad peptiseeriva toimega olla ka mitteelektrolüüdid, näiteks lahusti.
Peptiseerimisprotsess ise on peamiselt tingitud adsorptsiooninähtustest, mille tulemuseks on mitte ainult hajutatud osakeste x-potentsiaali suurenemine, vaid ka nende lahustumisastme (hüdratatsiooni) suurenemine. Sooli dispergeeritud faasi koaguleerunud osakestega laengu kommunikatsioon aitab ühelt poolt kaasa sademe üldisele lahtitulemisele ja teisest küljest nende osakeste üleminekule Browni toimel hõljuvasse olekusse. liikumine. Kui see juhtub, moodustuvad hajutatud osakeste ümber solvaadikestad, mis tekitavad nende kiilumisefekti.
Nagu koagulatsioon, ei mõjuta hüdrofoobsete soolide peptiseerumine kolloidtuuma sügavaid masse. Need protsessid toimuvad faasiliidese kõige õhemates kihtides, seetõttu on peptiseerimiseks vaja ebaolulises koguses elektrolüüte võrreldes sooli olekusse muundunud sette kogusega (joonis 14).
|
|
Seega, kui võtta sama kogus koagulanti ja pepteerida see erineva koguse peptiseerijaga, siis väikeste koguste korral toimub ainult selle adsorptsioon ilma sademe lahustumiseta (kõver OA, joonis 14) ja kontsentratsiooni edasine tõus. peptiseerija, toimub ka lahustuvuse suurenemine (kõver AB). Kui jätkame peptiseerija koguse suurendamist, jõuab lahustuvus kiiresti kasvades teatud piirini ja ei sõltu enam peptiseerija kogusest (kõverad BC ja CD). Peptisaatori suure liia korral võib tekkida koagulatsioon (kõver DE). Meie poolt vaadeldud OD-kõver annab tüüpilise pildi adsorptsioonipeptiseerimisest. |
Lisaks adsorptsioonile toimub ka lahustuv peptiseerimine. Seda tüüpi peptiseerimine hõlmab kõiki juhtumeid, millega peptiseerimisprotsess on seotud keemiline reaktsioon pindmiselt paiknevad kolloidmitsellide molekulid.
Konstantse peptiseerija koguse ja suureneva kalgendikoguse korral viimase pepteeritavus esmalt suureneb, saavutades maksimumi, seejärel väheneb. Seda W. Ostwaldi ja A. Butsagi kehtestatud mustrit nimetati reegli eelnõuks.
Gerasimenko Evgenia
See esitlus on pühendatud Tyndalli efekti kirjeldusele ja selle praktilisele rakendamisele.
Lae alla:
Eelvaade:
Esitluste eelvaate kasutamiseks looge Google'i konto (konto) ja logige sisse: https://accounts.google.com
Slaidide pealdised:
Lõpetanud: 11. klassi "B" õpilane Evgenia Gerasimenko Kontrollis: keemiaõpetaja Yurkina T.I. 2012/2013 õppeaasta tyndallik efekt
John Tyndall Iiri füüsik ja insener. Sündis Carlow krahvkonnas Lylin Bridge'is. Pärast keskkooli lõpetamist töötas ta topograaf-geodeetina sõjalistes organisatsioonides ja raudteede ehitusel. Samal ajal lõpetas ta Prestoni Mehaanikainstituudi. Vallandati sõjaväegeodeetilisest teenistusest halbade töötingimuste vastu protestimise pärast. Ta õpetas Queenwoodi kolledžis (Hampshire), jätkates samal ajal eneseharimist. Aastatel 1848–51 kuulas loenguid Marburgi ja Berliini ülikoolides. Inglismaale naastes sai temast õpetaja ja seejärel professor Londoni Kuninglikus Instituudis. Teadlase peamised tööd on pühendatud magnetismile, akustikale, gaaside ja aurude soojuskiirguse neeldumisele, valguse hajutamisele häguses keskkonnas. Uuris liustike ehitust ja liikumist Alpides. Tyndall oli teaduse populariseerimise ideest äärmiselt kirglik. Ta pidas regulaarselt avalikke loenguid, sageli kõigile tasuta loengutena: lõuna ajal vabrikuhoovides töötajatele, Kuninglikus Instituudis jõululoenguid lastele. Tyndalli kui populariseerija tuntus jõudis ka teisele poole Atlandi ookeani – tema raamatu „Teaduse killud” Ameerika väljaande kogu tiraaž müüdi läbi ühe päevaga. Ta suri 1893. aastal absurdses surmas: õhtusööki valmistades kasutas teadlase naine (kes elas ta 47 aasta võrra kauem) eksikombel lauasoola asemel kasutusele üht köögis hoitud keemilist reaktiivi.
Kirjeldus Tyndalli efekt - optiliselt ebahomogeense keskkonna kuma, mis tuleneb seda läbiva valguse hajumisest. Seda põhjustab valguse difraktsioon üksikutele osakestele või keskkonna struktuurse ebahomogeensuse elementidele, mille suurus on palju väiksem kui hajutatud valguse lainepikkus. Iseloomulik kolloidsüsteemidele (näiteks hüdrosoolid, tubakasuits), millel on madal dispergeeritud faasi osakeste kontsentratsioon ja mille murdumisnäitaja erineb dispersioonikeskkonna murdumisnäitajast. Tavaliselt vaadeldakse seda heleda koonusena tumedal taustal (Tyndalli koonus), kui fokuseeritud valguskiir suunatakse küljelt läbi tasapinnaliste paralleelsete seintega klaaselemendi, mis on täidetud kolloidlahusega. Valge (mittemonokromaatilise) valguse lühilainekomponent on hajutatud pikalainelisest komponendist tugevamate kolloidosakestega, seetõttu on tema poolt mitteneelavas tuhas moodustunud Tyndalli koonus sinise varjundiga. Tyndalli efekt on sisuliselt sama, mis opalestsents. Kuid traditsiooniliselt viitab esimene termin valguse intensiivsele hajumisele piiratud ruumis piki kiirt ja teine - valguse nõrka hajumist kogu vaadeldava objekti mahus.
Tyndalli efekti tajub palja silmaga valgust hajutava süsteemi ruumala mingi osa ühtlase kuma. Valgus tuleb üksikutest täppidest – difraktsioonilaikudest, mis on optilise mikroskoobi all hästi eristatavad lahjendatud sooli piisavalt tugeva valgustusega. Teatud suunas hajuva valguse intensiivsus (langeva valguse konstantsete parameetrite korral) sõltub hajuvate osakeste arvust ja nende suurusest.
Ajastus Algusaeg (logi kuni -12 kuni -6); Eluiga (log tc -12 kuni 15); Lagunemisaeg (log td -12 kuni -6); Optimaalne arendusaeg (log tk -9 kuni -7). Tehniline teostus efekt Mõju on valgusvihu läbimisel kergesti jälgitav heelium neoonlaser läbi kolloidlahuse (lihtsalt värvimata tärkliseželee). Diagramm
Efekti rakendamine Tyndalli efektist lähtuvalt kasutatakse laialdaselt kolloidosakeste tuvastamise, suuruse ja kontsentratsiooni määramise meetodeid (ultramikroskoopia, nefelomeetria). teaduslikud uuringud ja tööstuspraktika).
Näide. Ultramikroskoop. Ultramikroskoop on optiline instrument väikseimate (kolloidsete) osakeste tuvastamiseks, mille mõõtmed on väiksemad kui tavaliste valgusmikroskoopide eraldusvõime piir. Võimalus selliseid osakesi ultramikroskoobi abil tuvastada on tingitud Tyndalli efekti poolt neile langevast valguse difraktsioonist. Tugeva külgvalgustuse korral märgib vaatleja iga osakese ultramikroskoobis ereda punktina (valgusdifraktsioonitäpp) tumedal taustal. Difraktsiooni tõttu väikseimatel osakestel on valgust väga vähe, seetõttu kasutatakse ultramikroskoobis reeglina tugevaid valgusallikaid. Sõltuvalt valgustuse intensiivsusest, valguse lainepikkusest, osakese ja keskkonna murdumisnäitajate erinevusest saab tuvastada osakesi suurusega 20-50 nm kuni 1-5 μm. Difraktsioonilaikude põhjal on võimatu kindlaks teha osakeste tegelikku suurust, kuju ja struktuuri. Ultramikroskoop ei anna uuritavatest objektidest optilist kujutist. Ultramikroskoobi abil on aga võimalik määrata osakeste olemasolu ja arvkontsentratsiooni, uurida nende liikumist ning ka arvutada osakeste keskmine suurus, kui on teada nende massikontsentratsioon ja tihedus. Pilu-ultramikroskoobi skeemil (joonis 1a) on uuritav süsteem liikumatu.
Pilu-ultramikroskoobi skeemil on uuritav süsteem liikumatu. Pilumikroskoobi skemaatiline diagramm. Küvetti 5 koos uuritava objektiga valgustatakse valgusallikaga 1 (2 - kondensaator, 4 - valgustuslääts) läbi kitsa ristkülikukujulise pilu 3, mille kujutis projitseeritakse vaatlusalale. Vaatlusmikroskoobi 6 okulaaris on näha pilu kujutise tasapinnal paiknevate osakeste helendavad täpid. Valgustatud ala kohal ega all osakeste olemasolu ei tuvastata.
Voolu-ultramikroskoobis liiguvad uuritavad osakesed mööda toru vaatleja silma suunas. Voolumikroskoobi skemaatiline diagramm Valgustsooni ületades registreeritakse need eredate välkudena visuaalselt või fotomeetrilise seadme abil. Reguleerides vaadeldavate osakeste valgustuse heledust liikuva fotomeetrilise kiilu 7 abil, on võimalik registreerimiseks välja tuua osakesed, mille suurus ületab etteantud piiri. Kaasaegse laservalgusallika ja optoelektroonilise osakestetuvastussüsteemiga in-line ultramikroskoobi abil määratakse osakeste kontsentratsioon aerosoolides vahemikus 1 kuni 109 osakest 1 cm3 kohta ning leitakse ka osakeste suuruse jaotuse funktsioonid. Ultramikroskoope kasutatakse hajutatud süsteemide uurimisel, et kontrollida atmosfääriõhu puhtust. Vesi, optiliselt läbipaistvate kandjate saastatuse määr võõrkehadega.
Kasutatud kirjandus 1. Füüsika. Suur entsüklopeediasõnaraamat.- M.: Suur vene entsüklopeedia, 1999.- lk.90, 460. 2. Uus polütehniline sõnaraamat.- M.: suur vene entsüklopeedia, 2000.- lk 20, 231, 460. Märksõnad optiline kuma ebahomogeenne kahefaasiline keskmine valgust hajuv hajuv keskkond
***Newtonile kukkus õun, hiinlased imetlesid lootoseõitel tilku ja John Tyndall märkas ilmselt läbi metsa kõndides valguskoonust. Muinasjutt? Võib olla. Kuid just viimase kangelase auks on nimetatud üks meie maailma ilusamaid efekte - Tyndalli efekt....***
Valguse hajumine on üks üldised omadused väga hajutatud süsteemid.
Hajutatud süsteemi külgvalgustuse all on iseloomulik sillerdav, reeglina sinakas sära, mis on eriti selgelt nähtav tumedal taustal.
Seda omadust, mis on seotud hajutatud faasi osakeste valguse hajutamisega, nimetatakse opaali nimest opalestsentsiks - opalus (lat.), sinaka või kollakasvalge värvi poolläbipaistev mineraal. Aastal 1868 avastas ta, et kui kolloidlahust valgustada küljelt tugevast allikast pärit valgusvihuga, siis täheldatakse eredat ühtlaselt helendavat koonust - Tyndalli koonus, või Tyndalli efekt, samas kui väikese molekulmassiga lahuse puhul tundub vedelik optiliselt tühi, s.t. tala jälg on nähtamatu.
vasakul - 1% tärkliselahus, paremal - vesi.
Tyndalli efekt tekib hõljuvate osakeste hajumisel, mille suurus ületab kümneid kordi aatomite suurust. Suspensiooniosakeste suurendamisel suurusjärgus 1/20 valguse lainepikkusest (alates umbes 25 nm ja üle selle), muutub hajumine polükromaatiliseks, st valgus hakkab hajuma ühtlaselt üle kogu nähtava värvivahemiku alates violetsest punaseks. Selle tulemusena kaob Tyndalli efekt. Seetõttu paistavad tihedad udu- või rünkpilved meile valgetena – need koosnevad tihedast veetolmu suspensioonist, mille osakeste läbimõõt on mikronitest millimeetriteni, mis on tunduvalt üle Tyndalli hajumisläve.
Võib arvata, et taevas tundub meile Tyndalli efekti tõttu sinine, kuid see pole nii. Pilvede või suitsu puudumisel muutub taevas sinakassiniseks "päevavalguse" hajumise tõttu õhumolekulidele. Seda tüüpi hajumist nimetatakse Rayleighi hajutamiseks (Sir Rayleighi järgi). Rayleighi hajumine hajutab sinist ja sinist valgust isegi rohkem kui Tyndalli efekt: näiteks sinine valgus lainepikkusega 400 nm hajub puhtas õhus üheksa korda tugevamini kui punane valgus lainepikkusega 700 nm. Seetõttu tundub taevas meile sinine – päikesevalgus hajub üle kogu spektrivahemiku, kuid spektri sinises osas on see peaaegu suurusjärgu võrra tugevam kui punases. Päikesepõletust põhjustavad ultraviolettkiired on veelgi hajutatud. Seetõttu jaotub päevitus üsna ühtlaselt üle keha, kattes ka need nahapiirkonnad, mis otsese päikesevalguse kätte ei puutu.
- Kokkupuutel 0
- Google Plus 0
- Okei 0
- Facebook 0