1. Struktura ciał gazowych, ciekłych i stałych
Teoria kinetyki molekularnej pozwala zrozumieć, dlaczego substancja może znajdować się w stanie gazowym, ciekłym i stałym.
Gazy. W gazach odległość między atomami lub cząsteczkami jest średnio wielokrotna więcej rozmiarów same cząsteczki ( rys.8.5). Na przykład pod ciśnieniem atmosferycznym objętość naczynia jest dziesiątki tysięcy razy większa niż objętość zawartych w nim cząsteczek.
Gazy łatwo ulegają kompresji, podczas gdy średnia odległość między cząsteczkami maleje, ale kształt cząsteczki się nie zmienia ( rys.8.6).

Cząsteczki z ogromnymi prędkościami - setki metrów na sekundę - poruszają się w przestrzeni. Zderzając się, odbijają się od siebie w różnych kierunkach jak kule bilardowe. Słabe siły przyciągania cząsteczek gazu nie są w stanie utrzymać ich blisko siebie. Dlatego gazy mogą rozszerzać się w nieskończoność. Nie zachowują kształtu ani objętości.
Liczne uderzenia molekuł o ścianki naczynia wytwarzają ciśnienie gazu.
Płyny. Cząsteczki cieczy znajdują się prawie blisko siebie ( rys.8.7), więc cząsteczka cieczy zachowuje się inaczej niż cząsteczka gazu. W cieczach mamy do czynienia z tzw. porządkiem krótkiego zasięgu, czyli uporządkowany układ cząsteczek jest zachowany w odległościach równych kilku średnicom cząsteczek. Cząsteczka oscyluje wokół swojej pozycji równowagi, zderzając się z sąsiednimi cząsteczkami. Tylko od czasu do czasu robi kolejny „skok”, wpadając w nową pozycję równowagi. W tej pozycji równowagi siła odpychania jest równa sile przyciągania, tj. całkowita siła oddziaływania cząsteczki wynosi zero. Czas ustalone życie cząsteczki wody, czyli czas jej oscylacji wokół jednego określonego położenia równowagi w temperaturze pokojowej, wynosi średnio 10 -11 s. Czas jednej oscylacji jest znacznie krótszy (10 -12 -10 -13 s). Wraz ze wzrostem temperatury skraca się czas życia cząsteczek.
Charakter ruchu molekularnego w cieczach, ustalony po raz pierwszy przez sowieckiego fizyka Ya.I. Frenkla, umożliwia zrozumienie podstawowych właściwości cieczy.
Cząsteczki cieczy znajdują się bezpośrednio obok siebie. Wraz ze spadkiem objętości siły odpychające stają się bardzo duże. To wyjaśnia niska ściśliwość płynów.
Jak wiadomo, płyny są płynne, tzn. nie zachowują kształtu. Można to wyjaśnić w ten sposób. Siła zewnętrzna nie zmienia zauważalnie liczby skoków molekularnych na sekundę. Ale przeskoki cząsteczek z jednej ustalonej pozycji do drugiej występują głównie w kierunku siły zewnętrznej ( rys.8.8). Dlatego płyn płynie i przybiera postać naczynia.
Ciała stałe. Atomy lub cząsteczki ciał stałych, w przeciwieństwie do atomów i cząsteczek cieczy, wibrują wokół pewnych pozycji równowagi. Z tego powodu ciała stałe zachowują nie tylko objętość, ale i kształt. Energia potencjalna oddziaływania cząsteczek ciała stałego jest znacznie większa niż ich energia kinetyczna.
Jest jeszcze jedna ważna różnica między cieczami a ciałami stałymi. Płyn można porównać do tłumu ludzi, w którym poszczególne osobniki przepychają się niespokojnie w miejscu, a ciało stałe jest jak smukła kohorta tych samych osobników, które choć nie stoją na baczność, zachowują przeciętnie pewne odległości między sobą . Jeśli połączymy centra równowagowych pozycji atomów lub jonów ciała stałego, to otrzymamy prawidłową sieć przestrzenną, zwaną krystaliczny.
Ryciny 8.9 i 8.10 pokazują sieci krystaliczne soli kuchennej i diamentu. Wewnętrzny porządek w układzie atomów kryształu prowadzi do regularnych zewnętrznych kształtów geometrycznych.


Rysunek 8.11 przedstawia jakuckie diamenty.
Dla gazu odległość l między cząsteczkami jest znacznie większa niż wymiary cząsteczek r 0:" l>>r 0 .
Ciecze i ciała stałe mają l≈r 0 . Cząsteczki cieczy układają się w nieładzie i od czasu do czasu przeskakują z jednej ustalonej pozycji na drugą.
W krystalicznych ciałach stałych cząsteczki (lub atomy) są ułożone w ściśle uporządkowany sposób.
2. Gaz doskonały w teorii kinetyki molekularnej
Badanie dowolnej dziedziny fizyki zawsze rozpoczyna się od wprowadzenia pewnego modelu, w ramach którego badanie będzie prowadzone w przyszłości. Na przykład, kiedy studiowaliśmy kinematykę, model ciała był punktem materialnym itp. Jak można się domyślić, model nigdy nie będzie odpowiadał rzeczywistym zachodzącym procesom, ale często jest bardzo zbliżony do tej korespondencji.
Fizyka molekularna, a w szczególności MKT, nie jest wyjątkiem. Wielu naukowców pracowało nad problemem opisu modelu od XVIII wieku: M. Łomonosow, D. Joule, R. Clausius (ryc. 1). Ten ostatni w rzeczywistości wprowadził model w 1857 r. gaz doskonały. Jakościowe wyjaśnienie podstawowych właściwości materii na podstawie teorii kinetyki molekularnej nie jest szczególnie trudne. Jednak teoria, która ustala ilościowe zależności między wielkościami zmierzonymi eksperymentalnie (ciśnienie, temperatura itp.) a właściwościami samych cząsteczek, ich liczbą i prędkością ruchu, jest bardzo złożona. W gazie pod zwykłym ciśnieniem odległość między cząsteczkami jest wielokrotnie większa niż ich rozmiar. W tym przypadku siły oddziaływania cząsteczek są pomijalne, a energia kinetyczna cząsteczek jest znacznie większa niż energia potencjalna oddziaływania. Cząsteczki gazu można traktować jako punkty materialne lub bardzo małe, stałe kulki. Zamiast prawdziwy gaz, między którymi działają molekuły złożone siły interakcja, rozważymy to model jest gazem idealnym.
Gaz doskonały– model gazu, w którym cząsteczki gazu i atomy są reprezentowane jako bardzo małe (zanikające rozmiary) elastyczne kulki, które nie oddziałują ze sobą (bez bezpośredniego kontaktu), a jedynie zderzają się (patrz rys. 2).
Należy zauważyć, że rozrzedzony wodór (pod bardzo niskim ciśnieniem) prawie całkowicie spełnia wymagania modelu gazu doskonałego.
 Ryż. 2.
Ryż. 2.
Gaz doskonały jest gazem, którego interakcja między cząsteczkami jest znikoma. Naturalnie, kiedy zderzają się cząsteczki gazu doskonałego, działa na nie siła odpychająca. Ponieważ zgodnie z modelem cząsteczki gazu możemy traktować jako punkty materialne, pomijamy rozmiary cząsteczek, zakładając, że objętość, którą zajmują, jest znacznie mniejsza niż objętość naczynia.
Przypomnijmy, że w modelu fizycznym brane są pod uwagę tylko te właściwości układu rzeczywistego, których uwzględnienie jest absolutnie niezbędne do wyjaśnienia badanych wzorców zachowania tego układu. Żaden model nie może przekazać wszystkich właściwości systemu. Teraz musimy rozwiązać dość wąski problem: obliczyć za pomocą teorii molekularno-kinetycznej ciśnienie gazu doskonałego na ściankach naczynia. W przypadku tego problemu idealny model gazu okazuje się całkiem zadowalający. Prowadzi to do rezultatów potwierdzonych doświadczeniem.
3. Ciśnienie gazu w teorii kinetyki molekularnej
Niech gaz będzie w zamkniętym naczyniu. Manometr pokazuje ciśnienie gazu p0. Jak powstaje ta presja?
Każda cząsteczka gazu, uderzając w ścianę, działa na nią z określoną siłą przez krótki czas. W wyniku przypadkowych uderzeń w ścianę ciśnienie zmienia się szybko w czasie, w przybliżeniu jak pokazano na rysunku 8.12. Jednak efekty wywołane uderzeniami poszczególnych cząsteczek są tak słabe, że nie są one rejestrowane przez manometr. Manometr rejestruje średnią czasową siłę działającą na każdą jednostkę powierzchni jego powierzchni. element wyczuwający- membrany. Pomimo niewielkich zmian ciśnienia ciśnienie średnie p0 w praktyce okazuje się, że jest to dość określona wartość, ponieważ w ścianę dochodzi do wielu uderzeń, a masy cząsteczek są bardzo małe.

Gaz doskonały to model gazu rzeczywistego. Zgodnie z tym modelem cząsteczki gazu można uznać za punkty materialne, których oddziaływanie zachodzi tylko wtedy, gdy się zderzają. Zderzając się ze ścianą, cząsteczki gazu wywierają na nią nacisk.
4. Mikro- i makro-parametry gazu
Teraz możemy zacząć opisywać parametry gazu doskonałego. Są podzielone na dwie grupy:
Idealne parametry gazu
 Oznacza to, że mikroparametry opisują stan pojedynczej cząstki (mikrociała), a makroparametry opisują stan całej części gazowej (makrociało). Napiszmy teraz relację łączącą jedne parametry z innymi, czyli podstawowe równanie MKT:
Oznacza to, że mikroparametry opisują stan pojedynczej cząstki (mikrociała), a makroparametry opisują stan całej części gazowej (makrociało). Napiszmy teraz relację łączącą jedne parametry z innymi, czyli podstawowe równanie MKT:
![]()
Tutaj: - średnia prędkość cząstek;
Definicja. - stężenie cząstki gazu - liczba cząstek na jednostkę objętości; ; jednostka - .
5. Średnia wartość kwadratu prędkości cząsteczek
Aby obliczyć średnie ciśnienie, musisz znać średnią prędkość cząsteczek (a dokładniej średnią wartość kwadratu prędkości). To nie jest łatwe pytanie. Przyzwyczaiłeś się do tego, że każda cząsteczka ma prędkość. Średnia prędkość cząsteczek zależy od ruchu wszystkich cząstek.
Wartości średnie. Od samego początku należy zrezygnować z podążania za ruchem wszystkich molekuł, z których składa się gaz. Jest ich za dużo i poruszają się bardzo ciężko. Nie musimy wiedzieć, jak porusza się każda cząsteczka. Musimy dowiedzieć się, do czego prowadzi ruch wszystkich cząsteczek gazu.
Charakter ruchu całego zestawu cząsteczek gazu jest znany z doświadczenia. Cząsteczki uczestniczą w losowym (termicznym) ruchu. Oznacza to, że prędkość dowolnej cząsteczki może być bardzo duża lub bardzo mała. Kierunek ruchu cząsteczek stale się zmienia, gdy zderzają się ze sobą.
Jednak prędkości poszczególnych cząsteczek mogą być dowolne Średnia wartość modułu tych prędkości jest dość określona. Podobnie wzrost uczniów w klasie nie jest taki sam, ale jego średnia wartość to pewna liczba. Aby znaleźć tę liczbę, musisz dodać wzrost poszczególnych uczniów i podzielić tę kwotę przez liczbę uczniów.
Średnia wartość kwadratu prędkości. W przyszłości będziemy potrzebować średniej wartości nie samej prędkości, ale kwadratu prędkości. Od tej wartości zależy średnia energia kinetyczna cząsteczek. A średnia energia kinetyczna cząsteczek, jak wkrótce zobaczymy, ma ogromne znaczenie w całej teorii kinetyki molekularnej.
Oznaczmy moduły prędkości poszczególnych cząsteczek gazu jako . Średnia wartość kwadratu prędkości jest określona wzorem:
gdzie n to liczba cząsteczek w gazie.
Ale kwadrat modułu dowolnego wektora jest równy sumie kwadratów jego rzutów na osie współrzędnych OH, OY, OZ. Dlatego
Średnie wartości wielkości można określić za pomocą wzorów podobnych do wzoru (8.9). Między wartością średnią a wartościami średnimi kwadratów projekcji zachodzi taka sama zależność jak stosunek (8,10):
Rzeczywiście, równość (8.10) obowiązuje dla każdej cząsteczki. Dodanie takich równości dla poszczególnych cząsteczek i podzielenie obu stron otrzymanego równania przez liczbę cząsteczek n, dochodzimy do wzoru (8.11).
Uwaga! Ponieważ kierunki trzech osi O, OY I oz ze względu na losowy ruch cząsteczek są one równe, średnie wartości kwadratów rzutów prędkości są sobie równe:
Widzisz, z chaosu wyłania się pewna prawidłowość. Czy możesz sam to rozgryźć?
Uwzględniając zależność (8.12), zamiast i podstawiamy do wzoru (8.11). Wtedy dla średniego kwadratu rzutu prędkości otrzymujemy:
![]()
tj. średni kwadrat rzutu prędkości jest równy 1/3 średniego kwadratu samej prędkości. Współczynnik 1/3 pojawia się ze względu na trójwymiarowość przestrzeni, a zatem istnienie trzech rzutów dla dowolnego wektora.
Prędkości cząsteczek zmieniają się losowo, ale średni kwadrat prędkości jest wartością dobrze określoną.
6. Podstawowe równanie teorii kinetyki molekularnej
Przechodzimy do wyprowadzenia podstawowego równania molekularno-kinetycznej teorii gazów. Równanie to ustala zależność ciśnienia gazu od średniej energii kinetycznej jego cząsteczek. Po wyprowadzeniu tego równania w XIX wieku. i rozpoczął się eksperymentalny dowód jego ważności szybki rozwój teoria ilościowa, kontynuowana do dziś.
Dowód prawie każdego twierdzenia w fizyce, wyprowadzenie dowolnego równania może być wykonane z różnym stopniem rygoru i przekonywania: bardzo uproszczone, mniej lub bardziej rygorystyczne lub z pełnym dostępnym rygorem nowoczesna nauka.
Rygorystyczne wyprowadzenie równania molekularno-kinetycznej teorii gazów jest dość skomplikowane. Dlatego ograniczamy się do bardzo uproszczonego, schematycznego wyprowadzenia równania. Mimo wszelkich uproszczeń wynik będzie poprawny.
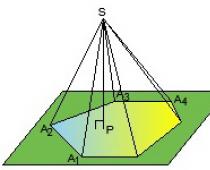
Wyprowadzenie głównego równania. Oblicz ciśnienie gazu na ścianie Płyta CD naczynie ABCD powierzchnia S, prostopadle do osi współrzędnych WÓŁ (rys.8.13).
Kiedy cząsteczka uderza w ścianę, zmienia się jej pęd: . Ponieważ moduł prędkości cząsteczek nie zmienia się po uderzeniu, to ![]() . Zgodnie z drugim prawem Newtona zmiana pędu cząsteczki jest równa pędowi siły działającej na nią od strony ścianki naczynia, a zgodnie z trzecim prawem Newtona pędowi siły, z jaką działała cząsteczka na ścianie ma taką samą wartość bezwzględną. W konsekwencji, w wyniku uderzenia molekuły, na ścianę działała siła, której pęd jest równy .
. Zgodnie z drugim prawem Newtona zmiana pędu cząsteczki jest równa pędowi siły działającej na nią od strony ścianki naczynia, a zgodnie z trzecim prawem Newtona pędowi siły, z jaką działała cząsteczka na ścianie ma taką samą wartość bezwzględną. W konsekwencji, w wyniku uderzenia molekuły, na ścianę działała siła, której pęd jest równy .
Fizyka molekularna jest prosta!
Siły oddziaływania cząsteczek
Wszystkie cząsteczki substancji oddziałują ze sobą siłami przyciągania i odpychania.
Dowód oddziaływania cząsteczek: zjawisko zwilżania, odporność na ściskanie i rozciąganie, niska ściśliwość ciał stałych i gazów itp.
Powodem interakcji cząsteczek są oddziaływania elektromagnetyczne naładowanych cząstek w materii.
Jak to wyjaśnić?
Atom składa się z dodatnio naładowanego jądra i ujemnie naładowanej powłoki elektronowej. Ładunek jądra jest równy całkowitemu ładunkowi wszystkich elektronów, dlatego jako całość atom jest elektrycznie obojętny.
Cząsteczka składająca się z jednego lub więcej atomów jest również elektrycznie obojętna.
Rozważ oddziaływanie między cząsteczkami na przykładzie dwóch nieruchomych cząsteczek.
Siły grawitacyjne i elektromagnetyczne mogą istnieć między ciałami w przyrodzie.
Ponieważ masy cząsteczek są niezwykle małe, pomijalne siły oddziaływania grawitacyjnego między cząsteczkami można pominąć.
Na bardzo dużych odległościach również nie ma interakcji elektromagnetycznych między cząsteczkami.
Ale wraz ze zmniejszeniem odległości między cząsteczkami cząsteczki zaczynają orientować się tak, że ich strony skierowane do siebie będą miały ładunki o różnych znakach (na ogół cząsteczki pozostają neutralne), a między cząsteczkami powstają siły przyciągania.
Przy jeszcze większym zmniejszeniu odległości między cząsteczkami powstają siły odpychające w wyniku oddziaływania ujemnie naładowanych powłok elektronowych atomów cząsteczek.
W rezultacie na cząsteczkę wpływa suma sił przyciągania i odpychania. Na dużych odległościach przeważa siła przyciągania (w odległości 2-3 średnic cząsteczek przyciąganie jest maksymalne), na krótkich siła odpychania.
Między cząsteczkami jest taka odległość, przy której siły przyciągania stają się równe siłom odpychania. Ta pozycja cząsteczek nazywana jest pozycją stabilna równowaga.
Cząsteczki znajdujące się w pewnej odległości od siebie i związane siłami elektromagnetycznymi mają energia potencjalna.
W pozycji równowagi stabilnej energia potencjalna cząsteczek jest minimalna.
W substancji każda cząsteczka oddziałuje jednocześnie z wieloma sąsiednimi cząsteczkami, co również wpływa na wartość minimalnej energii potencjalnej cząsteczek.
Ponadto wszystkie cząsteczki substancji są w ciągłym ruchu, tj. mają energię kinetyczną.
Zatem o strukturze substancji i jej właściwościach (ciała stałe, ciekłe i gazowe) decyduje stosunek minimalnej energii potencjalnej oddziaływania cząsteczek do zapasu energii kinetycznej ruch termiczny molekuły.
Struktura i właściwości ciał stałych, ciekłych i gazowych
Strukturę ciał wyjaśnia wzajemne oddziaływanie cząstek ciała i charakter ich ruchu termicznego.
Solidny
Ciała stałe mają stały kształt i objętość i są praktycznie nieściśliwe.
Minimalna energia potencjalna oddziaływania cząsteczek jest większa niż energia kinetyczna cząsteczek.
Silne oddziaływanie cząstek.
Ruch termiczny cząsteczek w ciele stałym wyraża się jedynie oscylacjami cząsteczek (atomów, cząsteczek) wokół pozycji równowagi stabilnej.
Ze względu na duże siły przyciągania cząsteczki praktycznie nie mogą zmienić swojego położenia w substancji, co tłumaczy niezmienność objętości i kształtu ciał stałych.
Większość ciał stałych ma uporządkowany przestrzennie układ cząstek, które tworzą regularną sieć krystaliczną. Cząstki materii (atomy, cząsteczki, jony) znajdują się na wierzchołkach - węzłach sieci krystalicznej. Węzły sieci krystalicznej pokrywają się z pozycją stabilnej równowagi cząstek.
Takie ciała stałe nazywane są krystalicznymi.
Płyn
Płyny mają określoną objętość, ale nie mają własnego kształtu, przyjmują kształt naczynia, w którym się znajdują.
Minimalna energia potencjalna oddziaływania cząsteczek jest porównywalna z energią kinetyczną cząsteczek.
Słabe oddziaływanie cząstek.
Ruch termiczny cząsteczek w cieczy wyraża się oscylacjami wokół położenia stabilnej równowagi w objętości dostarczanej cząsteczce przez sąsiadów
Cząsteczki nie mogą swobodnie poruszać się w całej objętości substancji, ale możliwe są przejścia cząsteczek w sąsiednie miejsca. To wyjaśnia płynność cieczy, zdolność do zmiany jej kształtu.

W cieczach cząsteczki są dość silnie związane ze sobą siłami przyciągania, co tłumaczy niezmienność objętości cieczy.
W cieczy odległość między cząsteczkami jest w przybliżeniu równa średnicy cząsteczki. Wraz ze spadkiem odległości między cząsteczkami (ściskanie cieczy) siły odpychania gwałtownie rosną, więc ciecze są nieściśliwe.
Pod względem struktury i charakteru ruchu termicznego ciecze zajmują pozycję pośrednią między ciałami stałymi a gazami.
Chociaż różnica między cieczą a gazem jest znacznie większa niż między cieczą a ciałem stałym. Na przykład podczas topienia lub krystalizacji objętość ciała zmienia się wielokrotnie mniej niż podczas parowania lub kondensacji.
Gazy nie mają stałej objętości i zajmują całą objętość naczynia, w którym się znajdują.
Minimalna energia potencjalna oddziaływania cząsteczek jest mniejsza niż energia kinetyczna cząsteczek.
Cząsteczki materii praktycznie nie wchodzą w interakcje.
Gazy charakteryzują się całkowitym nieuporządkowaniem układu i ruchu cząsteczek.
Jaka jest średnia odległość między cząsteczkami nasyconej pary wodnej w temperaturze 100°C?
Zadanie nr 4.1.65 z „Zebrania zadań na przygotowanie do” egzaminy wstępne w fizyce UGNTU”
Dany:
\(t=100^\circ\) C, \(l-?\)
Rozwiązanie problemu:
Rozważ parę wodną w pewnej dowolnej ilości równej \(\nu\) mol. Aby określić objętość \ (V \) zajmowaną przez daną ilość pary wodnej, musisz użyć równania Clapeyrona-Mendeleeva:
W tym wzorze \(R\) jest uniwersalną stałą gazową, równą 8,31 J/(mol·K). Ciśnienie nasyconej pary wodnej \(p\) w temperaturze 100 ° C wynosi 100 kPa, to znany fakt i każdy uczeń powinien wiedzieć.
Aby określić liczbę cząsteczek pary wodnej \(N\), posługujemy się następującym wzorem:
Tutaj \(N_A\) to liczba Avogadro, równa 6,023 10 23 1/mol.
Następnie dla każdej cząsteczki jest sześcian o objętości \(V_0\), oczywiście określony wzorem:
\[(V_0) = \frac(V)(N)\]
\[(V_0) = \frac((\nu RT))((p\nu (N_A))) = \frac((RT))((p(N_A)))\]
Teraz spójrz na diagram problemu. Każda cząsteczka jest konwencjonalnie umieszczona we własnym sześcianie, odległość między dwiema cząsteczkami może wynosić od 0 do \(2d\), gdzie \(d\) jest długością krawędzi sześcianu. Średnia odległość \(l\) będzie równa długości krawędzi sześcianu \(d\):
Długość krawędzi \(d\) można znaleźć tak:
W rezultacie otrzymujemy następującą formułę:
Przeliczmy temperaturę na skalę Kelvina i obliczmy odpowiedź:
Odpowiedź: 3,72 nm.
Jeśli nie rozumiesz rozwiązania i masz jakieś pytanie lub znalazłeś błąd, możesz zostawić komentarz poniżej.
Cząsteczki są bardzo małe, zwykłych molekuł nie widać nawet najpotężniejszym mikroskopem optycznym - ale niektóre parametry molekuł można obliczyć dość dokładnie (masa), a niektóre można oszacować tylko z grubsza (wymiary, prędkość) i byłoby miło jest zrozumieć, czym jest „rozmiar” cząsteczek” i o jakiej „prędkości molekularnej” mówimy. Tak więc masa cząsteczki jest określana jako „masa jednego mola” / „liczba cząsteczek w molu”. Na przykład dla cząsteczki wody m = 0,018/6 1023 = 3 10-26 kg (można to obliczyć dokładniej - liczba Avogadro jest znana z dobrą dokładnością, a masa molowa dowolnej cząsteczki jest łatwa do znalezienia).
Oszacowanie wielkości cząsteczki zaczyna się od pytania, jaki jest jej rozmiar. Gdyby tylko była idealnie wypolerowaną kostką! Nie jest jednak ani sześcianem, ani kulą iw ogóle nie ma jasno określonych granic. Jak być w takich przypadkach? Zacznijmy od daleka. Oszacujmy rozmiar znacznie bardziej znanego obiektu - uczniaka. Wszyscy widzieliśmy dzieci w wieku szkolnym, przyjmiemy masę przeciętnego ucznia równą 60 kg (a potem zobaczymy, czy ten wybór ma duży wpływ na wynik), gęstość ucznia jest mniej więcej taka sama jak wody (pamiętaj że warto wziąć głęboki wdech, a potem można „zawiesić się” w wodzie, prawie całkowicie zanurzonej, a jeśli wydychasz, od razu zaczynasz tonąć). Teraz możesz znaleźć objętość ucznia: V \u003d 60/1000 \u003d 0,06 metra sześciennego. metrów. Jeśli teraz przyjmiemy, że uczeń ma kształt sześcianu, to jego rozmiar zostanie określony jako pierwiastek sześcienny objętości, tj. około 0,4 m. Tak okazał się rozmiar - mniejszy niż wzrost (rozmiar "na wysokości"), większa grubość (rozmiar "w głębi"). Jeśli nie wiemy nic o kształcie ciała ucznia, to nie znajdziemy nic lepszego niż ta odpowiedź (zamiast sześcianu można by wziąć piłkę, ale odpowiedź byłaby mniej więcej taka sama, a to więcej trudna do obliczenia średnica kuli niż krawędź sześcianu). Ale jeśli mamy dodatkowe informacje (na przykład z analizy zdjęć), to odpowiedź może być znacznie bardziej rozsądna. Niech się okaże, że „szerokość” ucznia jest średnio cztery razy mniejsza od jego wzrostu, a „głębokość” trzykrotnie mniejsza. Następnie H * H / 4 * H / 12 \u003d V, stąd H \u003d 1,5 m (nie ma sensu dokonywać dokładniejszych obliczeń tak słabo określonej wartości, po prostu niepiśmienne jest skupienie się na możliwościach kalkulatora w takiej „kalkulacji”!). Otrzymaliśmy całkiem rozsądne oszacowanie wzrostu ucznia, jeśli wzięliśmy masę około 100 kg (a są takie dzieci!), to otrzymamy około 1,7 - 1,8 m - też całkiem rozsądnie.
Oszacujmy teraz wielkość cząsteczki wody. Znajdźmy objętość, która spada na jedną cząsteczkę w „ciekłej wodzie” - w niej cząsteczki są najgęściej upakowane (są mocniej do siebie dociśnięte niż w stanie stałym, „lodowym”). Mol wody ma masę 18 gi objętość 18 cu. cm. Wtedy jedna cząsteczka odpowiada objętości V= 18 10-6/6 1023 = 3 10-29 m3. Jeśli nie mamy informacji o kształcie cząsteczki wody (lub - jeśli nie chcemy brać pod uwagę złożonego kształtu cząsteczek), najprościej jest uznać ją za sześcian i znaleźć rozmiar dokładnie tak, jak właśnie znalazłem rozmiar sześciennego uczniaka: d = (V) 1/3 = 3 10-10 m. To wszystko! Możesz ocenić wpływ kształtu dość złożonych cząsteczek na wynik obliczeń, na przykład w następujący sposób: oblicz wielkość cząsteczek benzyny, uznając cząsteczki za kostki - a następnie przeprowadź eksperyment, patrząc na obszar plama po kropli benzyny na powierzchni wody. Traktując film jako „powierzchnię cieczy o grubości jednej cząsteczki” i znając masę kropli, możemy porównać wymiary uzyskane tymi dwoma metodami. Bardzo pouczający wynik!
Zastosowany pomysł nadaje się również do zupełnie innych obliczeń. Oszacujmy średnią odległość między sąsiednimi cząsteczkami rozrzedzonego gazu dla konkretnego przypadku - azotu pod ciśnieniem 1 atm i temperaturze 300K. Aby to zrobić, znajdujemy objętość, która w tym gazie spada na jedną cząsteczkę, a potem wszystko się po prostu ułoży. Weźmy więc mol azotu w tych warunkach i znajdźmy objętość porcji wskazanej w warunku, a następnie podzielmy tę objętość przez liczbę cząsteczek: V = R T / P NA = 8,3 300/105 6 1023 = 4 10 -26 m3. Przyjmiemy, że objętość jest podzielona na gęsto upakowane komórki sześcienne, a każda cząsteczka „średnio” znajduje się w centrum swojej komórki. Wtedy średnia odległość między sąsiednimi (najbliższymi) cząsteczkami jest równa krawędzi komórki sześciennej: d = (V)1/3 = 3 10-9 m. zajmują dość małą - około 1/1000 części - objętości statek. W tym przypadku również przeprowadziliśmy obliczenia bardzo w przybliżeniu - nie ma sensu dokładniej obliczać takich niezbyt określonych wartości, jak „średnia odległość między sąsiednimi cząsteczkami”.
Prawa gazowe i podstawy MKT.
Jeśli gaz jest dostatecznie rozrzedzony (a jest to powszechna rzecz, najczęściej mamy do czynienia z gazami rozrzedzonymi), to prawie każde obliczenie wykonuje się za pomocą wzoru, który wiąże ciśnienie P, objętość V, ilość gazu ν i temperaturę T - jest to słynny „stan równania gazu doskonałego” P·V= ν·R·T. Jak znaleźć jedną z tych wielkości, jeśli podane są wszystkie inne, jest dość proste i zrozumiałe. Możliwe jest jednak sformułowanie problemu w taki sposób, że pytanie będzie dotyczyło innej wielkości - na przykład gęstości gazu. Zadanie polega więc na wyznaczeniu gęstości azotu w temperaturze 300K i ciśnieniu 0,2 atm. Rozwiążmy to. Sądząc po stanie, gaz jest raczej rozrzedzony (powietrze, składające się w 80% z azotu i przy znacznie wyższym ciśnieniu, można uznać za rozrzedzone, oddychamy nim swobodnie i łatwo przez nie przechodzimy), a gdyby tak nie było, mielibyśmy jeszcze inne formuły, nie - używaj tego, kochani. Warunek nie określa objętości żadnej porcji gazu, ustalimy go sami. Weźmy 1 metr sześcienny azotu i znajdźmy ilość gazu w tej objętości. Znając masę molową azotu M = 0,028 kg / mol, znajdujemy masę tej porcji - i problem został rozwiązany. Ilość gazu ν= P V/RT, masa m = ν M = M P V/RT, stąd gęstość ρ= m/V = M P/R T = 0,028 20000/(8,3 300) 0,2 kg/m3. Wybrana przez nas objętość nigdy nie była uwzględniona w odpowiedzi, wybraliśmy ją ze względu na konkretność – tak łatwiej to rozumować, bo nie trzeba od razu zdawać sobie sprawy, że objętość może być dowolna, ale gęstość okaże się taka sama . Możesz jednak to rozgryźć - „biorąc objętość, powiedzmy, pięć razy większą, zwiększymy dokładnie pięciokrotnie ilość gazu, dlatego bez względu na objętość, jaką przyjmiemy, gęstość będzie taka sama”. Możesz po prostu przepisać swoją ulubioną formułę, zastępując w niej wyrażenie określające ilość gazu przez masę porcji gazu i jego masę molową: ν \u003d m / M, a następnie stosunek m / V \u003d MP / RT wynosi natychmiast wyrażone, a to jest gęstość . Można było wziąć mol gazu i znaleźć zajmowaną przez niego objętość, po czym od razu znajduje się gęstość, ponieważ masa mola jest znana. Ogólnie rzecz biorąc, im prostsze zadanie, tym bardziej równe i piękne sposoby jego rozwiązania ...
Oto kolejny problem, w którym pytanie może wydawać się nieoczekiwane: znajdź różnicę ciśnienia powietrza na wysokości 20 mi na wysokości 50 m nad poziomem gruntu. Temperatura 00С, ciśnienie 1 atm. Rozwiązanie: jeśli znajdziemy gęstość powietrza ρ w tych warunkach, to różnica ciśnień ∆P = ρ·g·∆H. Gęstość znajdujemy w taki sam sposób, jak w poprzednim zadaniu, jedyną trudnością jest to, że powietrze jest mieszaniną gazów. Zakładając, że składa się z 80% azotu i 20% tlenu, otrzymujemy masę mola mieszaniny: m = 0,8 0,028 + 0,2 0,032 0,029 kg. Objętość zajmowana przez ten mol wynosi V= R·T/P, a gęstość określa się jako stosunek tych dwóch wielkości. Wtedy wszystko jest jasne, odpowiedź będzie wynosić około 35 Pa.
Gęstość gazu będzie również musiała zostać obliczona podczas znajdowania na przykład siły podnoszenia balon na gorące powietrze podaną objętość, przy obliczaniu ilości powietrza w butlach do nurkowania potrzebnego do oddychania pod wodą przez znany czas, przy obliczaniu liczby osłów potrzebnych do przetransportowania określonej ilości oparów rtęci przez pustynię oraz w wielu innych przypadkach.
Ale zadanie jest bardziej skomplikowane: czajnik elektryczny głośno wrze na stole, pobór mocy 1000 W, wydajność. grzejnik 75% (reszta "odchodzi" do otaczającej przestrzeni). Z dyszy - powierzchnia „nosa” wynosi 1 cm2 - wylatuje strumień pary, oszacuj prędkość gazu w tym strumieniu. Wszystkie niezbędne dane są pobierane z tabel.
Rozwiązanie. Przyjmiemy, że para nasycona tworzy się w czajniku nad wodą, następnie strumień nasyconej pary wodnej wylatuje z dziobka o temperaturze +1000C. Ciśnienie takiej pary wynosi 1 atm, łatwo określić jej gęstość. Znając moc użytą do parowania P = 0,75 P0 = 750 W oraz ciepło właściwe parowania (parowania) r = 2300 kJ/kg, znajdujemy masę pary wytworzonej w czasie τ: m = 0,75 P0 τ/r. Znamy gęstość, wtedy łatwo obliczyć objętość tej ilości pary. Reszta jest już jasna - wyobraźmy sobie tę objętość jako kolumnę o polu przekroju 1 cm2, długość tej kolumny podzielona przez τ da nam prędkość odlotu (taka długość wylatuje w sekunda). Zatem prędkość odlotu strumienia z dziobka czajnika V = m/(ρ S τ) = 0,75P0 τ/(r ρ S τ) = 0,75P0 R T/(r P M S) = 750 8,3 373/(2,3 106 1 105 0,018 1 10-4) 5 m/s.
(c) Zilberman A.R.
Odległość tę można oszacować, znając gęstość substancji i masę molową. Koncentracja - liczba cząstek na jednostkę objętości jest związana z gęstością, masą molową i liczbą Avogadro z zależności:
gdzie jest gęstość substancji.
Odwrotność stężenia, - - to objętość per jeden cząstki, a odległość między cząstkami, a więc odległość między cząstkami:
W przypadku cieczy i ciał stałych gęstość słabo zależy od temperatury i ciśnienia, dlatego jest to praktycznie stała wartość i jest w przybliżeniu równa, tj. odległość między cząsteczkami jest rzędu wielkości samych cząsteczek.
Gęstość gazu w dużym stopniu zależy od ciśnienia i temperatury. W normalnych warunkach (ciśnienie, temperatura 273 K) gęstość powietrza wynosi około 1 kg / m3, masa molowa powietrza wynosi 0,029 kg / mol, następnie oszacowanie za pomocą wzoru (5.6) daje wartość. Tak więc w gazach odległość między cząsteczkami jest znacznie większa niż rozmiar samych cząsteczek.
Koniec pracy -
Ten temat należy do:
Fizyka
budżet federalny instytucja edukacyjna.. znakomity kształcenie zawodowe.. Orenburg państwowy instytut kierownictwo..
Jeśli potrzebujesz dodatkowych materiałów na ten temat lub nie znalazłeś tego, czego szukałeś, zalecamy skorzystanie z wyszukiwania w naszej bazie prac:
Co zrobimy z otrzymanym materiałem:
Jeśli ten materiał okazał się dla Ciebie przydatny, możesz zapisać go na swojej stronie w sieciach społecznościowych:
| ćwierkać |
Wszystkie tematy w tej sekcji:
Fizyczne podstawy mechaniki nierelatywistycznej
Mechanika bada ruch mechaniczny. Ruch mechaniczny nazywana zmianą pozycji ciał lub części ciał w stosunku do innych ciał lub części ciał.
Kinematyka punktu materialnego. Kinematyka ciała sztywnego
Sposoby definiowania ruchu punkt materialny w kinematografii. Podstawowe parametry kinematyczne: trajektoria, droga, przemieszczenie, prędkość, przyspieszenie normalne, styczne i pełne
Dynamika punktu materialnego i ruchu postępowego ciała sztywnego
Bezwładność tel. Waga. Puls. Interakcja telefoniczna. Wytrzymałość. Prawa Newtona. Rodzaje sił w mechanice. Siły przyciągania. Wspieraj reakcję i wagę. Siła sprężystości. Siła tarcia. Odkształcenie ciał stałych sprężystych. O
Dynamika rotacyjna
Podstawowe równanie dynamiki ruchu obrotowego ciała absolutnie sztywnego. Moment mocy. Moment kątowy względem punktu i osi. Moment bezwładności bryły sztywnej względem głównej
Zasady zachowania i zmiany pędu i momentu pędu w mechanice
Systemy telefoniczne Każdy zestaw ciał nazywa się systemem ciał. Jeśli na ciała włączone do systemu nie mają wpływu inne ciała, które nie są objęte systemem
Praca i moc w mechanice
Praca i siła siły i moment sił. ; ; ; ; ; Praca mechaniczna i energia potencjalna
Energia LGO
Ruch w dowolnej studni potencjału jest ruchem oscylacyjnym (ryc. 2.1.1). Rysunek 2.1.1. Ruch oscylacyjny w studni potencjału
Wahadło sprężynowe
Prawo zachowania i transformacji energii drgań wahadła sprężynowego (rys. 2.1.2): EPmax = EP + EK =
fizyczne wahadło
Prawo zachowania i transformacji energii wibracyjnej fizyczne wahadło(Rys. 2.1.3): Rys. 2.1.3. Wahadło fizyczne: O - punkt
fizyczne wahadło
Równanie podstawowego prawa dynamiki ruchu obrotowego ciała absolutnie sztywnego: (2.1.33) Ponieważ dla wahadła fizycznego (ryc. 2.1.6), to
Sprężynowe i fizyczne (matematyczne) wahadła
Do dowolnych systemów oscylacyjnych równanie różniczkowe Oscylacje własne mają postać:
Dodanie wibracji
Dodawanie drgań o tym samym kierunku Rozważ dodanie dwóch drgań harmonicznych i tej samej częstotliwości. Przemieszczenie x ciała oscylującego będzie sumą przemieszczeń xl
Tryby zaniku
β < ω0 – квазипериодический колебательный режим (рис. 2.2.2).
Рис. 2.2.2. График затухающих колебаний
Parametry tłumienia drgań
współczynnik tłumienia b Jeżeli przez pewien czas te amplituda oscylacji zmniejszy się e razy, to. potem, następny
Wahadło sprężynowe
Zgodnie z drugim prawem Newtona: , (2.2.17) gdzie (2.2.18) jest zewnętrzną siłą okresową działającą na wahadło sprężynowe.
Proces ustanawiania wymuszonych, nietłumionych oscylacji
Proces ustalania oscylacji wymuszonych nietłumionych można przedstawić jako proces sumowania dwóch oscylacji: 1. oscylacji tłumionych (rys. 2.2.8); ; &nb
Podstawy szczególnej teorii względności
Podstawy szczególnej teorii względności. Transformacje współrzędnych i czasu (1) Przy t = t’ = 0 początki współrzędnych obu układów pokrywają się: x0
Ładunki elektryczne. Sposoby pobierania opłat. Prawo zachowania ładunku elektrycznego
W naturze występują dwa rodzaje ładunków elektrycznych, umownie nazywane dodatnimi i ujemnymi. Zwyczajowo świt nazywa się historycznie pozytywnym
Oddziaływanie ładunków elektrycznych. Prawo Coulomba. Zastosowanie prawa Coulomba do obliczania sił interakcji rozciągniętych ciał naładowanych
Prawo oddziaływania ładunków elektrycznych zostało ustanowione w 1785 roku przez Charlesa Coulomba (Coulomb Sh., 1736-1806). Wisiorek mierzył siłę oddziaływania między dwiema małymi naładowanymi kulkami, w zależności od
Pole elektryczne. Siła pola elektrycznego. Zasada superpozycji pól elektrycznych
Oddziaływanie ładunków elektrycznych odbywa się poprzez specjalny rodzaj materii generowanej przez naładowane cząstki - pole elektryczne. Ładunki elektryczne zmieniają właściwości
Podstawowe równania elektrostatyki w próżni. Przepływ wektorowy natężenia pola elektrycznego. Twierdzenie Gaussa
Z definicji przepływ pola wektorowego przez teren jest wartością (Rys.2.1) Rys.2.1. O definicji przepływu wektorowego.
Zastosowanie twierdzenia Gaussa do obliczania pól elektrycznych
W wielu przypadkach twierdzenie Gaussa umożliwia znalezienie natężenia pola elektrycznego rozszerzonych naładowanych ciał bez uciekania się do obliczania niewygodnych całek. Zwykle odnosi się to do ciał, których geometria
Praca sił pola na ruch ładunku. Potencjał i różnica potencjałów pola elektrycznego
Jak wynika z prawa Coulomba, siła działająca na ładunek punktowy q w polu elektrycznym wytworzonym przez inne ładunki jest centralna. Przypomnij sobie, że centralny
Związek między natężeniem a potencjałem pola elektrycznego. gradient potencjału. Twierdzenie o krążeniu pola elektrycznego
Napięcie i potencjał to dwie cechy tego samego obiektu - pola elektrycznego, więc musi istnieć między nimi zależność funkcjonalna. Rzeczywiście, pracując z
Potencjały najprostszych pól elektrycznych
Z zależności, która określa zależność między natężeniem i potencjałem pola elektrycznego, wynika wzór na obliczenie potencjału pola: gdzie dokonuje się całkowania
Polaryzacja dielektryków. Opłaty wolne i związane. Główne rodzaje polaryzacji dielektryków
Zjawisko pojawiania się ładunków elektrycznych na powierzchni dielektryków w polu elektrycznym nazywamy polaryzacją. Otrzymane ładunki są polarne
Wektor polaryzacji i wektor indukcji elektrycznej
Do cechy ilościowe polaryzacja dielektryków wprowadza pojęcie wektora polaryzacji jako całkowitego (całkowitego) momentu dipolowego wszystkich cząsteczek na jednostkę objętości dielektryka
Natężenie pola elektrycznego w dielektryku
Zgodnie z zasadą superpozycji, pole elektryczne w dielektryku składa się wektorowo z pola zewnętrznego i pola ładunków polaryzacyjnych (rys. 3.11). lub w wartościach bezwzględnych
Warunki brzegowe dla pola elektrycznego
Przy przechodzeniu przez granicę między dwoma dielektrykami o różnych przenikalnościach ε1 i ε2 (rys. 3.12) należy wziąć pod uwagę warunki brzegowe
Pojemność elektryczna przewodników. Kondensatory
Ładunek q przekazany samotnemu przewodnikowi wytwarza wokół niego pole elektryczne, którego siła jest proporcjonalna do wielkości ładunku. Z kolei potencjał pola φ jest powiązany
Obliczanie pojemności prostych kondensatorów
Zgodnie z definicją pojemność kondensatora: , gdzie (całka jest liczona wzdłuż linii pola siły między płytami kondensatora). Dlatego ogólny wzór na obliczenie e
Energia systemu stałych opłat punktowych
Jak już wiemy, siły, z którymi oddziałują naładowane ciała, są potencjalne. Dlatego system naładowanych ciał ma energię potencjalną. Po usunięciu opłat
Obecna charakterystyka. Siła i gęstość prądu. Spadek potencjału wzdłuż przewodu przewodzącego prąd
Każdy uporządkowany ruch ładunków nazywany jest prądem elektrycznym. Nośnikami ładunku w ośrodkach przewodzących mogą być elektrony, jony, „dziury”, a nawet makroskopowo
Prawo Ohma dla jednorodnego odcinka łańcucha. Rezystancja przewodu
Istnieje zależność funkcjonalna między spadkiem potencjału - napięciem U a natężeniem prądu w przewodzie I, zwana charakterystyką prądowo-napięciową danego p
Na przeciek prąd elektryczny w przewodzie konieczne jest zachowanie różnicy potencjałów na jego końcach. Oczywiście do tego celu nie można użyć naładowanego kondensatora. Akcja
Rozgałęzione łańcuchy. Zasady Kirchhoffa
Obwód elektryczny zawierający węzły nazywany jest obwodem rozgałęzionym. Węzeł to miejsce w obwodzie, w którym zbiegają się trzy lub więcej przewodów (rys. 5.14).
Połączenie rezystancyjne
Połączenie rezystancji jest szeregowe, równoległe i mieszane. 1) Połączenie szeregowe. Po połączeniu szeregowym prąd przepływający przez wszystkie
poruszający ładunki elektryczne w obwodzie zamkniętym obecne źródło działa. Wyróżnij przydatne i pełna praca obecne źródło.
Oddziaływanie przewodników z prądem. Prawo Ampère'a
Wiadomo, że magnes trwały ma wpływ na przewodnik przewodzący prąd (na przykład pętlę przewodzącą prąd); znane jest również zjawisko odwrotne - przewodnik przewodzący prąd oddziałuje na magnes trwały (np.
Prawo Biota-Savarta-Laplace'a. Zasada superpozycji pól magnetycznych
Poruszające się ładunki elektryczne (prądy) zmieniają właściwości otaczającej przestrzeni - wytwarzają w niej pole magnetyczne. Pole to przejawia się w tym, że umieszczone w nim przewody
Obwód z prądem w polu magnetycznym. Moment magnetyczny prądu
W wielu przypadkach mamy do czynienia z prądami zamkniętymi, których rozmiary są niewielkie w porównaniu z odległością od punktu obserwacji. Takie prądy będą nazywane elementarnymi.
Pole magnetyczne na osi cewki kołowej z prądem
Zgodnie z prawem Biota-Savarta-Laplace'a indukcja pola magnetycznego wytworzonego przez bieżący element dl w odległości r od niego wynosi, gdzie α jest kątem między bieżącym elementem a promieniem
Moment sił działających na obwód z prądem w polu magnetycznym
Umieśćmy płaski prostokątny obwód (ramkę) z prądem w jednorodnym polu magnetycznym z indukcją (ryc. 9.2).
Energia obwodu z prądem w polu magnetycznym
Obwód przewodzący prąd umieszczony w polu magnetycznym ma magazyn energii. Rzeczywiście, aby obrócić obwód z prądem pod pewnym kątem w kierunku, odwrotny kierunek jego obrót w magnetycznym p
Obwód z prądem w niejednorodnym polu magnetycznym
Jeżeli obwód z prądem znajduje się w niejednorodnym polu magnetycznym (ryc. 9.4), to oprócz momentu obrotowego wpływa na niego również siła spowodowana obecnością gradientu pola magnetycznego. projekcja tego
Praca wykonana podczas przesuwania obwodu z prądem w polu magnetycznym
Rozważmy odcinek przewodnika przewodzącego prąd, który może swobodnie poruszać się po dwóch prowadnicach w zewnętrznym polu magnetycznym (ryc. 9.5). Pole magnetyczne będzie uważane za jednolite i skierowane pod kątem
Strumień wektora indukcji magnetycznej. Twierdzenie Gaussa w magnetostatyce. Wirowa natura pola magnetycznego
Przepływ wektora przez dowolną powierzchnię S nazywamy całką: , gdzie jest rzutem wektora na normalną do powierzchni S w danym punkcie (rys. 10.1). Rys.10.1. DO
Twierdzenie o cyrkulacji pola magnetycznego. Napięcie magnetyczne
Cyrkulacja pola magnetycznego wzdłuż zamknięty obwód l nazywamy całką: , gdzie jest rzutem wektora na kierunek stycznej do poziomicy w danym punkcie. Istotnych
Pole magnetyczne solenoidu i toroidu
Otrzymane wyniki zastosujmy do wyznaczenia natężenia pola magnetycznego na osi prostego długiego solenoidu i toroidu. 1) Pole magnetyczne na osi prostego długiego solenoidu.
Pole magnetyczne w materii. Hipoteza Ampère'a o prądach molekularnych. Wektor magnesowania
Różne substancje są w pewnym stopniu zdolne do magnetyzacji: to znaczy pod wpływem pola magnetycznego, w którym są umieszczone, nabierają momentu magnetycznego. Niektóre substancje
Opis pola magnetycznego w magnesach. Siła i indukcja pola magnetycznego. Podatność magnetyczna i przenikalność magnetyczna materii
Namagnesowana substancja wytwarza pole magnetyczne, które nakłada się na pole zewnętrzne (pole w próżni). Oba pola w sumie dają wynikowe pole magnetyczne z indukcją i zgodnie z
Warunki brzegowe dla pola magnetycznego
Podczas przechodzenia przez granicę między dwoma magnesami o różnych przenikalnościach magnetycznych μ1 i μ2, linie pola magnetycznego doświadczają
Momenty magnetyczne atomów i cząsteczek
Atomy wszystkich substancji składają się z dodatnio naładowanego jądra i ujemnie naładowanych elektronów poruszających się wokół niego. Każdy elektron poruszający się po orbicie tworzy kołowy prąd siły, - h
Natura diamagnetyzmu. Twierdzenie Larmora
Jeśli atom zostanie umieszczony w zewnętrznym polu magnetycznym z indukcją (ryc. 12.1), wówczas na elektron poruszający się po orbicie będzie działał moment obrotowy sił, dążąc do ustalenia momentu magnetycznego elektronu
Paramagnetyzm. Prawo Curie. Teoria Langevina
Jeśli moment magnetyczny atomów jest niezerowy, to substancja jest paramagnetyczna. Zewnętrzne pole magnetyczne ma tendencję do ustalania momentów magnetycznych atomów w tym czasie w
Elementy teorii ferromagnetyzmu. Pojęcie sił wymiany i struktura domenowa ferromagnetyków. Prawo Curie-Weissa
Jak wspomniano wcześniej, ferromagnesy charakteryzują się: wysoki stopień namagnesowanie i nieliniowa zależność od. Główna krzywa namagnesowania ferromagnesu
Siły działające na naładowaną cząstkę w polu elektromagnetycznym. Siła Lorentza
Wiemy już, że na przewodnik z prądem umieszczonym w polu magnetycznym działa siła Ampère. Ale prąd w przewodniku jest ukierunkowanym ruchem ładunków. Prowadzi to do wniosku, że siła
Ruch naładowanej cząstki w jednorodnym stałym polu elektrycznym
W tym przypadku siła Lorentza ma również tylko składnik elektryczny. Równanie ruchu cząstki w tym przypadku to: . Rozważ dwie sytuacje: a)
Ruch naładowanej cząstki w jednorodnym stałym polu magnetycznym
W tym przypadku siła Lorentza ma również tylko składnik magnetyczny. Równanie ruchu cząstki, zapisane w kartezjańskim układzie współrzędnych, to w tym przypadku: .
Praktyczne zastosowania siły Lorentza. efekt sali
Jednym z dobrze znanych przejawów siły Lorentza jest efekt odkryty przez Halla (Hall E., 1855-1938) w 1880 roku. _ _ _ _ _ _
Zjawisko indukcji elektromagnetycznej. Prawo Faradaya i zasada Lenza. EMF indukcji. Elektroniczny mechanizm występowania prądu indukcyjnego w metalach
Zjawisko indukcji elektromagnetycznej odkryto w 1831 roku. Michael Faraday (Faraday M., 1791-1867), który ustalił, że w każdym zamkniętym obwodzie przewodzącym, kiedy pot się zmienia
Zjawisko samoindukcji. Indukcyjność przewodnika
Wraz ze zmianą prądu w przewodniku zmienia się również jego własne pole magnetyczne. Wraz z nim zmienia się również strumień indukcji magnetycznej przenikający przez powierzchnię pokrytą obwodem przewodnika.
Procesy przejściowe w obwodach elektrycznych zawierających indukcyjność. Wytwarzanie i łamanie dodatkowych prądów
Przy każdej zmianie natężenia prądu w dowolnym obwodzie powstaje w nim pole elektromagnetyczne samoindukcji, które powoduje pojawienie się w tym obwodzie dodatkowych prądów, zwanych prądami dodatkowymi.
Energia pola magnetycznego. Gęstość energii
W eksperymencie, którego schemat pokazano na ryc. 14.7, po otwarciu klucza przez galwanometr przepływa przez pewien czas prąd malejący. Praca tego prądu jest równoznaczna z pracą sił zewnętrznych, których rolę odgrywa ED
Porównanie głównych twierdzeń elektrostatyki i magnetostatyki
Do tej pory badaliśmy elektryczność statyczną i pola magnetyczne, czyli takie pola, które są tworzone przez stałe ładunki i prądy stałe.
Pole elektryczne wirowe. Pierwsze równanie Maxwella
Występowanie prądu indukcyjnego w przewodzie stacjonarnym ze zmianą strumienia magnetycznego wskazuje na pojawienie się w obwodzie sił zewnętrznych, które wprawiają w ruch ładunki. Jak już
Hipoteza Maxwella o prądzie przesunięcia. Wzajemność pól elektrycznych i magnetycznych. Trzecie równanie Maxwella
Główną ideą Maxwella jest idea wzajemności pól elektrycznych i magnetycznych. Maxwell zasugerował, że źródłami są nie tylko zmienne pola magnetyczne
Forma różniczkowa równań Maxwella
1. Stosując twierdzenie Stokesa, przekształcamy lewą stronę pierwszego równania Maxwella do postaci: . Wtedy samo równanie można przepisać jako, skąd
Zamknięty układ równań Maxwella. Równania materiałowe
Aby zamknąć układ równań Maxwella, konieczne jest również wskazanie zależności między wektorami, czyli określenie właściwości środowiska materiałowego, w którym rozpatrywany jest elektromechanizm.
Konsekwencje z równań Maxwella. Fale elektromagnetyczne. prędkość światła
Rozważmy niektóre z głównych konsekwencji wynikających z równań Maxwella podanych w tabeli 2. Przede wszystkim zauważamy, że równania te są liniowe. Stąd wynika, że
Elektryczny obwód oscylacyjny. Wzór Thomsona
Drgania elektromagnetyczne mogą wystąpić w obwodzie zawierającym indukcyjność L i pojemność C (rys. 16.1). Taki obwód nazywa się obwodem oscylacyjnym. podekscytować się
Swobodne tłumione wibracje. Współczynnik jakości obwodu oscylacyjnego
Każdy rzeczywisty obwód oscylacyjny ma rezystancję (ryc. 16.3). Energia oscylacji elektrycznych w takim obwodzie jest stopniowo zużywana na podgrzanie oporu, zamieniając się w ciepło Joule'a
Wymuszone oscylacje elektryczne. Metoda diagramu wektorowego
Jeżeli zmienne źródło pola elektromagnetycznego jest zawarte w obwodzie obwodu elektrycznego zawierającego pojemność, indukcyjność i rezystancję (ryc. 16.5), to w nim wraz z własnymi tłumionymi oscylacjami,
Zjawiska rezonansowe w obwodzie oscylacyjnym. Rezonans napięcia i rezonans prądu
Jak wynika z powyższych wzorów, gdy częstotliwość zmiennej EMF ω jest równa, wartość amplitudy natężenia prądu w obwodzie oscylacyjnym przyjmuje
równanie falowe. Rodzaje i charakterystyka fal
Proces propagacji drgań w przestrzeni nazywany jest procesem falowym lub po prostu falą. Fale o różnym charakterze (dźwiękowe, sprężyste,
Fale elektromagnetyczne
Z równań Maxwella wynika, że jeśli za pomocą ładunków wzbudzone zostanie przemienne pole elektryczne lub magnetyczne, w otaczającej przestrzeni nastąpi sekwencja wzajemnych przekształceń
Energia i pęd fali elektromagnetycznej. Wskazujący wektor
Propagacji fali elektromagnetycznej towarzyszy transfer energii i pędu pole elektromagnetyczne. Aby to sprawdzić, mnożymy skalarnie pierwsze równanie Maxwella przez differ
Fale sprężyste w ciałach stałych. Analogia z falami elektromagnetycznymi
Prawa propagacji fal sprężystych w ciała stałe wynikają z ogólnych równań ruchu jednorodnego ośrodka odkształconego sprężyście: , gdzie ρ
stojące fale
Kiedy nakładają się na siebie dwie przeciwne fale o tej samej amplitudzie, powstają fale stojące. Pojawienie się fal stojących ma miejsce na przykład, gdy fale odbijają się od przeszkody. P
efekt Dopplera
Gdy źródło i (lub) odbiornik fal dźwiękowych poruszają się względem ośrodka, w którym dźwięk się rozchodzi, częstotliwość ν odbierana przez odbiornik może okazać się około
Fizyka molekularna i termodynamika
Wstęp. Przedmiot i zadania fizyki molekularnej. Fizyka molekularna bada stan i zachowanie obiektów makroskopowych pod wpływem czynników zewnętrznych (n
Ilość substancji
System makroskopowy musi zawierać liczbę cząstek porównywalną z liczbą Avogadro, aby można go było rozpatrywać w ramach fizyki statystycznej. dzwoni na numer Avogadro
Parametry kinetyczne gazu
Średnia droga swobodna - średnia odległość, jaką przebyła cząsteczka gazu pomiędzy dwoma kolejnymi zderzeniami, określa wzór: . (4.1.7) W tej formie
Idealne ciśnienie gazu
Ciśnienie gazu na ściance naczynia jest wynikiem zderzeń z nim cząsteczek gazu. Każda cząsteczka w zderzeniu przenosi pewien pęd na ścianę, dlatego działa na ścianę z n
Dyskretna zmienna losowa. Pojęcie prawdopodobieństwa
Rozważmy pojęcie prawdopodobieństwa na prostym przykładzie. Załóżmy, że w pudełku wymieszane są białe i czarne kule, które nie różnią się od siebie w żaden sposób, z wyjątkiem koloru. Dla uproszczenia, będzie
Rozkład prędkości cząsteczek
Doświadczenie pokazuje, że prędkości cząsteczek gazu znajdującego się w stanie równowagi mogą mieć bardzo różne wartości - zarówno bardzo duże, jak i bliskie zeru. Prędkość cząsteczek
Podstawowe równanie teorii kinetyki molekularnej
Średnia energia kinetyczna ruch do przodu cząsteczki są równe: . (4.2.15) Zatem temperatura bezwzględna jest proporcjonalna do średniej energii kinetycznej przepływu
Liczba stopni swobody cząsteczki
Wzór (31) określa jedynie energię ruchu translacyjnego cząsteczki. Taką średnią energię kinetyczną mają cząsteczki gazu jednoatomowego. W przypadku cząsteczek wieloatomowych konieczne jest uwzględnienie wkładu do
Energia wewnętrzna gazu doskonałego
Energia wewnętrzna gazu doskonałego jest równa całkowitej energii kinetycznej ruchu cząsteczek: Energia wewnętrzna jednego mola gazu doskonałego wynosi: (4.2.20) Wewnętrzna
wzór barometryczny. Dystrybucja Boltzmanna
Ciśnienie atmosferyczne na wysokości h zależy od ciężaru nakładających się warstw gazu. Jeśli temperatura powietrza T i przyspieszenie swobodny spadek g nie zmieniaj się wraz z wysokością, to ciśnienie powietrza P na wysokości
I zasada termodynamiki. Układ termodynamiczny. Parametry zewnętrzne i wewnętrzne. Proces termodynamiczny
Słowo „termodynamika” pochodzi od greckich słów termos – ciepło i mówca – siła. Termodynamika powstała jako nauka o siły napędowe powstające podczas procesów termicznych, o prawie
Stan równowagi. Procesy równowagi
Jeśli wszystkie parametry układu mają pewne wartości, które pozostają stałe w stałych warunkach zewnętrznych przez dowolnie długi czas, wówczas taki stan układu nazywamy równowagą lub
Mendelejew - równanie Clapeyrona
W stanie równowagi termodynamicznej wszystkie parametry układu makroskopowego pozostają niezmienne przez dowolnie długi czas w stałych warunkach zewnętrznych. Eksperyment pokazuje, że dla każdego
Energia wewnętrzna układu termodynamicznego
Oprócz termodynamiki parametry P,V i T układ termodynamiczny charakteryzuje się pewną funkcją stanu U, którą nazywamy energią wewnętrzną. Jeśli oznaczenie
Pojęcie pojemności cieplnej
Zgodnie z pierwszą zasadą termodynamiki, ilość ciepła dQ przekazanego do układu zmienia jego energię wewnętrzną dU i pracę dA, którą układ wykonuje na temperaturach zewnętrznych.
Tekst wykładu
Opracował: GumarovaSonia Faritovna Książka została wydana w wydaniu autorskim Podpisany. do wydrukowania 00.00.00. format 60x84 1/16. Bum. o
- W kontakcie z 0
- Google Plus 0
- ok 0
- Facebook 0