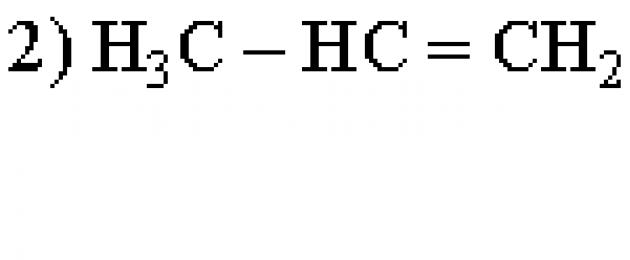Wykształcenie średnie ogólnokształcące
Wersja demonstracyjna egzaminu-2019 z chemii
Zwracamy uwagę na analizę wersji demonstracyjnej USE-2019 w chemii.Niniejszy materiał zawiera wyjaśnienia i szczegółowy algorytm rozwiązania, a także zalecenia dotyczące korzystania z podręczników i podręczników, które mogą być potrzebne w przygotowaniu do egzaminu.
24 sierpnia 2018 roku na oficjalnej stronie FIPI pojawiła się wersja demonstracyjna USE-2019 w chemii, a także specyfikacja i kodyfikator.
Podręcznik zawiera zadania szkoleniowe o podstawowym i zaawansowanym poziomie złożoności, pogrupowane według tematu i typu. Zadania są ułożone w takiej samej kolejności, jak sugerowana w wersja egzaminacyjna POSŁUGIWAĆ SIĘ. Na początku każdego rodzaju zadania należy sprawdzić elementy treści – tematy, które należy przestudiować przed przystąpieniem do realizacji. Podręcznik przyda się nauczycielom chemii, ponieważ umożliwia efektywne organizowanie proces studiowania w klasie, dyrygowanie aktualna kontrola wiedzę, a także przygotowanie uczniów do egzaminu.
Strukturę i zawartość KIM USE w chemii w 2019 roku regulują następujące dokumenty:
- Kodyfikator elementów treści i wymagań dotyczących poziomu kształcenia absolwentów organizacje edukacyjne do jednolitego egzaminu państwowego z chemii w 2019 roku;
- Specyfikacja kontrolnych materiałów pomiarowych do ujednoliconego egzaminu państwowego z chemii w 2019 roku;
- Wersja demo kontrolne materiały pomiarowe USE 2019
Kodyfikator został opracowany na podstawie federalnego komponentu stanowego standardu kształcenia średniego (pełnego) ogólnego w zakresie chemii z 2004 r. i odpowiednio określa całkowitą ilość treści sprawdzanych za pomocą pomiaru kontrolnego UŻYWAJ materiałów. Podstawa treści kontrolnych materiałów pomiarowych jest określona w kodyfikatorze ze względu na obecność w nim zoperacjonalizowanych umiejętności i czynności dwóch dużych bloków „poznać/zrozumieć” i „umieć”, które są przedstawione w wymaganiach normy.
Kodyfikator obejmuje minimum wiedzy, umiejętności, metod działań poznawczych i praktycznych, które spełnia wymagania dotyczące poziomu wyszkolenia absolwentów, a tym samym zapewnia niezależność KIM od nauczania chemii w szkole według wariantowych programów i podręczników.
V specyfikacje kontrolnych materiałów pomiarowych w chemii
- ustalono powołanie KIM USE;
- prezentowane są dokumenty określające treść KIM USE;
- opisuje podejścia do doboru treści, rozwoju struktury KIM USE
- przedstawiono strukturę KIM USE, podano charakterystykę zadań różnych typów, pokazano ich rozkład na części pracy, bloki treści i linie treści, rodzaje testowanych umiejętności i metody działania;
- wskazany jest czas na wykonanie pracy, dodatkowe materiały i sprzęt, który można wykorzystać podczas egzaminu;
- przedstawiono system oceny poszczególnych zadań i całej pracy jako całości;
- opisano zmiany w KIM USE 2019 w stosunku do 2018 roku;
- przedstawiono uogólniony plan wariantu KIM USE na rok 2019.
Wersja demo ZASTOSOWANIE w chemii 2019 opracowane w pełnej zgodności z kodyfikatorem i specyfikacją oraz umożliwia zapoznanie się z rodzajami zadań, które zostaną przedstawione w pracy egzaminacyjnej 2019, z ich stopniem skomplikowania, wymaganiami dotyczącymi kompletności i poprawności napisania szczegółowej odpowiedzi, z kryteria oceny zadań.
Należy jednak wziąć pod uwagę, że:
- zadania zawarte w demo, nie obejmują wszystkich elementów treści, który będzie testowany z wariantami CMM w 2019 roku;
- pełna lista elementów, które mogą być kontrolowane na ujednoliconym egzaminie państwowym w 2019 r. podana jest w kodyfikatorze elementów treści oraz wymagań dotyczących poziomu przygotowania absolwentów organizacji do ujednoliconego egzaminu państwowego;
- wizyta, umówione spotkanie Wersja demo ma umożliwić każdemu uczestnikowi USE i szerokiej publiczności zapoznanie się ze strukturą opcji KIM, rodzajami zadań i ich stopniem złożoności: podstawowym, zaawansowanym i wysokim.
Praca egzaminacyjna składa się z dwóch części obejmujących 35 zadań. Część 1 zawiera 29 zadań o podstawowym i zaawansowanym poziomie trudności z krótką odpowiedzią. Odpowiedzią na zadania z części 1 jest ciąg liczb lub liczba. Część 2 zawiera 6 zadań wysoki poziom Trudności z rozszerzonymi odpowiedziami. Odpowiedzi na zadania 30–35 obejmują szczegółowy opis przez cały czas trwania zadania.
Na zaliczenie pracy egzaminacyjnej z chemii przeznacza się 3,5 godziny (210 minut).
Podczas wykonywania pracy Układ okresowy pierwiastków chemicznych D.I. Mendelejew, tablica rozpuszczalności soli, kwasów i zasad w wodzie, szeregi elektrochemiczne napięć metali. Te materiały towarzyszące są dołączone do tekstu pracy. Możesz także użyć nieprogramowalnego kalkulatora.
Zadania w pracy egzaminacyjnej podzielone są na cztery bloki treści, które podzielone są na linie treści:
- „Teoretyczne podstawy chemii: „Struktura atomu. Prawo okresowe i układ okresowy pierwiastków chemicznych D.I. Mendelejew. Wzory zmian właściwości pierwiastków chemicznych według okresów i grup. „Struktura materii. Wiązanie chemiczne";
- „Substancje nieorganiczne: klasyfikacja i nazewnictwo, Właściwości chemiczne i genetyczne powiązanie substancji różnych klas”;
- „Substancje organiczne: klasyfikacja i nazewnictwo, właściwości chemiczne i pokrewieństwo genetyczne substancji różnych klas”;
- Metody poznawania chemii. Chemia i życie: reakcja chemiczna. Metody poznawania chemii. Chemia i życie. Obliczenia według wzorów chemicznych i równań reakcji.
Przy ustalaniu liczba zadań KIM USE, skupiony na sprawdzaniu asymilacji materiał edukacyjny poszczególne bloki przede wszystkim brana jest pod uwagę zajmowana przez nie przestrzeń. objętość w treści przedmiotu chemia.
Rozważ zadania przedstawione w pracy egzaminacyjnej, odnoszące się do wersji demonstracyjnej egzaminu z chemii 2019.
Blok „Struktura atomu. Prawo okresowe i układ okresowy pierwiastków chemicznych D.I. Mendelejew. Wzory zmian właściwości pierwiastków chemicznych według okresów i grup. „Struktura materii. Wiązanie chemiczne"
Blok ten zawiera zadania tylko o podstawowym poziomie złożoności, które koncentrowały się na badaniu przyswajania pojęć charakteryzujących budowę atomów pierwiastków chemicznych i budowę substancji, a także testowaniu umiejętności zastosowania prawa okresowego do porównania właściwości pierwiastków i ich związków.
Przyjrzyjmy się tym zadaniom.
Zadania 1-3 łączy jeden kontekst:
Ćwiczenie 1
Określ atomy, których z pierwiastków wskazanych w rzędzie w stanie podstawowym mają cztery elektrony na zewnętrznym poziomie energii.
Zadanie 3
Spośród wskazanych w rzędzie elementów wybierz dwa elementy, które wykazują najmniejszą wartość stopień utlenienia równy -4.
Zapisz numery wybranych elementów w polu odpowiedzi.
Do egzekucji zadania 1 konieczne jest zastosowanie wiedzy o budowie powłok elektronowych atomów pierwiastków chemicznych pierwszych czterech okresów, s-, p- oraz D- elementy, informacje uh konfiguracje elektronowe atomów, stany podstawowe i wzbudzone atomów. Prezentowane pierwiastki znajdują się w głównych podgrupach, dlatego liczba zewnętrznych elektronów ich atomów jest równa liczbie grupy, do której ten pierwiastek się znajduje. Cztery zewnętrzne elektrony mają atomy krzemu i węgla.
Zadanie 1 w 2018 roku zostało pomyślnie zrealizowane przez 61,0% zdających.
Pomyślne zadania 2 obejmuje zrozumienie znaczenia prawa okresowego D.I. Mendelejew i prawidłowości zmian właściwości chemicznych pierwiastków i ich związków według okresów i grup w związku z osobliwościami budowy atomów pierwiastków. Należy zwrócić uwagę na to, że konieczne jest nie tylko wybranie elementów, które są w tym samym okresie, ale także ułożenie ich w określonej kolejności. W tym zadaniu powinieneś ułożyć elementy w kolejności rosnącej ich metalicznych właściwości. Aby to zrobić, musimy pamiętać, że w ciągu jednego okresu zwiększania ładunku jądra atomu, właściwości metaliczne pierwiastków maleją. Dlatego w porządku rosnącym właściwości metalicznych pierwiastki III okres powinny być ułożone w kolejności: Si - Mg - Na.
W 2018 roku zadanie 2 pomyślnie wykonało 62,0% zdających.
Do egzekucji zadania 3 należy rozumieć znaczenie pojęć pierwiastka chemicznego, atomu, cząsteczki, jonu, wiązania chemicznego, elektroujemności, walencji, stopnia utlenienia, umieć określić wartościowość, stopień utlenienia pierwiastków chemicznych, ładunki jonowe, stosując podstawowe zasady teoria budowy atomu. Najniższy stopień utlenienia pierwiastków niemetalicznych określa liczba elektronów, która nie wystarcza do uzupełnienia zewnętrznego poziomu elektronicznego, który może zawierać nie więcej niż osiem elektronów. Najniższy stopień utlenienia, równy -4, będą miały pierwiastki niemetaliczne 4 grupy, w tym kontekście krzem i węgiel.
Zadanie 3 pomyślnie wykonało 80,2% uczestników egzaminu.
Wyniki realizacji tych zadań w 2018 r. wskazują, że uczniowie dość skutecznie radzą sobie z nimi, w przeciwieństwie do zadania 4 tego samego bloku, mające na celu określenie umiejętności określenia rodzaju wiązania chemicznego w związkach, określenie charakteru wiązania chemicznego (jonowe, kowalencyjne, metaliczne, wodorowe) oraz zależności właściwości związków nieorganicznych i materia organiczna na ich skład i strukturę. W 2018 roku tylko 52,6% zdających egzamin było w stanie wykonać to zadanie.
Zadanie 4
Z proponowanej listy wybierz dwa związki, w których występuje jonowe wiązanie chemiczne.
- Ca(ClO2) 2
- HClO 3
- NH4Cl
- HClO 4
- Cl2O7
Zapisz numery wybranych połączeń w polu odpowiedzi.
Wykonując to zadanie, należy przeanalizować skład jakościowy każdej substancji określonej w zadaniu. Dzieci w wieku szkolnym często nie biorą pod uwagę, że w obrębie jednej substancji mogą istnieć różne rodzaje wiązań chemicznych między atomami, w zależności od wartości ich elektroujemności. Tak więc między atomami chloru i tlenu w chloranie wapnia Ca (ClO 2) 2 występuje kowalencyjne wiązanie polarne, a między jonem chloranowym a jonowym wapniowym. Uczniowie zapominają też, że wewnątrz kationu amonowego atom azotu jest kowalencyjnie związany z atomami wodoru. wiązania polarne, ale sam kation amonowy jest związany z anionami reszt kwasowych przez wiązanie jonowe. Zatem poprawną odpowiedzią jest chloran wapnia (1) i chlorek amonu (3).
Blok „Substancje nieorganiczne”
Przyswojenie elementów treści tego bloku sprawdzają zadania o podstawowym, zaawansowanym i wysokim stopniu złożoności: łącznie 7 zadań, z czego 4 zadania o podstawowym poziomie złożoności, 2 zadania o podwyższonym poziomie złożoności i 1 zadanie o wysokim stopniu złożoności.
Zadania o podstawowym poziomie złożoności tego bloku są przedstawione zadaniami z wyborem dwóch poprawnych odpowiedzi z pięciu oraz w formie ustalenia korespondencji między pozycjami dwóch zestawów (zadanie 5).
Realizacja zadań bloku „Substancje nieorganiczne” wiąże się z wykorzystaniem szerokiego zakresu umiejętności przedmiotowych. Wśród nich są umiejętności: klasyfikowania substancji nieorganicznych i organicznych; nazywać substancje według nomenklatury międzynarodowej i trywialnej; scharakteryzować skład i właściwości chemiczne substancji różnych klas; układać równania reakcji potwierdzające związek substancji różnych klas.
Wykonując zadania 5 o podstawowym poziomie złożoności, studenci muszą wykazać się umiejętnością klasyfikowania substancji nieorganicznych według wszystkich znanych kryteriów klasyfikacyjnych, wykazując się przy tym znajomością trywialnej i międzynarodowej nomenklatury substancje nieorganiczne.
Zadanie 5
Ustal zgodność między wzorem substancji a klasą / grupą, do której należy ta substancja: dla każdej pozycji wskazanej literą wybierz odpowiednią pozycję wskazaną przez liczbę.
Wśród prezentowanych substancji NH 4 HCO 3 należy do soli kwaśnych, KF - do soli średnich, NO jest tlenkiem niesolotwórczym. Zatem poprawna odpowiedź to 431. Wyniki wykonania zadania 5 w 2018 r. wskazują, że absolwenci z powodzeniem opanowali umiejętność klasyfikacji substancji nieorganicznych: średni odsetek wykonania tego zadania wyniósł 76,3.
Nieco gorzej radzą sobie dzieci w wieku szkolnym z zadaniami o podstawowym poziomie złożoności, w których muszą stosować wiedzę o charakterystycznych właściwościach chemicznych substancji nieorganicznych różnych klas. Obejmują one zadania 6 i 7 .
Zadanie 6
Z proponowanej listy wybierz dwie substancje, z których każda reaguje bez ogrzewania.
- chlorek wapnia (roztwór)
- siarczan miedzi(II) (roztwór)
- stężony kwas azotowy
- rozcieńczony kwas solny
- tlenek glinu
Wykonując to zadanie, należy przeprowadzić następującą sekwencję operacji umysłowych: określić charakter chemiczny wszystkich proponowanych w zadaniu związków, a następnie na tej podstawie ustalić, że żelazo nie będzie reagować z roztworem chlorek wapnia i tlenek glinu oraz stężony kwas azotowy w temperaturze pokojowej pasywują żelazo. Zgodnie z pozycją w elektrochemicznym szeregu napięć, żelazo reaguje bez ogrzewania z siarczanem miedzi (II), zastępując miedź z tej soli oraz z rozcieńczonym kwasem solnym, wypierając z niej wodór. Prawidłowa odpowiedź to zatem 24.
Zadanie 7 w 2018 roku wykonało 62,8% absolwentów.
Zadanie 7
Do jednej z probówek dodano mocny kwas X z osadem wodorotlenku glinu, a do drugiej dodano roztwór substancji Y. W rezultacie zaobserwowano rozpuszczanie się osadu w każdej z probówek. Z proponowanej listy należy wybrać substancje X i Y, które mogą wejść w opisane reakcje.
- kwas bromowodorowy
- wodorosiarczek sodu
- kwas wodorosiarczkowy
- wodorotlenek potasu
- hydrat amoniaku
Zadanie 7 wymaga dogłębnej analizy warunków, zastosowania znajomości właściwości substancji oraz istoty reakcji wymiany jonowej. Zadanie 7 jest oceniane na maksymalnie 2 punkty. W 2018 roku 66,5% absolwentów ukończyło zadanie 7.
Przy wykonywaniu zadania 7, zaproponowanego w wersja demo, należy wziąć pod uwagę, że wodorotlenek glinu wykazuje właściwości amfoteryczne i wchodzi w interakcje zarówno z mocnymi kwasami, jak i zasadami. Zatem substancja X jest silnym kwasem bromowodorowym, substancja Y jest zasadowym wodorotlenkiem potasu. Prawidłowa odpowiedź to 14.
Zadania 8 oraz 9 o podwyższonym poziomie złożoności skupiają się na kompleksowym teście wiedzy o właściwościach substancji nieorganicznych. Zadania te przedstawione są w formie ustalenia korespondencji między dwoma zestawami. Wykonanie każdego z tych zadań jest oceniane na maksymalnie 2 punkty.
Zadanie 8
Ustal zgodność między formułą substancji a odczynnikami, z którymi każda ta substancja może wchodzić w interakcje: dla każdej pozycji wskazanej literą wybierz odpowiednią pozycję wskazaną przez liczbę.
FORMUŁA SUBSTANCJI |
ODCZYNNIKI |
|
|
D) ZnBr 2 (p–p) |
1) AgNO 3, Na 3 PO 4, Cl 2 2) BaO, H2O, KOH 3) H 2, Cl 2, O 2 4) HBr, LiOH, CH3COOH (roztwór) 5) H 3 PO 4 (p–p), BaCl 2, CuO |
Wpisz w tabeli wybrane liczby pod odpowiednimi literami.
Przy wykonywaniu zadania 8 konieczne jest zastosowanie wiedzy zarówno o charakterystycznych właściwościach głównych klas związków nieorganicznych, jak io specyficznych właściwościach poszczególnych przedstawicieli tych klas.
Należy więc wziąć pod uwagę, że siarka może reagować z wodorem, działając jako środek utleniający i utleniać się pod wpływem chloru i tlenu (3).
Tlenek siarki (VI) jest typowym tlenkiem kwasowym, który reaguje z tlenkiem zasadowym BaO, wodą i wodorotlenkiem potasu (2).
Wodorotlenek cynku jest amfoteryczny i może reagować zarówno z kwasami, jak i zasadami (4).
Bromek cynku może wejść w reakcję wymiany z azotanem srebra i fosforanem sodu, tworząc nierozpuszczalne sole - AgCl i Zn 3 (PO 4) 2, a także oddziaływać z chlorem, który wypiera z niego brom (1).
Więc poprawna odpowiedź to 3241.
To zadanie okazuje się tradycyjnie trudne dla uczniów: w 2018 r. 49,3% absolwentów ukończyło je w całości.
Zadanie 9 przedstawione w formie ustalenia zgodności między substancjami reagującymi a produktami reakcji między tymi substancjami.
Zadanie 9
Ustal zgodność między substancjami wyjściowymi, które wchodzą w reakcję, a produktami tej reakcji: dla każdej pozycji oznaczonej literą wybierz odpowiednią pozycję oznaczoną liczbą.
SUBSTANCJE STARTOWE |
PRODUKTY REAKCJI |
|
A) Mg i H 2 SO 4 (stęż.) B) MgO i H2SO4 B) S i H2SO4 (stęż.) D) H2S i O2 (przykład) |
1) MgSO4 i H2O 2) MgO, SO2 i H2O 3) H2S i H2O 4) SO 2 i H 2 O 5) MgSO4, H2S i H2O 6) SO3 i H2O |
Wpisz w tabeli wybrane liczby pod odpowiednimi literami.
Wykonując zadanie 9 należy przeanalizować właściwości substancji wchodzących w reakcję, warunki procesów, przewidzieć produkty tych reakcji, wybierając je z proponowanej listy. Realizacja zadania przewiduje kompleksowe wykorzystanie wiedzy o właściwościach chemicznych określonych substancji z uwzględnieniem określonych warunków reakcji między nimi. Podczas wykonywania tego zadania pożądane jest zapisanie równań odpowiednich reakcji, co ułatwi sformułowanie odpowiedzi.
Rozważ zadanie 9, przedstawione w wersji demonstracyjnej. Bierzemy pod uwagę, że stężony kwas siarkowy w reakcji z magnezem będzie wykazywał właściwości utleniające dzięki atomom siarki na stopniu utlenienia +6. Produktami reakcji są siarczan magnezu, siarkowodór i woda (5).
Tlenek magnezu jest tlenkiem zasadowym, który w interakcji z kwasem siarkowym tworzy sól – siarczan magnezu i wodę (1).
Stężony kwas siarkowy utlenia siarkę do dwutlenku siarki (4).
W nadmiarze tlenu siarkowodór utlenia się do dwutlenku siarki (4).
Więc poprawna odpowiedź to 5144.
Przyswojenie wiedzy o związkach substancji nieorganicznych sprawdza się za pomocą zadań o podstawowym stopniu złożoności z krótką odpowiedzią (zadanie 10) oraz zadania o wysokim stopniu złożoności z odpowiedzią szczegółową (zadanie 32).
Zadanie 9, podobnie jak zadanie 8, okazało się trudne dla absolwentów: w 2018 r. ukończyło je 47,4% zdających.
Rozważać zadanie 10 podstawowy poziom trudności z wersji demo.
Zadanie 10
- KCl (roztwór)
- K2O
- HCl (przykład)
- CO 2 (roztwór)
Wpisz w tabeli numery wybranych substancji pod odpowiednimi literami.
Węglan sodu można otrzymać przez oddziaływanie dwutlenek węgla z tlenkiem potasu K 2 O (2). Gdy dwutlenek węgla jest przepuszczany przez roztwór średniej soli K2CO3, tworzy się kwaśna sól KHCO3 (5). Na liście substancji proponowany jest również kwas solny, ale w jego nadmiarze powstaje dwutlenek węgla, a nie sól kwasowa. Więc prawidłowa odpowiedź to 25.
Zadanie 10, które oceniane jest na maksymalnie 2 punkty, w 2018 roku ukończyło z sukcesem 66,5% absolwentów.
Zadanie 32 wysoki poziom złożoności to opis „eksperymentu myślowego”. Aby poradzić sobie z tym zadaniem, często oprócz właściwości chemicznych substancji konieczne jest również poznanie ich właściwości fizyczne(stan skupienia, kolor, zapach itp.).
Rozważ zadanie 32 z wersji demonstracyjnej.
Zadanie 32
Podczas elektrolizy wodnego roztworu azotanu miedzi(II) uzyskano metal. Po podgrzaniu metal potraktowano stężonym kwasem siarkowym. Powstały gaz reagował z siarkowodorem, tworząc prostą substancję. Substancję tę ogrzewano stężonym roztworem wodorotlenku potasu.
Napisz równania dla czterech opisanych reakcji.
Możliwa odpowiedź:
- 2Cu (NO 3) 2 + 2H 2 O \u003d 2Cu + 4HNO 3 + O 2 (elektroliza)
- Cu + 2H 2 SO 4 (stęż.) = CuSO 4 + SO 2 + 2H 2 O
- SO2 + 2H2S \u003d 3S + 2H2O
- 3S + 6KOH = 2K 2 S + K 2 SO 3 + 3 H 2 O
(możliwe tworzenie K 2 S 2 O 3)
Zadanie 32, które oceniane jest na maksymalnie 4 punkty (jeden punkt za każde poprawnie sformułowane równanie reakcji), w 2018 roku ukończyło z sukcesem 37,6% absolwentów.
Zablokuj „Substancje organiczne”
Zawartość bloku „Substancje organiczne” to system wiedzy o najważniejszych pojęciach i teoriach chemii organicznej, charakterystycznych właściwościach chemicznych badanych substancji należących do różnych klas związków organicznych, relacji między tymi substancjami. Ten blok zawiera 9 zadań. Przyswojenie elementów treści tego bloku jest sprawdzane przez zadania o podstawowym (zadania 11-15 i 18), zaawansowanym (zadania 16 i 17) i wysokim (zadanie 33) poziomie złożoności. Zadania te testowały również kształtowanie umiejętności i czynności podobnych do tych, które zostały nazwane w odniesieniu do elementów zawartości bloku „Substancje nieorganiczne”.
Rozważ zadania bloku „Substancje nieorganiczne”.
Wykonując zadania 11 Na podstawowym poziomie złożoności studenci muszą wykazać się umiejętnością klasyfikowania substancji organicznych według wszystkich znanych kryteriów klasyfikacyjnych, wykazując się przy tym znajomością trywialnej i międzynarodowej nomenklatury substancji organicznych.
Zadanie 11
Ustal korespondencję między nazwą substancji a klasą/grupą,
do której należy ta substancja: dla każdej pozycji oznaczonej literą wybierz odpowiednią pozycję oznaczoną liczbą.
Wpisz w tabeli wybrane liczby pod odpowiednimi literami.
Wśród prezentowanych substancji metylobenzen odnosi się do węglowodorów, anilina do amin aromatycznych, a 3-metylobutanal to aldehyd. Zatem poprawna odpowiedź to 421. Wyniki wykonania zadania 11 w 2018 r. wskazują, że umiejętność klasyfikowania substancji organicznych w porównaniu z tą samą umiejętnością w odniesieniu do substancji nieorganicznych jest nieco słabiej rozwinięta wśród absolwentów: odsetek wykonania tego zadania wynosi 61,7.
Wykonując zadania 12 o podstawowym poziomie złożoności, absolwenci muszą stosować podstawowe przepisy teorii związków organicznych do analizowania budowy i właściwości substancji, określania rodzaju wiązań chemicznych w związkach, przestrzennej budowy cząsteczek, homologów i izomerów.
Zadanie 12
Z proponowanej listy wybierz dwie substancje, które są strukturalnymi izomerami butenu-1.
- butan
- cyklobutan
- butyna-2
- butadien-1,3
- metylopropen
Zapisz numery wybranych substancji w polu odpowiedzi.
Izomerami butenu-2 o wzorze cząsteczkowym C4H8 będą cyklobutan i metylopropen. Prawidłowa odpowiedź to 25.
Dla absolwentów zadanie to okazało się dość trudne: w 2018 r. średni odsetek jego realizacji wyniósł 56,2.
Zadanie 13 podstawowy poziom złożoności ma na celu zbadanie umiejętności scharakteryzowania właściwości chemicznych i głównych metod otrzymywania węglowodorów.
Zadanie 13
Z proponowanej listy wybierz dwie substancje, podczas interakcji z roztworem nadmanganianu potasu w obecności kwasu siarkowego zaobserwuje się zmianę koloru roztworu.
- heksan
- benzen
- toluen
- propan
- propylen
Zapisz numery wybranych substancji w polu odpowiedzi.
Wykonując to zadanie, należy wziąć pod uwagę, że roztwór nadmanganianu potasu w obecności kwasu siarkowego jest zdolny do utleniania węglowodorów zawierających wiązania podwójne i potrójne, a także homologi benzenowe. Spośród substancji przedstawionych w zadaniu są to toluen (metylobenzen) i propylen. Prawidłowa odpowiedź to 35. W 2018 roku tylko 57,7% absolwentów pomyślnie wykonało to zadanie.
Wykonując zadania 14 podstawowy poziom złożoności wymaga zastosowania wiedzy o charakterystycznych właściwościach chemicznych związków organicznych zawierających tlen.
Zadanie 14
Z proponowanej listy wybierz dwie substancje, z którymi reaguje formaldehyd.
- Ag2O (roztwór NH3)
- CH 3 DOS 3
Zapisz numery wybranych substancji w polu odpowiedzi.
Formaldehyd jest zdolny zarówno do reakcji redukcji, jak i utleniania: wodór (3) zredukuje go do metanolu, a pod działaniem amoniakalnego roztworu tlenku srebra (4) ulegnie utlenieniu. Prawidłowa odpowiedź to 34. Odsetek wykonania zadania 14 jest jeszcze niższy niż zadania 13: w 2018 r. pomyślnie je ukończyło tylko 56,9% absolwentów.
Zadanie 15 poziom podstawowy ma na celu sprawdzenie umiejętności scharakteryzowania właściwości chemicznych i metod otrzymywania związków organicznych zawierających azot (aminy i aminokwasy) oraz substancji o znaczeniu biologicznym (tłuszcze, węglowodany).
Zadanie 15
Z proponowanej listy wybierz dwie substancje, z którymi reaguje metyloamina.
- propan
- chlorometan
- wodór
- wodorotlenek sodu
- kwas chlorowodorowy
Zapisz numery wybranych substancji w polu odpowiedzi.
Metyloamina może reagować z chlorometanem (2), tworząc drugorzędową sól aminową – chlorek dimetyloaminy, a także z kwasem solnym (5), tworząc również sól – chlorek metyloaminy. Prawidłowa odpowiedź to 25. W 2018 roku tylko 47% uczestników egzaminu pomyślnie wykonało zadanie 15. Skrajnie niskie wyniki tego zadania pozwalają stwierdzić, że absolwenci mają słabo ugruntowaną wiedzę na temat właściwości chemicznych związków organicznych zawierających azot oraz metod ich otrzymywania. Przyczyną tego może być niedostateczna uwaga poświęcana temu elementowi treści w procesie studiowania chemii organicznej w szkole.
Zadanie 16 koncentruje się na badaniu wiedzy na temat charakterystycznych właściwości chemicznych węglowodorów oraz metod ich wytwarzania na podwyższonym poziomie złożoności.
Zadanie 16
Ustal zgodność między nazwą substancji a produktem, który powstaje głównie podczas interakcji tej substancji z bromem: dla każdej pozycji oznaczonej literą wybierz odpowiednią pozycję oznaczoną liczbą.
Wpisz w tabeli wybrane liczby pod odpowiednimi literami.
Etan wchodzi w reakcję podstawienia z bromem, tworząc bromoetan (5).
Zastąpienie atomu wodoru podczas bromowania izobutanu następuje głównie na trzeciorzędowym atomie węgla, co prowadzi do powstania 2-bromo,2-metylopropanu (2).
Bromowaniu cyklopropanu towarzyszy pękanie pierścienia z utworzeniem 1,3-dimetylopropanu (3).
Podczas bromowania cykloheksanu, w przeciwieństwie do cyklopropanu, w cyklu zachodzi reakcja podstawienia atomów wodoru i powstaje bromocykloheksan (6).
Tym samym poprawna odpowiedź to 5236. Zadanie to absolwenci zrealizowali dość pomyślnie – w 2018 r. ukończyło je 48,7% zdających.
Zadanie 17 ma na celu zbadanie umiejętności scharakteryzowania właściwości chemicznych i metod otrzymywania związków organicznych zawierających tlen (ograniczające alkohole jedno- i wielowodorotlenowe, fenol, aldehydy, kwasy karboksylowe, estry) o podwyższonym stopniu złożoności.
Zadanie 17
Ustal zgodność między reagującymi substancjami a produktem zawierającym węgiel, który powstaje podczas interakcji tych substancji: dla każdej pozycji wskazanej literą wybierz odpowiednią pozycję wskazaną przez liczbę.
Wpisz w tabeli wybrane liczby pod odpowiednimi literami.
Do pomyślnego wykonania takich zadań konieczne jest nie tylko zastosowanie wiedzy o właściwościach chemicznych związków organicznych, ale także opanowanie terminologii chemicznej. Ponadto konieczne jest spisanie równań reakcji wskazanych w warunku, aby upewnić się, że odpowiedź jest poprawna.
Produktem reakcji kwasu octowego i siarczku sodu jest octan sodu (5) i siarkowodór.
Kwas mrówkowy reaguje z wodorotlenkiem sodu, tworząc mrówczan sodu (4) i wodę.
Kwas mrówkowy pod działaniem wodorotlenku miedzi (II) po podgrzaniu utlenia się do dwutlenku węgla (6).
Produktem reakcji etanolu z sodem jest etanolan sodu (2) i wodór.
Zatem poprawna odpowiedź to 5462. W 2018 r. 48,6% zdających z powodzeniem wykonało zadanie 17.
Sprawdzana jest asymilacja elementu zawartości „związek węglowodorów i związków organicznych zawierających tlen” zadanie 18 podstawowy poziom trudności i zadanie 33 wysoki poziom złożoności.
Zadanie 18
Podano następujący schemat przemian substancji:
Określ, które z podanych substancji są substancjami X i Y.
- Cu(OH)2
- NaOH (H2O)
- NaOH (alkohol)
Wpisz w tabeli numery wybranych substancji pod odpowiednimi literami.
Etanol można otrzymać z chloroetanu pod działaniem wodnego roztworu zasady (4). Aldehyd octowy powstaje w wyniku oddziaływania etanolu z tlenkiem miedzi (II) (2) po podgrzaniu. Prawidłowa odpowiedź to 52. Wykonanie tego zadania zostało ocenione maksymalnie na 2 punkty. W 2018 r. pomyślnie je ukończyło tylko 56,4% zdających.
Rozważ także zadanie 33 o wysokim stopniu złożoności, które testuje asymilację związku związków organicznych różnych klas.
Zadanie 33
Napisz równania reakcji, które można wykorzystać do przeprowadzenia następujących przekształceń:
Pisząc równania reakcji, korzystaj ze wzorów strukturalnych substancji organicznych.
Możliwa odpowiedź:
W temperaturze 180 °C w obecności stężonego kwasu siarkowego propanol-1 ulega odwodnieniu z wytworzeniem propenu:
Propen oddziałując z chlorowodorem tworzy głównie 2-chloropropan zgodnie z regułą Markownikowa:

Pod działaniem wodnego roztworu zasady 2-chloropropan hydrolizuje się do propanolu-2:
Ponadto propen (X 1) należy ponownie otrzymać z propanolu-2, co można przeprowadzić w wyniku wewnątrzcząsteczkowej reakcji odwodnienia w temperaturze 180 ° C pod działaniem stężonego kwasu siarkowego:
Produktem utleniania propenu wodnym roztworem nadmanganianu potasu na zimno jest alkohol dwuwodorotlenowy propanodiol-1,2, nadmanganian potasu zostaje zredukowany do tlenku manganu(IV), który tworzy brązowy osad:

W 2018 roku 41,1% zdających było w stanie wykonać to zadanie całkowicie poprawnie.
Blok „Reakcja chemiczna. Metody poznawania chemii. Chemia i życie. Obliczenia według wzorów chemicznych i równań reakcji”
Asymilację elementów zawartości tego bloku sprawdzają zadania o różnym stopniu złożoności, w tym 4 zadania o podstawowym poziomie złożoności, 4 zadania o podwyższonym poziomie złożoności i 2 zadania o wysokim poziomie złożoności.
Realizacja zadań tego bloku przewiduje weryfikację kształtowania umiejętności: wykorzystania w określonych sytuacjach wiedzy o zastosowaniu badanych substancji i procesach chemicznych, przemysłowych metodach otrzymywania określonych substancji i metodach ich przetwarzania; zaplanować eksperyment w celu pozyskania i rozpoznania najważniejszych substancji nieorganicznych i organicznych w oparciu o zdobytą wiedzę na temat zasad bezpiecznej pracy z substancjami w życiu codziennym; wykonywać obliczenia na wzorach i równaniach chemicznych.
Niektóre elementy zawartości tego bloku, takie jak określenie charakteru środowiska wodnych roztworów substancji, wskaźniki, obliczenia ułamka masowego lub objętościowego plonu produktu reakcji z teoretycznie możliwego, obliczenia masy frakcję (masę) związku chemicznego w mieszaninie sprawdzano w ramach jednego zadania w połączeniu z innymi elementami zawartości.
Rozważ zadania tego bloku z wersji demo.
Zadanie 19 mające na celu sprawdzenie umiejętności klasyfikacji reakcji chemicznych w chemii nieorganicznej i organicznej według wszystkich znanych kryteriów klasyfikacyjnych.
Zadanie 19
Z proponowanej listy typów reakcji wybierz dwa typy reakcji, które obejmują oddziaływanie metali alkalicznych z wodą.
- katalityczny
- jednorodny
- nieodwracalny
- redoks
- Reakcja neutralizacji
Zapisz numery wybranych typów reakcji w polu odpowiedzi.
Reakcja oddziaływania metali alkalicznych z wodą jest nieodwracalna (3) i redoks (4). Odpowiedź to 34.
Analiza wykonania zadania 19 w 2018 r. wskazuje, że uczniowie mają trudności z określeniem rodzajów reakcji w chemii nieorganicznej i organicznej: tylko 54,3% zdających wykonało to zadanie pomyślnie.
Zadanie 20 sprawdza przyswajanie umiejętności wyjaśnienia wpływu różnych czynników na szybkość reakcji chemicznej.
Zadanie 20
Z proponowanej listy wpływów zewnętrznych wybierz dwa wpływy, które prowadzą do zmniejszenia szybkości reakcji chemicznej etylenu z wodorem.
- spadek temperatury
- wzrost stężenia etylenu
- użycie katalizatora
- spadek stężenia wodoru
- wzrost ciśnienia w układzie
Wpisz w polu odpowiedzi numery wybranych wpływów zewnętrznych.
Szybkość reakcji maleje wraz ze spadkiem temperatury (1) oraz ze spadkiem stężenia reagentów, w tym przypadku wodoru (4). Przeciwnie, wzrost stężenia reagentów, zastosowanie katalizatora i wzrost ciśnienia, prowadzący do wzrostu stężenia substancji gazowych, przyczyniają się do wzrostu szybkości reakcji etylenu z wodorem. Prawidłowa odpowiedź to 14. Należy zauważyć, że zdający radzą sobie z tym zadaniem bardzo pomyślnie: odsetek jego ukończenia w 2018 r. wyniósł 78,6.
Zadania na temat „Reakcje oksydacyjno-redukcyjne” są prezentowane na egzaminie na podstawowym i wysokim poziomie złożoności. Podczas wykonywania tych zadań studenci muszą wykazać się umiejętnością określania stopnia utlenienia pierwiastków chemicznych w związkach, wyjaśniania istoty reakcji redoks oraz układania ich równań. Jednocześnie zadanie o wysokim poziomie złożoności łączy pojedynczy kontekst z zadaniem na temat „Dysocjacja elektrolityczna. Reakcje wymiany jonowej»
Zadania na podstawowym poziomie złożoności na temat „Reakcje oksydacyjno-redukcyjne” - zadania do „ustalenia korespondencji między pozycjami dwóch zestawów”. Rozważ zadanie na ten temat z wersji demo.
Zadanie 21
Ustal zgodność między równaniem reakcji a właściwością pierwiastka azotowego, który wykazuje w tej reakcji: dla każdej pozycji oznaczonej literą wybierz odpowiednią pozycję oznaczoną liczbą.
Wpisz w tabeli wybrane liczby pod odpowiednimi literami.
W reakcji A stopień utlenienia azotu nie zmienia się i pozostaje równy –3, tj. azot nie wykazuje właściwości redoks (3).
W reakcji B azot zwiększa stopień utlenienia z –3 w NH 3 do 0 w N 2, tj. jest środkiem redukującym (2).
W reakcji B azot zwiększa również stopień utlenienia z –3 w NH 3 do +2 w NO, tj. jest środkiem redukującym (2).
Więc poprawna odpowiedź to 322.
Sprawdzana jest asymilacja wiedzy o procesach elektrolizy stopów i roztworów zadanie 22 zwiększony poziom złożoności w formacie ustalania korespondencji między pozycjami dwóch zestawów.
Zadanie 22
Ustal zgodność między formułą soli a produktami elektrolizy wodnego roztworu tej soli, które zostały uwolnione na obojętnych elektrodach: dla każdej pozycji oznaczonej literą wybierz odpowiednią pozycję oznaczoną liczbą.
FORMUŁA SOLNA |
PRODUKTY DO ELEKTROLIZY |
|
Wpisz w tabeli wybrane liczby pod odpowiednimi literami.
Do wykonania tego zadania niezbędna jest znajomość i umiejętność nanoszenia na elektrody wzorów uwalniania produktu podczas elektrolizy roztworów i stopionych soli, zasad, kwasów.
Fosforan sodu jest solą utworzoną aktywny metal i utleniony kwas. Produktami elektrolizy tej soli będzie wodór na katodzie i tlen na anodzie (1).
Podczas elektrolizy wodnego roztworu chlorku potasu na katodzie będzie uwalniany wodór, a na anodzie (4) chlor.
Bromek miedzi (II) jest solą utworzoną przez metal znajdujący się w elektrochemicznym szeregu napięć po wodorze, więc tylko miedź zostanie uwolniona na katodzie. Anion bromkowy to anion kwasu beztlenowego, który zostanie utleniony na anodzie z uwolnieniem bromu (3).
Skład azotanu miedzi(II) zawiera anion zawierający tlen, który nie jest utleniany na anodzie. W wyniku utlenienia wody na anodzie uwolniony zostanie tlen (2).
Tak więc prawidłowa odpowiedź to 1432. Należy zauważyć, że uczniowie z powodzeniem radzą sobie z tym zadaniem: odsetek jego ukończenia w 2018 r. Jest wysoki - 75,0.
Zadanie 23
Ustal zgodność między nazwą soli a stosunkiem tej soli do hydrolizy: dla każdej pozycji oznaczonej literą wybierz odpowiednią pozycję oznaczoną liczbą.
Wpisz w tabeli wybrane liczby pod odpowiednimi literami.
Przy wykonywaniu tego zadania zdający muszą wykazać się znajomością procesów hydrolizy soli różnego rodzaju, w zależności od siły tworzącego je kwasu i zasady.
Chlorek amonu jest solą utworzoną ze słabej zasady i mocny kwas, więc jest hydrolizowany na kationie (1).
Siarczan potasu jest solą powstałą z mocnej zasady i mocnego kwasu, dzięki czemu nie ulega hydrolizie (3).
Węglan potasu jest solą utworzoną przez mocną zasadę i słaby kwas, dzięki czemu ulega hydrolizie anionów (2).
Siarczek glinu jest solą utworzoną przez słabą zasadę i słaby kwas, dlatego jest hydrolizowany zarówno przez kation, jak i anion, a w środowisku wodnym zachodzi całkowita i nieodwracalna hydroliza tej soli, o czym świadczy kreska w tabela rozpuszczalności (4).
Prawidłowa odpowiedź to zatem 1324. Odsetek wykonania tego zadania jest dość wysoki: w 2018 r. pomyślnie je ukończyło 62,6% zdających.
Zadania USE związane z pojęciem „równowagi chemicznej”, a także pojęciem „szybkości reakcji chemicznej”, nie wymagają obliczeń ilościowych. Do ich realizacji wystarczy zastosować wiedzę na poziomie jakościowym („przesunięcia w kierunku reakcji bezpośredniej” itp.).
Zadanie 24
Ustal zgodność między równaniem reakcji odwracalnej a kierunkiem zmiany równowagi chemicznej wraz ze wzrostem ciśnienia: dla każdej pozycji wskazanej literą wybierz odpowiednią pozycję wskazaną przez liczbę.
RÓWNANIE REAKCJI |
KIERUNEK PRZESUNIĘCIA RÓWNOWAGI CHEMICZNEJ |
|
A) N2(g) + 3H2(g) 2NH3(g) B) 2H2(g) + O2(g) 2H2O(g) C) H2 (g) + Cl2 (g) ↔ 2НCl (g) D) SO 2 (g) + Cl 2 (g) ↔ SO 2 Cl 2 (g) |
1) przesuwa się w kierunku reakcji bezpośredniej 2) przesuwa się w kierunku reakcji wstecznej 3) praktycznie się nie rusza |
Wpisz w tabeli wybrane liczby pod odpowiednimi literami.
Zadanie na temat „Równowaga chemiczna” ma na celu sprawdzenie asymilacji pojęć „odwracalnych i nieodwracalnych reakcji chemicznych”, „równowagi chemicznej”, „przesunięcia równowagi chemicznej pod wpływem różnych czynników”. Przy wykonywaniu tego zadania konieczne jest wykazanie się umiejętnością wyjaśnienia wpływu różnych czynników na zmianę równowagi chemicznej.
Reakcje A, B i D przebiegają ze spadkiem liczby cząsteczek substancji gazowych, dlatego zgodnie z zasadą Le Chateliera wraz ze wzrostem ciśnienia równowaga przesuwa się w kierunku reakcji bezpośredniej (1).
Reakcja B przebiega bez zmiany liczby cząsteczek substancji gazowych, dlatego wzrost ciśnienia nie wpłynie na przesunięcie równowagi (3). Więc poprawna odpowiedź to 1131.
W 2018 roku 64,0% zdających zrealizowało to zadanie z sukcesem.
Największe trudności dla uczestników USE pojawiają się przy wykonywaniu zadań o podwyższonym stopniu złożoności w formie „ustalenia korespondencji między pozycjami dwóch zbiorów”, które testują przyswajanie wiedzy o eksperymentalnych podstawach chemii i ogólnych wyobrażeniach o metodach przemysłowych do pozyskiwania najważniejszych substancji. Należą do nich zadania 25 i 26.
Zadanie 25 sprawdza przyswajanie wiedzy o reakcjach jakościowych na substancje nieorganiczne i organiczne.
Zadanie 25
Ustal zgodność między formułami substancji a odczynnikiem, za pomocą którego można odróżnić wodne roztwory tych substancji: dla każdej pozycji oznaczonej literą wybierz odpowiednią pozycję oznaczoną liczbą.
FORMUŁA SUBSTANCJI |
||
A) HNO 3 i NaNO 3 B) KCl i NaOH C) NaCl i BaCl 2 D) AlCl3 i MgCl2 |
Wpisz w tabeli wybrane liczby pod odpowiednimi literami.
To zadanie ma wyraźny charakter praktyczny. Przy jej wykonywaniu konieczne jest zastosowanie nie tylko wiedzy teoretycznej na temat właściwości chemicznych substancji, ale również umiejętności planowania i prowadzenia eksperymentu chemicznego. Pomyślne wykonanie tego zadania wymaga doświadczenia w przeprowadzeniu prawdziwego eksperymentu chemicznego.
Kwas azotowy można odróżnić od azotanu sodu za pomocą miedzi (1). Kwas azotowy reaguje z miedzią, tworząc niebieski azotan miedzi (II) i uwalniając tlenek azotu (IV) lub tlenek azotu (II), w zależności od stężenia. Azotan sodu nie reaguje z miedzią.
Chlorek potasu można odróżnić od wodorotlenku sodu za pomocą siarczanu miedzi (II) (5), z którym wodorotlenek sodu oddziałuje, tworząc niebieski osad wodorotlenku miedzi (II). Chlorek potasu nie wchodzi w interakcje z siarczanem miedzi (II).
Chlorek baru, w przeciwieństwie do chlorku sodu, reaguje z siarczanem miedzi (II) (5), tworząc biały krystaliczny osad siarczanu baru.
Zarówno chlorek glinu, jak i chlorek magnezu reagują z roztworem wodorotlenku sodu (2), tworząc białe bezpostaciowe osady odpowiednich wodorotlenków. Jednak wodorotlenek glinu, w przeciwieństwie do wodorotlenku magnezu, rozpuszcza się w nadmiarze roztworu alkalicznego, tk. ma właściwości amfoteryczne.
Więc poprawna odpowiedź to 1552.
Wykonywanie zadania sprawdzającego wiedzę o reakcjach jakościowych jest tradycyjnie trudne dla uczniów. W 2018 roku tylko 44,8% zdających ukończyło to zadanie z sukcesem. Wyniki tego zadania wskazują, że absolwenci nie opanowali umiejętności pracy eksperymentalnej w zakresie badania właściwości substancji i prowadzenia reakcji chemicznych. Może to wynikać ze znacznego skrócenia czasu przeznaczonego na przeprowadzenie prawdziwego eksperymentu chemicznego podczas nauki chemii w szkole.
Zadanie 26 sprawdza przyswajanie zasad pracy w laboratorium, ogólne wyobrażenia o przemysłowych metodach pozyskiwania najważniejszych substancji i ich zastosowaniu.
Zadanie 26
Ustal zgodność między substancją a jej głównym obszarem zastosowania: dla każdej pozycji oznaczonej literą wybierz odpowiednią pozycję oznaczoną cyfrą.
Wpisz w tabeli wybrane liczby pod odpowiednimi literami.
Zadanie to, podobnie jak zadanie 25, ma charakter praktyczny. Aby pomyślnie wykonać to zadanie, zdający musi posiadać wiedzę merytoryczną na temat metod otrzymywania substancji, obszarów ich zastosowania, metod rozdzielania mieszanin oraz zasad technologicznych niektórych gałęzi przemysłu chemicznego.
Substancje przedstawione w tym zadaniu znajdują szerokie zastosowanie w technologii, przemyśle i życiu codziennym. Metan jest głównie używany jako paliwo (2). Izopren to monomer do produkcji gumy (3), etylen to monomer do produkcji tworzyw sztucznych (4). Należy zauważyć, że odsetek realizacji tego zadania, nawet po zmianie jego nasycenia treścią i zmniejszeniu stopnia skomplikowania z zaawansowanego do podstawowego, nadal pozostaje niezwykle niski: w 2018 r. ukończyło je tylko 44,8% zdających.
Zadania o wysokim stopniu złożoności dotyczące tematów „Reakcje redoks” i „Reakcje wymiany jonowej” są połączone jednym kontekstem. Do egzekucji zadania 30 Zdający muszą samodzielnie wybierać z proponowanej listy substancji, pomiędzy którymi może zachodzić reakcja redoks, a nie pracować z gotowym schematem reakcji, jak miało to miejsce w latach poprzednich. Następnie należy sporządzić równanie reakcji, wprowadzić równowagę elektroniczną i wskazać czynnik utleniający i reduktor. Do egzekucji zadania 31 należy wybrać z proponowanej listy substancji, pomiędzy którymi możliwa jest reakcja wymiany jonowej, a następnie zapisać równania w postaciach cząsteczkowych, pełnych i skróconych formach jonowych. Oba zadania są warte maksymalnie 2 punkty każde. Przy wykonywaniu tego zadania studenci potrzebują również umiejętności pisania równań reakcji wymiany jonowej w formie jonowej, pełnej i zredukowanej.
Rozważ zadania 30 i 31 z jednym kontekstem z wersji demonstracyjnej.
Zadanie 30
Z zaproponowanej listy substancji wybierz substancje, pomiędzy którymi możliwa jest reakcja redoks, i zapisz równanie dla tej reakcji. Zrób wagę elektroniczną, wskaż środek utleniający i redukujący.
Do wykonania tego zadania konieczna jest analiza utleniania właściwości regenerujące proponowane substancje. Wśród proponowanych substancji nadmanganian potasu jest żywotnym środkiem utleniającym, który będzie wykazywał właściwości utleniające dzięki atomom manganu w najwyższy stopień utlenianie +7.
Siarczyn sodu, dzięki atomom siarki na pośrednim stopniu utlenienia +4, może wykazywać zarówno właściwości utleniające, jak i redukujące. Podczas interakcji z nadmanganianem potasu - silnym środkiem utleniającym - siarczyn sodu będzie środkiem redukującym, utleniającym się do siarczanu sodu.
Reakcja może zachodzić w różnych mediach, w kontekście tej listy substancji - obojętnych lub zasadowych. Zwróćmy uwagę na to, że w odpowiedzi należy napisać tylko jedno równanie reakcji redoks.
Możliwa odpowiedź:

Reduktorem jest siarczyn sodu lub siarka na stopniu utlenienia +4.
Nadmanganian potasu lub mangan na stopniu utlenienia +7 jest środkiem utleniającym.
Zadanie 31
Z proponowanej listy substancji wybierz substancje, pomiędzy którymi możliwa jest reakcja wymiany jonowej. Zapisz molekularne, pełne i skrócone równania jonowe dla tej reakcji.
Wśród tych substancji możliwa jest reakcja wymiany jonów między wodorowęglanem potasu a wodorotlenkiem potasu, w wyniku której sól kwasowa zamieni się w przeciętną.
Możliwa odpowiedź:

Zadania 30 i 31 są w stanie zróżnicować absolwentów według poziomu wykształcenia. Należy zauważyć, że komplikacja sformułowania zadania 30 spowodowała spadek odsetka jego realizacji: jeśli w 2017 roku pomyślnie je ukończyło 68% absolwentów, to w 2018 roku już tylko 41,0%.
Odsetek wykonania zadania wynosi 31 - 60,1. Jednocześnie absolwenci o wysokim poziomie wyszkolenia pewnie poradzili sobie z przygotowaniem reakcji redoks i reakcji wymiany jonowej, natomiast absolwenci słabo wyszkoleni praktycznie nie wykonali tych zadań.
Pod kontrolą UŻYWAJ pracy Chemia odgrywa dużą rolę problemy obliczeniowe. Tłumaczy się to tym, że przy ich rozwiązywaniu należy polegać na znajomości właściwości chemicznych związków, korzystać z umiejętności układania równań reakcji chemicznych, tj. wykorzystać w połączeniu podstawy teoretyczne i pewne umiejętności operacyjno-logiczne i obliczeniowe.
Rozwiązanie problemów obliczeniowych wymaga znajomości właściwości chemicznych substancji i wiąże się z wykonaniem określonego zestawu działań zapewniających uzyskanie prawidłowej odpowiedzi. Działania te obejmują:
- sporządzanie równań reakcji chemicznych (zgodnie ze stanem problemu) niezbędnych do wykonania obliczeń stechiometrycznych;
- wykonywanie obliczeń niezbędnych do znalezienia odpowiedzi na postawione pytania w stanie problemu;
- sformułowanie logicznie uzasadnionej odpowiedzi na wszystkie pytania postawione w warunkach zadania (np. określenie wielkości fizycznej – masy, objętości, ułamka masowego substancji).
Należy jednak pamiętać, że nie wszystkie te działania muszą koniecznie być obecne przy rozwiązywaniu dowolnego problemu obliczeniowego, a w niektórych przypadkach niektóre z nich mogą być używane wielokrotnie.
Zgodnie z kodyfikatorem elementów treści i wymagań dotyczących poziomu wyszkolenia absolwentów organizacji edukacyjnych do ujednoliconego egzaminu państwowego z chemii, uczniowie powinni być w stanie przeprowadzić następujące obliczenia przy użyciu wzorów chemicznych i równań reakcji:
- obliczenia z wykorzystaniem pojęcia „ułamka masowego substancji w roztworze”;
- obliczenia stosunków objętościowych gazów w reakcjach chemicznych;
- obliczenia masy substancji lub objętości gazów zgodnie ze znaną ilością substancji, masą lub objętością jednej z substancji biorących udział w reakcji;
- obliczenia efektu cieplnego reakcji;
- obliczenia masy (objętości, ilości substancji) produktów reakcji, jeżeli jedna z substancji jest podana w nadmiarze (ma zanieczyszczenia);
- obliczenia masy (objętości, ilości substancji) produktu reakcji, jeżeli jedna z substancji jest podana w postaci roztworu o określonym ułamku masowym substancji rozpuszczonej;
- ustalenie wzoru cząsteczkowego i strukturalnego substancji;
- obliczenia udziału masowego lub objętościowego wydajności produktu reakcji z teoretycznie możliwego;
- obliczenia ułamka masowego (masy) związku chemicznego w mieszaninie.
Podczas rozwiązywania problemów obliczeniowych studenci często przyznają, że: typowe błędy:
- nie rozróżniaj masy roztworu od masy substancji rozpuszczonej;
- ustalając ilość substancji gazowej, podziel jej masę przez objętość molową lub odwrotnie, podziel objętość substancji gazowej przez jej masę molową;
- zapomnij umieścić współczynniki w równaniach reakcji;
- nie stwierdzają, która substancja jest w nadmiarze (błąd ten może być również związany z brakiem umiejętności rozwiązywania problemów „nadmiar – niedobór”);
- przy obliczaniu błędnie przekształcają wzory matematyczne, nie myśląc o absurdzie otrzymanej odpowiedzi (np. produkują mnożenie, ale nie dział masa substancji rozpuszczonej do jej ułamka masowego podczas znajdowania masy roztworu).
Większość problemów obliczeniowych lepiej rozwiązać na modlitwie, ponieważ ta metoda jest bardziej racjonalna. Jednak sama metoda rozwiązania i jej racjonalność nie są brane pod uwagę przy ocenie problemów obliczeniowych. Najważniejsze, aby uczeń zademonstrował logikę zaproponowanej przez siebie metody rozwiązania i zgodnie z nią wykonał poprawne obliczenia, które powinny doprowadzić go do prawidłowej odpowiedzi.
Analiza wyników realizacji zadań obliczeniowych w 2018 r. pokazuje, że zadania obliczeniowe o nawet podstawowym poziomie złożoności sprawiają trudności uczniom w wieku szkolnym. Przede wszystkim dotyczy to zadania 28 oraz 29 . W zadaniu 28 konieczne jest wykonanie obliczeń stosunków objętościowych gazów w reakcjach chemicznych lub obliczeń z wykorzystaniem równań termochemicznych. Z zadanie 27, w którym konieczne jest wykonanie obliczeń przy użyciu pojęcia „ułamka masowego substancji w roztworze”, uczniowie radzą sobie lepiej.
Przy wykonywaniu zadań obliczeniowych o podstawowym poziomie złożoności należy zwrócić uwagę na wymiar pożądanej wartości (g, kg, l, m 3 itd.) oraz stopień dokładności jej zaokrąglenia (do liczb całkowitych, dziesiętnych , setne itd.).
Oto problemy obliczeniowe na podstawowym poziomie złożoności z wersji demo wersja egzaminu 2019
Zadanie 27
Oblicz masę azotanu potasu (w gramach), którą należy rozpuścić w 150,0 g roztworu o ułamku masowym tej soli 10%, aby otrzymać roztwór o ułamku masowym 12%. (Zapisz liczbę do dziesiątych).
Odpowiedź: ___________________
Prawidłowa odpowiedź to 3.4.
Zadanie 27 w 2018 r. pomyślnie wykonało 61,2% zdających.
Zadanie 28
W wyniku reakcji, której równanie termochemiczne
2H2 (g) + O2 (g) \u003d 2H2O (g) + 484 kJ,
Uwolniono 1452 kJ ciepła. Oblicz masę powstałej wody (w gramach). (Zapisz liczbę do najbliższej liczby całkowitej.)
Odpowiedź: ___________________
W tym przykładzie znaleziona masa powstałej wody wynosi 108 g. Zapisujemy odpowiedź: 108.
Zadanie 28 w 2018 roku pomyślnie wykonało tylko 58,3% zdających.
Zadanie 29
Oblicz masę tlenu (w gramach) potrzebną do całkowitego spalenia 6,72 litra (NO) siarkowodoru. (Zapisz liczbę do dziesiątych).
Odpowiedź: ___________________
Prawidłowa odpowiedź to 14.4.
W 2018 roku 60% absolwentów ukończyło zadanie 29.
Zadania o wysokim stopniu złożoności 34 i 35 nie zawsze są dostępne nawet dla uczniów o dobrym i doskonałym poziomie przygotowania. Podczas rozwiązywania problemu 35 wiele dzieci w wieku szkolnym nie rozumie chemii procesów opisanych w zadaniu i popełnia błędy podczas kompilowania równań reakcji. Tak więc brak zrozumienia, co oznacza wyrażenie „część substancji rozłożyła się”, nie pozwala tym studentom na sporządzenie równań dla odpowiednich reakcji i przeprowadzenie na nich niezbędnych obliczeń. Inny typowy błąd związany jest z określeniem masy powstałego roztworu, co ostatecznie prowadzi do błędnego znalezienia pożądanego udziału masowego substancji w roztworze.
Rozważać zadanie 34 wysoki poziom złożoności z wersji demo.
Zadanie 34
Gdy próbka węglanu wapnia została podgrzana, część substancji uległa rozkładowi. Jednocześnie uwolniono 4,48 l (n.o.) dwutlenku węgla. Masa stałej pozostałości wynosiła 41,2 g. Tę pozostałość dodano do 465,5 g roztworu kwasu chlorowodorowego pobranego w nadmiarze. Określ ułamek masowy soli w powstałym roztworze.
W odpowiedzi zapisz równania reakcji wskazane w stanie problemu i podaj wszystkie niezbędne obliczenia (wskaż jednostki miary pożądanego wielkości fizyczne).
Możliwa odpowiedź:
Zapisano równania reakcji:
CaCO 3 \u003d CaO + CO 2
CaCO 3 + 2HCl \u003d CaCl 2 + CO 2 + H 2 O
CaO + 2HCl = CaCl2 + H2O
Ilość związków substancji w stałej pozostałości obliczono:
n(CO2) \u003d V / V m \u003d 4,48 / 22,4 \u003d 0,2 mola
n (CaO) \u003d n (CO 2) \u003d 0,2 mol
m(CaO) = n M = 0,2 ∙ 56 = 11,2 g
m (pozostałość CaCO3) \u003d 41,2 - 11,2 \u003d 30 g
n (pozostałość CaCO3) \u003d m / M \u003d 30 / 100 \u003d 0,3 mola
Masę soli w otrzymanym roztworze obliczono:
n (CaCl 2) \u003d n (CaO) + n (CaCO 3) \u003d 0,5 mola
m(CaCl 2) \u003d n M \u003d 0,5 ∙ 111 \u003d 55,5 g
n (CO 2) \u003d n (pozostałość CaCO 3) \u003d 0,3 mol
m(CO2) \u003d n M \u003d 0,3 ∙ 44 \u003d 13,2 g
Udział masowy chlorku wapnia w roztworze oblicza się:
m (roztwór) \u003d 41,2 + 465,5 - 13,2 \u003d 493,5 g
w(CaCl 2) \u003d m (CaCl 2) / m (roztwór) \u003d 55,5 / 493,5 \u003d 0,112 lub 11,2%
W 2018 r. 21,3% zdających wykonało całkowicie zadanie 34 i otrzymało za jego wykonanie maksymalnie cztery punkty.
Wykonując zadania 35 wymagane jest nie tylko określenie wzoru cząsteczkowego substancji organicznej, ale także, na podstawie właściwości chemicznych opisanych w warunku ustalenia jej właściwości chemicznych, ustalenie jej wzoru strukturalnego, a także sporządzenie równania dla jednej substancji organicznej. charakterystycznych reakcji chemicznych z udziałem tej substancji. Rozważ problem 35 o wysokim stopniu złożoności.
Zadanie 35
Substancja organiczna A zawiera 11,97% azotu, 9,40% wodoru i 27,35% tlenu masowo i powstaje w reakcji substancji organicznej B z propanolem-2. Wiadomo, że substancja B jest pochodzenia naturalnego i może wchodzić w interakcje zarówno z kwasami, jak i zasadami.
Na podstawie tych warunków cesji:
- przeprowadzić niezbędne obliczenia (wskazać jednostki miary wymaganych wielkości fizycznych) i ustalić wzór cząsteczkowy oryginalnej substancji organicznej;
- sporządzić wzór strukturalny tej substancji, który jednoznacznie odzwierciedla kolejność wiązania atomów w jej cząsteczce;
- napisz równanie reakcji na otrzymanie substancji A z substancji B i propanolu-2 (użyj wzorów strukturalnych substancji organicznych).
Możliwa odpowiedź:
Przeprowadzono obliczenia i ustalono wzór cząsteczkowy substancji A. Ogólny wzór substancji A to C x H y O z N m .
w(C) = 100 - 9,40 - 27,35 - 11,97 = 51,28%
x:y:z:m=51,28/12:9,4/1:27,35/16:11,97/14=5:11:2:1.
Wzór cząsteczkowy substancji A - C 5 H 11 O 2 N
Wzór strukturalny substancji A został opracowany:

Równanie reakcji otrzymywania substancji A jest napisane:
Uczniom pojawiają się trudności w kompilowaniu wzoru strukturalnego pożądanej substancji organicznej, która jednoznacznie odzwierciedla jej właściwości, a także w kompilowaniu równania reakcji zgodnie ze stanem problemu. Tylko 25,7% zdających w 2018 roku było w stanie w pełni podołać temu zadaniu i uzyskać maksymalnie 3 punkty za jego rozwiązanie.
Należy zauważyć, że zadania ze szczegółową odpowiedzią mogą być realizowane przez absolwentów na różne sposoby.
Na zakończenie podkreślamy kilka podstawowych zasad organizacji przygotowania uczniów do egzaminu.
Głównym zadaniem przygotowania do egzaminu powinna być celowa praca nad powtórzeniem, usystematyzowaniem i uogólnieniem przerabianego materiału, wprowadzeniem do systemu wiedzy kluczowych pojęć z przedmiotu chemia.
Nie da się również sprowadzić przygotowania do egzaminu tylko do szkolenia w zakresie wykonywania zadań zbliżonych do zadań z pracy egzaminacyjnej roku bieżącego. Należy szeroko stosować różnego rodzaju zadania w różnych formatach, które mają na celu nie tylko powielanie zdobytej wiedzy, ale testowanie kształtowania umiejętności zastosowania wiedzy teoretycznej w nowych sytuacjach uczenia się.
Podczas studiowania, powtarzania i konsolidowania materiałów edukacyjnych konieczne jest korzystanie z różnych zadań, w tym związanych z przekształcaniem informacji z jednej formy do drugiej: kompilacja tabel ogólnych, diagramów wykresów, diagramów, wykresów, notatek itp.
I oczywiście podstawową rolę w przygotowaniu do egzaminu odgrywa doświadczenie i wiedza zdobyta przez uczniów podczas wykonywania i omawiania wyników prawdziwego eksperymentu chemicznego, na co należy zwrócić szczególną uwagę w procesie studiowania szkolnego kursu chemii .
Praca próbna klasa 8
Specyfikacja CMM do wykonywania prac kontrolnych nr 1 na temat „Atomów pierwiastków chemicznych”
Cel testu: ocena stopnia opanowania przez każdego studenta treści tematu „Atomy pierwiastków chemicznych”
„Treść zadań kontrolnych jest określona przez treść program pracy na temat „Atomy pierwiastków chemicznych” Przedmiot"chemia": substancja prosta i złożona, pierwiastek chemiczny, układ okresowy pierwiastków chemicznych, wzór chemiczny, względne masy atomowe i cząsteczkowe, budowa atomowa, budowa powłok elektronowych, wiązanie chemiczne.
Poziom trudności
Kod według specyfikatora
Rodzaj pracy
Temat
Wynik w punktach
1
b
C-1.6.
W GÓRĘ-1,2
Zadanie jakościowe
Prosta i złożona sprawa
2 minuty.
1b
2
b
C-4.5.
UP-1.2.
Zadanie jakościowe
2 minuty.
1b
3
b
C-1.2.
UP-2.5.1
Zadanie jakościowe
Układ okresowy
2 minuty.
1b
4
b
C-1.1.
UP-1.2.
Zadanie jakościowe
izotopy
2 minuty.
1b
5
b
C-1.1.
UP-2.2.1.
Zadanie jakościowe
Struktura atomu
2 minuty.
1b
6
b
C-1.1.
UP-2.4.5
Zadanie jakościowe
2 minuty.
1b
7
b
C-1.1.
UP-2.5.1.
Zadanie jakościowe
Struktura powłoki elektronowej
2 minuty.
1b
8
b
C-1.3.
W GÓRĘ-1,2
Zadanie jakościowe
Elektroujemność
2 minuty.
1b
9
b
C-1.2.
UP-2.4.5
Zadanie jakościowe
Układ okresowy
2 minuty.
1b
10
b
C-1.2.1.
UP-2.2.1.
Problem projektowy
Struktura atomu
2 minuty.
1b
11
P
C-1.6.
UP-1.1.
Dopasowanie
Znaki pierwiastków chemicznych
4 min.
2b
12
P
C-4.5.
UP-1.2.
Względna masa cząsteczkowa
4 min
2b
13
V
C-1.1.
UP-2.5.1
Elektroniczna struktura atomu
8 minut
3b
14
V
C-1.3.
UP-1.2.
Rodzaje wiązań chemicznych
8 min.
3b
Kodyfikator
praca kontrolna nr 1na temat „Atomy pierwiastków chemicznych”
KOD
1
Substancja
Prawo okresowe i układ okresowy pierwiastków chemicznych D.I. Mendelejew 1
1.2.1
Grupy i okresy układu okresowego. Fizyczne znaczenie numeru seryjnego pierwiastka chemicznego
1.2.2
Wzory zmian właściwości pierwiastków i ich związków w związku z pozycją pierwiastków w układzie okresowym D.I. Mendelejew
Atomy i cząsteczki. Pierwiastek chemiczny. Substancje proste i złożone
4
Wykonywanie obliczeń na podstawie wzorów i równań reakcji
KOD
1
Poznaj/zrozum:
1.2.
najważniejsze pojęcia chemiczne: substancja, pierwiastek chemiczny, atom, cząsteczka, względne masy atomowe i cząsteczkowe, wiązanie chemiczne.
2.
móc zadzwonić
2.1.1
pierwiastki chemiczne;
2.2
być w stanie wyjaśnić
2.2.1
fizyczne znaczenie liczby atomowej (seryjnej) pierwiastka chemicznego, liczb grupy i okresu w układzie okresowym D.I. Mendelejew, do którego należy element;
2.4
być w stanie zidentyfikować
2.4.1
2.5
Komponować:
2.5.1.
schematy budowy atomów pierwszych 20 pierwiastków układu okresowego D.I. Mendelejew;
Część 1 zawiera 10 zadań na poziomie podstawowym. Każde pytanie ma 4 możliwe odpowiedzi, z których tylko jedna jest poprawna. Za wykonanie każdego zadania - 1 pkt.
13
wynik
Maksymalny wynik
14.
wynik
Przedstawiana jest poprawna odpowiedź na pytanie oraz wystarczające uzasadnienie, które nie zawiera błędów.
Przedstawiono poprawną odpowiedź na pytanie, ale jej uzasadnienie nie jest dostatecznie kompletne
Podana jest tylko poprawna odpowiedź
Maksymalny wynik
Liczba punktów
Mniej niż 7
7-10
11-15
16-20
Stopień
Poziom osiągnięć
Niski
Baza
podniesiony
Praca próbna klasa 8
Specyfikacja KIM dotycząca monitoringu prac kontrolnych za I półrocze.
Rodzaj kontroli: monitoring wewnętrzny
Cel testu: ocena stopnia opanowania przez każdego studenta treści tematów „Atomów pierwiastków chemicznych”, „Rodzaje wiązań chemicznych”, „Substancje proste. Stosunki ilościowe”, „Związki pierwiastków chemicznych”
Treść zadań kontrolnych określona jest treścią programu prac na tematy: „Atomy pierwiastków chemicznych”, „Rodzaje wiązań chemicznych”, „Substancje proste. Stosunki ilościowe”, „Związki pierwiastków chemicznych”
Na wykonanie testu masz 45 minut. Praca składa się z 2 części i obejmuje 15 zadań.
Część 1 zawiera 10 zadań na poziomie podstawowym. Każde pytanie ma 4 możliwe odpowiedzi, z których tylko jedna jest poprawna. Za wykonanie każdego zadania - 1 pkt.
Część 2 składa się z 4 zaawansowanych zadań. Za wykonanie każdego zadania - 2 punkty, w przypadku popełnienia jednego błędu odpowiedź oceniana jest na 1 punkt. W przypadku popełnienia dwóch lub więcej błędów lub braku odpowiedzi, otrzymuje się 0 punktów. Ostatnie dwa zadania wymagają pełnej odpowiedzi. Za wykonanie zadania -3 pkt.
Maksymalna liczba punktów to 24 punkty
Przy opracowywaniu zadań uwzględniono standardy czasu zawarte w Specyfikacji GIA dla zadań o różnym stopniu złożoności i wykonania całości pracy.
Rozkład zadań według poziomów trudności, sprawdzanych elementów treści przedmiotowych, poziomu szkolenia, rodzajów zadań i czasu wykonania przedstawia tabela 1.
Poziom trudności
Kod według specyfikatora
Rodzaj pracy
Temat
Wynik w punktach
1
b
C-1.2.1. UP-1.1.1.
Zadanie jakościowe
Układ okresowy
1b
2
b
C-1.2.1. UP-1.1.1.
Zadanie jakościowe
izotopy
1b
3
b
C-1.1.1. UP-1.1.1.
Zadanie jakościowe
Struktura atomu
1b
4
b
C-1.2.1. UP-1.1.1.
Zadanie jakościowe
Struktura atomu
1b
5
b
C-1.2.1. UP-1.2.1.
Zadanie jakościowe
1b
6
b
C-1.2.1. UP-1.2.1.
Zadanie jakościowe
Układ okresowy
1b
7
b
C-1.2.1. UP-1.2.1.
Zadanie jakościowe
Alotropia
1b
8
b
C-1.2.1. UP-1.1.1.
Zadanie jakościowe
Struktura powłok elektronowych
1b
9
b
C-4.3.1. UP- 2.5.2.
Problem projektowy
Kret
1b
10
b
C-1.2.1. UP-1.1.3.
Zadanie jakościowe
Proste substancje
1b
11
P
C-1.2.1. UP-1.2.1.
Dopasowanie
Struktura atomu
2b
12
P
C-1.3.1. UP-2.4.2.
Dopasowanie
Rodzaje wiązań chemicznych
2b
13
P
C-4.3.1. UP-2.5.2.
Problem projektowy
Masa cząsteczkowa
2b
14
P
C-1.2.1. UP-1.1.3.
Dopasowanie
Zagregowany stan substancji
2b
15
P
C-4.3.3. W GÓRĘ-.
Zadanie obliczeniowe z otwartą odpowiedzią
3b
16
P
C-4.3.3. W GÓRĘ-.
Zadanie obliczeniowe z otwartą odpowiedzią
3b
Praca próbna klasa 8
Specyfikacja CMM do wykonywania prac kontrolnych nr 2 na temat „Związki pierwiastków chemicznych”
Rodzaj kontroli: monitoring wewnętrzny
Cel testu: ocena poziomu rozwoju przez każdego ucznia treści tematu „Związki pierwiastków chemicznych”
Na wykonanie testu masz 45 minut. Praca składa się z 2 części i obejmuje 14 zadań.
Część 1 zawiera 10 zadań na poziomie podstawowym. Każde pytanie ma 4 możliwe odpowiedzi, z których tylko jedna jest poprawna. Za wykonanie każdego zadania - 1 pkt.
Część 2 składa się z 2 zadań zaawansowanych i 2 zadań wysokiego poziomu. Za wykonanie zadań 11,12 - 2 punkty, jeśli popełni się jeden błąd, to odpowiedź oceniana jest na 1 punkt. W przypadku popełnienia dwóch lub więcej błędów lub braku odpowiedzi, otrzymuje się 0 punktów. Ostatnie dwa zadania wymagają pełnej odpowiedzi. Za wykonanie 13.14 zadań -3 pkt.
Maksymalna liczba punktów to 20 punktów.
Przy opracowywaniu zadań uwzględniono standardy czasu zawarte w Specyfikacji GIA dla zadań o różnym stopniu złożoności i wykonania całości pracy.
Rozkład zadań według poziomów trudności, sprawdzanych elementów treści przedmiotowych, poziomu szkolenia, rodzajów zadań i czasu wykonania przedstawia tabela 1.
Poziom trudności
Kod według specyfikatora
Rodzaj pracy
Temat
Szacowany czas wykonania zadania.
Wynik w punktach
1
b
C-1.6.
W GÓRĘ-1.1
Zadanie jakościowe
Wzory ogólne głównych klas substancji nieorganicznych.
2 minuty.
1b
2
b
C-4.5.
UP-1.2.
Zadanie jakościowe
Stan utlenienia
2 minuty.
1b
3
b
C-1.6.
W GÓRĘ-2.4.4
Zadanie jakościowe
2 minuty.
1b
4
b
C-1,6
W GÓRĘ-2.4.4
Zadanie jakościowe
Klasy związków nieorganicznych
2 minuty.
1b
5
b
C-1,6
W GÓRĘ-2.4.4
Zadanie jakościowe
Klasy związków nieorganicznych
2 minuty.
1b
6
b
C-1,6
UP-2.2.1
Zadanie jakościowe
Nomenklatura związków nieorganicznych
2 minuty.
1b
7
b
C-4.5.2
UP-2.8.1.
Problem projektowy
Ułamek masowy
2 minuty.
1b
8
b
C-1.3.
W GÓRĘ-1,2
Zadanie jakościowe
ładunek jonowy
2 minuty.
1b
9
b
C-1.2.
W GÓRĘ-1,2
Zadanie jakościowe
Kryształowa komórka
2 minuty.
1b
10
b
C-1.2.1.
UP-2.2.1.
Zadanie jakościowe
Czyste substancje i mieszaniny
2 minuty.
1b
11
P
C-1.4.
UP-1.2.
Zadanie jakościowe
Stan utlenienia
4 min.
2b
12
P
C-1,6
W GÓRĘ-2.4.4
Dopasowanie
Klasy związków nieorganicznych
4 min
2b
13
V
C-4.5.2.
UP-2.8.1
Problem projektowy
Frakcja objętości
8 minut
3b
14
V
C-5.3, 4.5.1.
UP-2.8.1
Zadanie jakościowe z otwartą odpowiedzią
Ułamek masowy, człowiek w świecie substancji.
8 min.
3b
Kodyfikator
Elementy treści i wymagania dotyczące poziomu wyszkolenia studentów do prowadzenia badań kontrolnych z chemii za I półrocze.
Sekcja 1. Kodyfikator. Elementy treści
KOD
Elementy treści zweryfikowane przez zadania CMM
1.1.1.
Budowa powłok elektronowych atomów pierwiastków pierwszych czterech okresów
1.2.1.
Prawo okresowe i układ okresowy pierwiastków chemicznych D.I. Mendelejew Wzory zmian właściwości pierwiastków i ich związków według okresów i grup
4.3.1.
Obliczanie masy substancji.
4.3.3.
Obliczenia masy substancji lub objętości gazów.
Sekcja 2. Kodyfikator. Wymagania dotyczące poziomu szkolenia.
KOD
Umiejętności i działania testowane przez zadania KIM
1.1.1.
Zrozum znaczenie najważniejszych pojęć (podkreśl je cechy charakterystyczne): substancja, pierwiastek chemiczny, atom, cząsteczka, względny atom i masy cząsteczkowe, jon, izotopy, wiązanie chemiczne, elektroujemność.
1.2.1.
Stosować podstawowe przepisy teorii chemicznych (struktura atomu, wiązanie chemiczne) do analizy struktury i właściwości substancji
1.1.3.
Użyj najważniejszych pojęć chemicznych, aby wyjaśnić poszczególne fakty i zjawiska
2.4.2.
Wyjaśnij naturę wiązania chemicznego (jonowe, kowalencyjne, metaliczne, wodorowe);
2.5.2.
obliczenia według wzorów i równań chemicznych
Test z chemii, ocena 8
Kodyfikator
Elementy treści i wymagania dotyczące poziomu wyszkolenia studentów, do prowadzeniapraca kontrolna nr 2na temat „Związki pierwiastków chemicznych”
Sekcja 1. Kodyfikator. Elementy treści
KOD
Elementy treści zweryfikowane przez zadania CMM
1
Substancja
Wartościowość pierwiastków chemicznych. Stopień utlenienia pierwiastków chemicznych
Czyste substancje i mieszaniny
Struktura substancji. Wiązanie chemiczne: kowalencyjne (polarne i niepolarne), jonowe, metaliczne
5
Chemia i życie
Człowiek w świecie substancji, materiałów i reakcji chemicznych
4
Metody poznawania substancji i zjawisk chemicznych. Eksperymentalne Podstawy Chemii
4.5.2.
Obliczanie ułamka masowego substancji rozpuszczonej w roztworze
4.5.1
Obliczanie udziału masowego pierwiastka chemicznego w substancji
Sekcja 2. Kodyfikator. Wymagania dotyczące poziomu szkolenia.
KOD
Umiejętności i działania testowane przez zadania KIM
1
wiedzieć
symbole chemiczne: znaki pierwiastków chemicznych, wzory związków chemicznych, równania reakcji chemicznych;
1.2.
najważniejsze pojęcia chemiczne: substancja, pierwiastek chemiczny, atom, cząsteczka, względne masy atomowe i cząsteczkowe, jon, kation, anion, wiązanie chemiczne, elektroujemność, wartościowość, stopień utlenienia, mol, masa molowa, objętość molowa, roztwory, elektrolity i nieelektrolity, dysocjacja elektrolityczna, czynnik utleniający i redukujący, utlenianie i redukcja, ciepło reakcji, główne typy reakcji w chemii nieorganicznej;
2.
Dowiedz się, jak nazwać:
2.1.2
związki badanych klas substancji nieorganicznych
2.2
Definiować:
2.4.1
skład substancji zgodnie z ich formułami;
2.4,2
wartościowość i stopień utlenienia pierwiastka w związku
2.4.4
przynależność substancji do określonej klasy związków
2.5
Komponować:
2.5.2.
wzory związków nieorganicznych badanych klas;
Oblicz:
2.8.1
ułamek masowy pierwiastka chemicznego według wzoru
System oceny testów z chemii
Część 1 zawiera 10 zadań na poziomie podstawowym. Każde pytanie ma 4 możliwe odpowiedzi, z których tylko jedna jest poprawna. Za wykonanie każdego zadania - 1 pkt.
Część 2 składa się z 2 zadań zaawansowanych i 2 zadań wysokiego poziomu. Za wykonanie zadań 11,12 - 2 punkty, jeśli popełni się jeden błąd, to odpowiedź oceniana jest na 1 punkt. W przypadku popełnienia dwóch lub więcej błędów lub braku odpowiedzi, otrzymuje się 0 punktów. Ostatnie dwa zadania wymagają pełnej odpowiedzi. Za wykonanie zadania -3 pkt.
Część 2. Rozwiązywanie zadania ze szczegółową odpowiedzią.
13
wynik
Na pytanie podano poprawną odpowiedź
Przedstawiono poprawną odpowiedź na pytanie, ale popełniono błąd matematyczny
Podana jest tylko poprawna odpowiedź
Maksymalny wynik
14.
wynik
Zapisuje się wzór substancji, podaje się nazwę chemiczną, oblicza się ułamek masowy
Zapisano wzór substancji, podano nazwę chemiczną
Formuła substancji jest zapisana
Maksymalny wynik
Przełożenie wyniku testu na oceny w systemie pięciopunktowym.
Liczba punktów
Mniej niż 7
7-10
11-15
16-20
Stopień
Poziom osiągnięć
Niski
Baza
podniesiony
Praca próbna klasa 8
Specyfikacja KIM do prowadzenia prac kontrolnych nr 3 na temat „Zmiany zachodzące w substancjach”
Rodzaj kontroli: monitoring wewnętrzny
Cel testu: ocena poziomu opanowania treści tematu „Zmiany zachodzące w substancjach” przez każdego ucznia
„Treść zadań kontrolnych jest określona przez treść programu pracy na temat „Zmiany zachodzące w substancjach” przedmiotu „chemia”: zjawiska fizyczne, chemiczne, oznaki reakcji chemicznych, rodzaje reakcji chemicznych, egzotermiczne i endotermiczne reakcje, katalizator, czyste substancje, mieszaniny, metody rozdzielania mieszanin, równania chemiczne, współczynniki.
Na wykonanie testu masz 45 minut. Praca składa się z 2 części i obejmuje 14 zadań.
Część 1 zawiera 10 zadań na poziomie podstawowym. Każde pytanie ma 4 możliwe odpowiedzi, z których tylko jedna jest poprawna. Za wykonanie każdego zadania - 1 pkt.
Część 2 składa się z 2 zadań zaawansowanych i 2 zadań wysokiego poziomu. Za wykonanie zadań 11,12 - 2 punkty, jeśli popełni się jeden błąd, to odpowiedź oceniana jest na 1 punkt. W przypadku popełnienia dwóch lub więcej błędów lub braku odpowiedzi, otrzymuje się 0 punktów. Ostatnie dwa zadania wymagają pełnej odpowiedzi. Za wykonanie 13.14 zadań -3 pkt.
Maksymalna liczba punktów to 20 punktów.
Przy opracowywaniu zadań uwzględniono standardy czasu zawarte w Specyfikacji GIA dla zadań o różnym stopniu złożoności i wykonania całości pracy.
Rozkład zadań według poziomów trudności, sprawdzanych elementów treści przedmiotowych, poziomu szkolenia, rodzajów zadań i czasu wykonania przedstawia tabela 1.
Poziom trudności
Kod według specyfikatora
Rodzaj pracy
Temat
Szacowany czas wykonania zadania.
Wynik w punktach
1
b
C-2.1
W GÓRĘ-1,2
Zadanie jakościowe
Zjawiska zachodzące w substancjach.
2 minuty.
1b
2
b
C-2.1
UP-1.2.1
Zadanie jakościowe
Oznaki reakcji chemicznych.
2 minuty.
1b
3
b
C-2.1
UP-2.5.3
Zadanie jakościowe
Układ współczynników
2 minuty.
1b
4
b
C-2.2
UP-2.4.5
Zadanie jakościowe
Rodzaje reakcji chemicznych
2 minuty.
1b
5
b
C-2.2
UP-2.4.5
Zadanie jakościowe
Rodzaje reakcji chemicznych
2 minuty.
1b
6
b
C-2.2
UP-2.4.5
Zadanie jakościowe
Rodzaje reakcji chemicznych
2 minuty.
1b
7
b
C-2.1
W GÓRĘ-1,2
Zadanie jakościowe
Warunki występowania reakcji chemicznych.
2 minuty.
1b
8
b
C-2.2
W GÓRĘ-1,2
Zadanie jakościowe
Szereg metali naprężeniowych
2 minuty.
1b
9
b
C-2.1
UP-2.4.5
Zadanie jakościowe
Rodzaje reakcji chemicznych
2 minuty.
1b
10
b
C-4.5.3
UP-2.8.3
Problem projektowy
Obliczenia na równaniach chemicznych.
2 minuty.
1b
11
P
C-2.2
UP-2.4.5
Dopasowanie
Rodzaje reakcji chemicznych
4 min.
2b
12
P
C-2.2
UP-2.4.5
Dopasowanie
Rodzaje reakcji chemicznych
4 min
2b
13
V
C-2.1
UP-2.5.3
Zadanie jakościowe z otwartą odpowiedzią.
Równania chemiczne. Rodzaje reakcji chemicznych.
8 minut
3b
14
V
C-4.5.3
UP-2.9.2
Zadanie obliczeniowe z otwartą odpowiedzią
Zadanie obliczeniowe z otwartą odpowiedzią.
8 min.
3b
Test z chemii, ocena 8
Kodyfikator
Elementy treści i wymagania dotyczące poziomu wyszkolenia studentów, do prowadzeniapraca kontrolna nr 3na temat „Zmiany zachodzące w substancjach”
Sekcja 1. Kodyfikator. Elementy treści
KOD
Elementy treści zweryfikowane przez zadania CMM
Czyste substancje i mieszaniny
Reakcja chemiczna. Warunki i oznaki reakcji chemicznych. Równania chemiczne. Zachowanie masy substancji w reakcjach chemicznych
Klasyfikacja reakcji chemicznych według różnych kryteriów: liczba i skład substancji wyjściowych i otrzymanych, zmiany stopnia utlenienia pierwiastków chemicznych, absorpcja i uwalnianie energii
4.5.3
Sekcja 2. Kodyfikator. Wymagania dotyczące poziomu szkolenia.
KOD
Umiejętności i działania testowane przez zadania KIM
1
Poznaj/zrozum:
najważniejsze pojęcia chemiczne: substancja, pierwiastek chemiczny, atom, cząsteczka, względne masy atomowe i cząsteczkowe, jon, kation, anion, wiązanie chemiczne, elektroujemność, wartościowość, stopień utlenienia, mole, masa molowa, objętość molowa, roztwory, elektrolity i nie -elektrolity, dysocjacja elektrolityczna, czynnik utleniający i redukujący, utlenianie i redukcja, ciepło reakcji, główne typy reakcji w chemii nieorganicznej;
1.2.1
cechy charakterystyczne najważniejszych pojęć chemicznych;
2.
być w stanie zdefiniuj / klasyfikuj, komponuj, oblicz:
2.4.5
rodzaje reakcji chemicznych;
2.5.3
równania reakcji chemicznych
2.8.3
wykorzystać zdobytą wiedzę i umiejętności w praktycznych działaniach oraz Życie codzienne dla:
2.9.2
wyjaśnienia poszczególnych faktów i zjawisk przyrodniczych;
System oceny testów z chemii
Część 1 zawiera 10 zadań na poziomie podstawowym. Każde pytanie ma 4 możliwe odpowiedzi, z których tylko jedna jest poprawna. Za wykonanie każdego zadania - 1 pkt.
Część 2 składa się z 2 zadań zaawansowanych i 2 zadań wysokiego poziomu. Za wykonanie zadań 11,12 - 2 punkty, jeśli popełni się jeden błąd, to odpowiedź oceniana jest na 1 punkt. W przypadku popełnienia dwóch lub więcej błędów lub braku odpowiedzi, otrzymuje się 0 punktów. Ostatnie dwa zadania wymagają pełnej odpowiedzi. Za wykonanie zadania -3 pkt.
Część 2. Rozwiązywanie zadania ze szczegółową odpowiedzią.
13
wynik
Zapisano równanie reakcji chemicznej
Ustalone kursy
Wskazany typ reakcji
Maksymalny wynik
14.
wynik
Przedstawiana jest poprawna odpowiedź na pytanie oraz wystarczające uzasadnienie, które nie zawiera błędów.
Przedstawiono poprawną odpowiedź na pytanie, ale jej uzasadnienie nie jest dostatecznie kompletne
Podana jest tylko poprawna odpowiedź
Maksymalny wynik
Przełożenie wyniku testu na oceny w systemie pięciopunktowym.
Liczba punktów
Mniej niż 7
7-10
11-15
16-20
Stopień
Poziom osiągnięć
Niski
Baza
podniesiony
Praca próbna klasa 8
Specyfikacja KIM do prowadzenia prac kontrolnych nr 4 na temat „Rozwiązania. Właściwości roztworów elektrolitów »
Rodzaj kontroli: monitoring wewnętrzny
Cel testu: ocena stopnia opanowania przez każdego ucznia treści tematu „Rozwiązania. Właściwości roztworów elektrolitów»
Na wykonanie testu masz 45 minut. Praca składa się z 2 części i obejmuje 14 zadań.
Część 1 zawiera 10 zadań na poziomie podstawowym. Każde pytanie ma 4 możliwe odpowiedzi, z których tylko jedna jest poprawna. Za wykonanie każdego zadania - 1 pkt.
Część 2 składa się z 2 zadań zaawansowanych i 2 zadań wysokiego poziomu. Za wykonanie zadań 11,12 - 2 punkty, jeśli popełni się jeden błąd, to odpowiedź oceniana jest na 1 punkt. W przypadku popełnienia dwóch lub więcej błędów lub braku odpowiedzi, otrzymuje się 0 punktów. Ostatnie dwa zadania wymagają pełnej odpowiedzi. Za wykonanie 13.14 zadań -3 pkt.
Maksymalna liczba punktów to 20 punktów.
Przy opracowywaniu zadań uwzględniono standardy czasu zawarte w Specyfikacji GIA dla zadań o różnym stopniu złożoności i wykonania całości pracy.
Rozkład zadań według poziomów trudności, sprawdzanych elementów treści przedmiotowych, poziomu szkolenia, rodzajów zadań i czasu wykonania przedstawia tabela 1.
Poziom trudności
Kod według specyfikatora
Rodzaj pracy
Temat
Szacowany czas wykonania zadania.
Wynik w punktach
1
b
C-2,4
UP-1.2.2
Zadanie jakościowe
Dysocjacja elektrolityczna
2 minuty.
1b
2
b
C-2,3
UP-2.2.3.
Zadanie jakościowe
Stopień dysocjacji
2 minuty.
1b
3
b
C-2.1
UP-2.2.3
Zadanie jakościowe
Zmiana koloru wskaźników
2 minuty.
1b
4
b
C-2,5
UP-2.4.6
Zadanie jakościowe
Reakcje wymiany jonowej
2 minuty.
1b
5
b
C-2.2
UP-2.4.5
Zadanie jakościowe
Warunki występowania reakcji wymiany jonowej
2 minuty.
1b
6
b
C-2,5
UP-2.4.6
Zadanie jakościowe
Reakcje wymiany jonowej
2 minuty.
1b
7
b
C-3.2.1.
UP-2.3.3.
Zadanie jakościowe
2 minuty.
1b
8
b
C-3.2.2.
UP-2.3.3.
Zadanie jakościowe
Właściwości chemiczne głównych klas substancji nieorganicznych
2 minuty.
1b
9
b
C-2.2
UP-2.4.5
Zadanie jakościowe
2 minuty.
1b
10
b
C-3.3.
UP-2.3.4.
Zadanie jakościowe
połączenie genetyczne
2 minuty.
1b
11
P
C-2,5
UP-2.4.6
Dopasowanie
Reakcje wymiany jonowej
4 min.
2b
12
P
C-2,5
UP-2.4.5
Dopasowanie
Reakcje wymiany jonowej
4 min.
2b
13
V
C-3.2.3.,3.2.4.
UP-2.5.3
Zadanie jakościowe z otwartą odpowiedzią.
Właściwości chemiczne głównych klas substancji nieorganicznych
8 min.
3b
14
V
C-4.5.3
UP-2.8.3.
Zadanie obliczeniowe z otwartą odpowiedzią
Obliczenia na podstawie równań chemicznych objętości substancji przez masę produktów reakcji
8 min.
3b
Test z chemii, ocena 8
Kodyfikator
Elementy treści i wymagania dotyczące poziomu wyszkolenia studentów, do prowadzeniapraca kontrolna nr 4 na temat „Rozwiązania. Właściwości roztworów elektrolitów »
Sekcja 1. Kodyfikator. Elementy treści
KOD
Elementy treści zweryfikowane przez zadania CMM
2
Reakcja chemiczna
Elektrolity i nieelektrolity
Kationy i aniony. Dysocjacja elektrolityczna kwasów, zasad i soli (średnio
Reakcje wymiany jonowej i warunki ich realizacji
3
Podstawowe Podstawy Chemii Nieorganicznej
3.2.1.
3.2.2.
3.2.3.
Właściwości chemiczne kwasów
3.2.4.
Właściwości chemiczne soli
3.3.
4
.
Eksperymentalne Podstawy Chemii
4.5.3.
Obliczanie ilości substancji, masy lub objętości substancji z ilości substancji, masy lub objętości jednego z reagentów lub produktów reakcji
Sekcja 2. Kodyfikator. Wymagania dotyczące poziomu szkolenia.
KOD
Umiejętności i działania testowane przez zadania KIM
1
Poznaj/zrozum:
1.2.2
o istnieniu związku między najważniejszymi pojęciami chemicznymi
2.
być w stanie wyjaśnij/sklasyfikuj, skomponuj, oblicz:
2.2.3.
esencja procesu dysocjacja elektrolityczna i reakcje wymiany jonowej
2.3.3
właściwości chemiczne głównych klas substancji nieorganicznych (tlenki, kwasy, zasady i sole)
2.8.3
ilość substancji, objętość lub masa substancji przez ilość substancji, objętość lub masę reagentów lub produktów reakcji
2.4
określić
2.4.6.
możliwość reakcji wymiany jonowej;
2.5.
makijaż
2.5.3.
równania reakcji chemicznych
2.3.4.
System oceny testów z chemii
Część 1 zawiera 10 zadań na poziomie podstawowym. Każde pytanie ma 4 możliwe odpowiedzi, z których tylko jedna jest poprawna. Za wykonanie każdego zadania - 1 pkt.
Część 2 składa się z 2 zadań zaawansowanych i 2 zadań wysokiego poziomu. Za wykonanie zadań 11,12 - 2 punkty, jeśli popełni się jeden błąd, to odpowiedź oceniana jest na 1 punkt. W przypadku popełnienia dwóch lub więcej błędów lub braku odpowiedzi, otrzymuje się 0 punktów. Ostatnie dwa zadania wymagają pełnej odpowiedzi. Za wykonanie zadania -3 pkt.
Część 2. Rozwiązywanie zadania ze szczegółową odpowiedzią.
13
wynik
Trzy równania reakcji chemicznych zapisane są w formie molekularnej i jonowej
Dwa równania reakcji są zapisane w postaci molekularnej i jonowej
Jedno równanie reakcji zapisane w formie molekularnej i jonowej
Maksymalny wynik
14.
wynik
2) Obliczono ilość substancji i masę azotanu srebra zawartego w roztworze wyjściowym: zgodnie z równaniem reakcji
3) Obliczono udział masowy azotanu srebra w roztworze wyjściowym
Odpowiedź jest poprawna i kompletna, zawiera wszystkie elementy
3
2
1
0
Maksymalny wynik
3
Przełożenie wyniku testu na oceny w systemie pięciopunktowym.
Liczba punktów
Mniej niż 7
7-10
11-15
16-20
Stopień
2
3
4
5
Poziom osiągnięć
Niski
Baza
podniesiony
Praca próbna klasa 8
Specyfikacja KIM do wykonywania końcowych prac kontrolnych monitoringu.
Rodzaj kontroli: monitoring wewnętrzny
Cel sprawdzianu: ocena stopnia opanowania przez każdego studenta treści tematów 8 klasy przedmiotu z chemii.
Zgodnie z treścią praca pozwoli Ci sprawdzić sukces opanowania tematów:
1. Prawo okresowe i układ okresowy pierwiastków chemicznych. Budowa atomu.
2. Wiązanie chemiczne.
3. Związki pierwiastków chemicznych.
4. Reakcje chemiczne. dysocjacja elektrolityczna.
5. Metody otrzymywania substancji, zastosowanie substancji i reakcje chemiczne.
Praca ujawni kształtowanie się następujących umiejętności przedmiotowych:
1. Opisz budowę atomu, właściwości pierwiastków i ich związków według pozycji in układ okresowy.
2. Określić rodzaj wiązania chemicznego, stopień utlenienia pierwiastków chemicznych.
3. Wymieniać substancje, klasyfikować je, opisywać właściwości i metody otrzymywania.
4. Ułóż równania reakcji chemicznych różne rodzaje, równania ED.
5. Przeprowadzać obliczenia za pomocą wzorów i równań chemicznych.
Praca ujawni przyswajanie treści na poziomie podstawowym (B), zaawansowanym (P)
wysoki (w)
Na wykonanie testu masz 45 minut. Praca składa się z 2 części i obejmuje 14 zadań.
Część 1 zawiera 10 zadań na poziomie podstawowym. Każde pytanie ma 4 możliwe odpowiedzi, z których tylko jedna jest poprawna. Za wykonanie każdego zadania - 1 pkt.
Część 2 składa się z 2 zadań zaawansowanych i 2 zadań wysokiego poziomu. Za wykonanie zadań 11,12 - 2 punkty, jeśli popełni się jeden błąd, to odpowiedź oceniana jest na 1 punkt. W przypadku popełnienia dwóch lub więcej błędów lub braku odpowiedzi, otrzymuje się 0 punktów. Ostatnie dwa zadania wymagają pełnej odpowiedzi. Za wykonanie 13.14 zadań -3 pkt.
Maksymalna liczba punktów to 20 punktów.
Przy opracowywaniu zadań uwzględniono standardy czasu zawarte w Specyfikacji GIA dla zadań o różnym stopniu złożoności i wykonania całości pracy.
Rozkład zadań według poziomów trudności, sprawdzanych elementów treści przedmiotowych, poziomu szkolenia, rodzajów zadań i czasu wykonania przedstawia tabela 1.
Poziom trudności
Kod według specyfikatora
Rodzaj pracy
Temat
Szacowany czas wykonania zadania.
Wynik w punktach
1
b
C-1.6.
UP-1.3.
Zadanie jakościowe
Wzory chemiczne
2 minuty
1b
2
b
C-1.1.
UP-1.1.
Zadanie jakościowe
Struktura atomu
2 minuty
1b
3
b
C-1.3.
UP-1.2.
Zadanie jakościowe
wiązanie chemiczne
2 minuty
1b
4
b
C-1.3.
UP-1.2.
Zadanie jakościowe
Kryształowa komórka
2 minuty
1b
5
b
C-2.2
UP-2.5.3.
Zadanie jakościowe
Rodzaje reakcji chemicznych
2 minuty
1b
6
b
C-3.3.
UP-2.3.4.
Zadanie jakościowe
połączenie genetyczne
2 minuty
1b
7
b
C-3.2.1.
UP-2.3.3.
Zadanie jakościowe
Właściwości chemiczne głównych klas substancji nieorganicznych
2 minuty
1b
8
b
C-2.2.
UP-1.1.
Zadanie jakościowe
Charakterystyka reakcji
2 minuty
1b
9
b
C-2.6.
UP-1.2.
Zadanie jakościowe
Reakcje redoks
2 minuty
1b
10
b
C-3.2.3.
UP-2.3.3.
Zadanie jakościowe
Właściwości chemiczne głównych klas substancji nieorganicznych
2 minuty
1b
11
P
C-3.2.4.
UP-2.3.3.
Dopasowanie
Właściwości chemiczne głównych klas substancji nieorganicznych
4 minuty
2b
12
P
C-1.6.
UP-2.1.2.
Dopasowanie
Klasyfikacja substancji nieorganicznych
4 minuty
2b
13
V
C-4.5.3.
UP-2.8.3.
Zadanie obliczeniowe z otwartą odpowiedzią
Obliczenia na równaniach chemicznych objętości substancji przez masę produktów reakcji
8 minut
3b
14
V
C-3.3.
UP-2.5.3..
Zadanie jakościowe z otwartą odpowiedzią
Ułóż równania reakcji różnych typów
8 minut
3b
Test z chemii, ocena 8
Kodyfikator
Elementy treści i wymagania dotyczące poziomu wyszkolenia studentów, do końcowego monitoringupraca kontrolna
Sekcja 1. Kodyfikator. Elementy treści
KOD
Elementy treści zweryfikowane przez zadania CMM
1
Substancja
1.6.
Atomy i cząsteczki. Pierwiastek chemiczny. Substancje proste i złożone. Główne klasy substancji nieorganicznych. Nomenklatura związków nieorganicznych
1.1
Budowa atomu. Struktura powłok elektronowych atomów pierwszych 20 pierwiastków układu okresowego D.I. Mendelejew
1.3.
Struktura substancji. Wiązanie chemiczne: kowalencyjne (polarne i niepolarne), jonowe, metaliczne
2
Reakcje chemiczne.
2.2.
Klasyfikacja reakcji chemicznych według różnych kryteriów: liczba i skład substancji wyjściowych i otrzymanych, zmiany stopnia utlenienia pierwiastków chemicznych, absorpcja i uwalnianie energii.
2.6.
Reakcje redoks. Środek utleniający i środek redukujący
3
Podstawowe podstawy chemii nieorganicznej.
3.2.1.
Właściwości chemiczne tlenków: zasadowe, amfoteryczne, kwasowe
3.2.2.
Właściwości chemiczne zasad
3.2.3.
Właściwości chemiczne kwasów
3.2.4.
Właściwości chemiczne soli (średnie)
3.3.
Związek różnych klas substancji nieorganicznych
4
Metody poznawania substancji i zjawisk chemicznych. Eksperymentalne Podstawy Chemii
4.2.
Oznaczanie charakteru środowiska roztworu kwasów i zasad za pomocą wskaźników. Reakcje jakościowe na jony w roztworze (jony chlorkowe, siarczanowe, węglanowe, amonowe
4.4.
Otrzymywanie i badanie właściwości badanych klas substancji nieorganicznych
4.5.3.
Obliczanie ilości substancji, masy lub objętości substancji z ilości substancji, masy lub objętości jednego z reagentów lub produktów reakcji
Sekcja 2. Kodyfikator. Wymagania dotyczące poziomu szkolenia.
KOD
Umiejętności i działania testowane przez zadania KIM
1
Poznaj/zrozum:
1.1.
symbole chemiczne: znaki pierwiastków chemicznych, wzory związków chemicznych, równania reakcji chemicznych;
1.2.
pierwiastek, atom, cząsteczka, względne masy atomowe i cząsteczkowe, jon, kation, anion, wiązanie chemiczne, elektroujemność, wartościowość, stopień utlenienia, mol, masa molowa, objętość molowa, roztwory, elektrolity i nieelektrolity, dysocjacja elektrolityczna, środek utleniający i czynnik redukujący, utlenianie i regeneracja, efekt cieplny reakcji, główne typy reakcji w chemii nieorganicznej;
2
Dowiedz się, jak nazwać:
2.1.2.
związki badanych klas substancji nieorganicznych;
2
Umieć opisać:
2.3.3.
właściwości chemiczne głównych klas substancji nieorganicznych (tlenki, kwasy, zasady i sole);
2.3.4.
związek między składem, strukturą i właściwościami poszczególnych przedstawicieli substancji organicznych
Umieć komponować:
2.5.3.
równania reakcji chemicznych
Umieć obliczyć:
2.8.3.
ilość substancji, objętość lub masa substancji przez ilość substancji, objętość lub masę reagentów lub produktów reakcji
System oceny testów z chemii
Część 1 zawiera 10 zadań na poziomie podstawowym. Każde pytanie ma 4 możliwe odpowiedzi, z których tylko jedna jest poprawna. Za wykonanie każdego zadania - 1 pkt.
Część 2 składa się z 2 zadań zaawansowanych i 2 zadań wysokiego poziomu. Za wykonanie zadań 11,12 - 2 punkty, jeśli popełni się jeden błąd, to odpowiedź oceniana jest na 1 punkt. W przypadku popełnienia dwóch lub więcej błędów lub braku odpowiedzi, otrzymuje się 0 punktów. Ostatnie dwa zadania wymagają pełnej odpowiedzi. Za wykonanie zadania -3 pkt.
Część 2. Rozwiązywanie zadania ze szczegółową odpowiedzią.
13
Treść kryterium
wynik
1) Równanie reakcji składa się z:
2) Wyznaczone masy cząsteczkowe
3) Obliczona objętość gazu
Odpowiedź jest poprawna i kompletna, zawiera wszystkie elementy
3
Pierwsze dwa elementy odpowiedzi są napisane poprawnie
2
Jeden element odpowiedzi jest napisany poprawnie
1
Wszystkie elementy odpowiedzi są napisane niepoprawnie
0
Maksymalny wynik
3
14.
Treść kryterium
wynik
Przedstawiana jest poprawna odpowiedź na pytanie oraz wystarczające uzasadnienie, które nie zawiera błędów.
3
Przedstawiono poprawną odpowiedź na pytanie, ale jej uzasadnienie nie jest dostatecznie kompletne
2
Podana jest tylko poprawna odpowiedź
1
Maksymalny wynik
3
Przełożenie wyniku testu na oceny w systemie pięciopunktowym.
Liczba punktów
Mniej niż 7
7-10
11-15
16-20
Stopień
2
3
4
5
Poziom osiągnięć
Niski
Baza
podniesiony
Kodyfikator chemii obejmuje:
- Sekcja 1. Wykaz elementów treści do sprawdzenia na ujednoliconym egzaminie państwowym z chemii;
- Sekcja 2 Lista wymagań dotyczących poziomu wyszkolenia, sprawdzana na ujednoliconym egzaminie państwowym z chemii.
Elementy treści zweryfikowane przez zadania CMM
1. PODSTAWY TEORETYCZNE CHEMII
1.1 Współczesne idee dotyczące budowy atomu
1.1.1 Budowa powłok elektronowych atomów pierwiastków pierwszych czterech okresów: s-, p- i d-pierwiastków. Konfiguracja elektronowa atomów i jonów. Stany podstawowe i wzbudzone atomów
1.2.2 ogólna charakterystyka metale z grup IA–IIIA w związku z ich pozycją w układzie okresowym pierwiastków chemicznych D.I. Mendelejew i cechy strukturalne ich atomów
1.2.3 Charakterystyka pierwiastków przejściowych (miedź, cynk, chrom, żelazo) według ich położenia w układzie okresowym pierwiastków chemicznych D.I. Mendelejew i cechy strukturalne ich atomów
1.2.4 Ogólna charakterystyka niemetali z grup IVА–VIIA w związku z ich położeniem w układzie okresowym pierwiastków chemicznych D.I. Mendelejew i cechy strukturalne ich atomów
1.3 Wiązanie chemiczne i struktura materii
1.3.1 Kowalencyjne wiązanie chemiczne, jego odmiany i mechanizmy powstawania. Charakterystyka wiązania kowalencyjnego (polarność i energia wiązania). Wiązanie jonowe. Połączenie metalowe. wiązanie wodorowe
1.3.2 Elektroujemność. oraz
1.3.3 Substancje o budowie molekularnej i niemolekularnej. Rodzaj sieci krystalicznej. Zależność właściwości substancji od ich składu i struktury
1.4 Reakcja chemiczna
1.4.1 Klasyfikacja reakcji chemicznych w chemii nieorganicznej i organicznej
1.4.2 Efekt termiczny reakcji chemicznej. Równania termochemiczne
1.4.3 Szybkość reakcji chemicznej, jej zależność od różnych czynników
1.4.4 Odwracalne i nieodwracalne reakcje chemiczne. bilans chemiczny. Zmiana równowagi chemicznej pod wpływem różnych czynników
1.4.5 Dysocjacja elektrolityczna elektrolitów w roztworach wodnych.
1.4.6 Reakcje wymiany jonowej
1.4.7 Hydroliza soli. Środowisko roztworów wodnych: kwaśne, obojętne, zasadowe
1.4.8 Reakcje redoks. Korozja metali i metody ochrony przed nią
1.4.9 Elektroliza stopów i roztworów (sole, zasady, kwasy)
1.4.10 Jonowe (reguła V.V. Markovnikova) i rodnikowe mechanizmy reakcji w chemii organicznej
2. CHEMIA NIEORGANICZNA
2.1 Klasyfikacja substancji nieorganicznych. (trywialne i międzynarodowe)
4.1.6 Główne metody otrzymywania (w laboratorium) określonych substancji należących do badanych klas związków nieorganicznych
4.1.7 Podstawowe metody otrzymywania węglowodorów (w laboratorium)
4.1.8 Podstawowe metody produkcji związków organicznych zawierających tlen (w laboratorium)
4.2 Ogólne reprezentacje o przemysłowych metodach otrzymywania najważniejszych substancji
4.2.1 Pojęcie metalurgii: ogólne metody otrzymywania metali
4.2.2 Ogólne zasady naukowe produkcji chemicznej (na przykładzie przemysłowej produkcji amoniaku, kwasu siarkowego, metanolu). zanieczyszczenie chemiczne środowisko i jego konsekwencje
4.2.3 Naturalne źródła węglowodorów, ich przetwarzanie
4.2.4 Związki wielkocząsteczkowe. Reakcje polimeryzacji i polikondensacji. Polimery. Tworzywa sztuczne, włókna, gumy
4.2.5 Zastosowanie badanych substancji nieorganicznych i organicznych
4.3.1 Obliczenia z wykorzystaniem pojęcia „ułamka masowego substancji w roztworze”
4.3.2 Obliczenia stosunków objętościowych gazów w reakcjach chemicznych
4.3.3 Obliczenia masy substancji lub objętości gazów ze znanej ilości substancji, masy lub objętości jednej z substancji biorących udział w reakcji
4.3.4 Obliczenia ciepła reakcji
4.3.5 Obliczenia masy (objętości, ilości substancji) produktów reakcji, jeżeli jedna z substancji jest podana w nadmiarze (ma zanieczyszczenia)
4.3.6 Obliczenia masy (objętości, ilości substancji) produktu reakcji, jeżeli jedna z substancji jest podana jako roztwór o określonym ułamku masowym substancji rozpuszczonej
4.3.7 Ustalenie wzoru cząsteczkowego i strukturalnego substancji
4.3.8 Obliczenia udziału masowego lub objętościowego wydajności produktu reakcji z teoretycznie możliwego
4.3.9 Obliczenia ułamka masowego (masy) związku chemicznego w mieszaninie
Umiejętności i działania testowane przez zadania KIM
Poznaj/zrozum:
1. Najważniejsze pojęcia chemiczne
- Zrozum znaczenie najważniejszych pojęć (podkreśl ich charakterystyczne cechy): substancja, pierwiastek chemiczny, atom, cząsteczka, względne masy atomowe i cząsteczkowe, jon, izotopy, wiązanie chemiczne, elektroujemność, wartościowość, stopień utlenienia, mol, masa molowa, molowy objętość, substancje molekularne i struktura niemolekularna, roztwory, elektrolity i nieelektrolity, dysocjacja elektrolityczna, hydroliza, utleniacz i reduktor, utlenianie i redukcja, elektroliza, szybkość reakcji chemicznych, równowaga chemiczna, ciepło reakcji, szkielet węglowy, grupa funkcyjna , izomeria i homologia, izomeria strukturalna i przestrzenna, główne typy reakcji w chemii nieorganicznej i organicznej.
- Ujawnij relacje między koncepcjami.
- Użyj najważniejszych pojęć chemicznych, aby wyjaśnić poszczególne fakty i zjawiska.
2. Podstawowe prawa i teorie chemii
- Stosować podstawowe zasady teorii chemicznych (struktura atomu, wiązania chemiczne, dysocjacja elektrolityczna, kwasy i zasady, budowa związków organicznych, kinetyka chemiczna) do analizy struktury i właściwości substancji
- Zrozumieć granice stosowalności badanych teorii chemicznych
- Zrozum znaczenie ustawy okresowej D.I. Mendelejewa i użyj go do jakościowej analizy i uzasadnienia głównych praw budowy atomów, właściwości pierwiastków chemicznych i ich związków
3. Najważniejsze substancje i materiały
- Klasyfikuj substancje nieorganiczne i organiczne zgodnie ze wszystkimi znanymi kryteriami klasyfikacji
- rozumiem to praktyczne użycie substancje ze względu na ich skład, strukturę i właściwości
- Bądź świadomy roli i znaczenia substancji w praktyce
- Wyjaśnij ogólne metody i zasady pozyskiwania najważniejszych substancji
Być w stanie:
1. imię
- badane substancje według trywialnej lub międzynarodowej nomenklatury
2. Zdefiniuj/sklasyfikuj:
- wartościowość, stopień utlenienia pierwiastków chemicznych, ładunki jonowe;
- w związkach i rodzaju sieci krystalicznej;
- struktura przestrzenna cząsteczek;
- charakter środowiska wodnych roztworów substancji;
- środek utleniający i środek redukujący;
- przynależność substancji do różnych klas związków nieorganicznych i organicznych;
- homologi i izomery;
- reakcje chemiczne w chemii nieorganicznej i organicznej (według wszystkich znanych kryteriów klasyfikacyjnych)
3. Scharakteryzuj:
- pierwiastki s, p i d zgodnie z ich położeniem w układzie okresowym D.I. Mendelejew;
- ogólne właściwości chemiczne prostych substancji - metali i niemetali;
- ogólne właściwości chemiczne głównych klas związków nieorganicznych, właściwości poszczególnych przedstawicieli tych klas;
- budowa i właściwości chemiczne badanych związków organicznych
4. Wyjaśnij:
- zależność właściwości pierwiastków chemicznych i ich związków od położenia pierwiastka w układzie okresowym D.I. Mendelejew;
- charakter wiązania chemicznego (jonowe, kowalencyjne, metaliczne, wodorowe);
- zależność właściwości substancji nieorganicznych i organicznych od ich składu i struktury;
- istota badanych typów reakcji chemicznych: dysocjacja elektrolityczna, wymiana jonowa, redoks (i tworzenie ich równań);
- wpływ różnych czynników na szybkość reakcji chemicznej i przesunięcie równowagi chemicznej
5. Zaplanuj/wykonaj:
- eksperyment na otrzymywanie i rozpoznawanie najważniejszych związków nieorganicznych i organicznych z uwzględnieniem nabytej wiedzy o zasadach bezpiecznej pracy z substancjami w laboratorium i w domu;
- obliczenia według wzorów i równań chemicznych
Ujednolicony egzamin państwowy z CHEMII
przygotowany przez Federalny Państwowy Instytut Naukowy„FEDERALNY INSTYTUT MIAR PEDAGOGICZNYCH”

Kodyfikator elementów zawartości chemii
do zestawiania kontrolnych materiałów pomiarowych
jednolity egzamin państwowy 2007
Kodyfikator jest opracowywany na podstawie obowiązkowej minimalnej treści podstawowego kształcenia ogólnego i średniego (pełnego) w zakresie chemii (załączniki do rozporządzeń Ministerstwa Edukacji Federacji Rosyjskiej nr Rosja z dnia 5 marca 2004 r. Nr 000) .
Pogrubiona kursywa oznacza duże bloki treści. Oddzielne elementy treści, na podstawie których dokonywane są zadania weryfikacyjne, oznaczane są w blokach kodem kontrolowanego elementu.
Kod sekcji |
kontrolowany element | Elementy treści zweryfikowane przez zadania CMM |
1 | Pierwiastek chemiczny |
|
Formy istnienia pierwiastków chemicznych. Współczesne idee dotyczące budowy atomów. Izotopy. |
||
Budowa powłok elektronowych atomów pierwiastków pierwszych czterech okresów Orbitale atomowe, pierwiastki s i p. Elektroniczna konfiguracja atomu. Stany podstawowe i wzbudzone atomów . |
||
Prawo okresowe i układ okresowy pierwiastków chemicznych. Promienie atomów, ich okresowe zmiany w układzie pierwiastków chemicznych. Wzory zmian właściwości chemicznych pierwiastków i ich związków według okresów i grup. |
||
2 | Substancja |
|
Wiązanie chemiczne: kowalencyjne (polarne i niepolarne), jonowe, metaliczne, wodorowe. |
||
Metody tworzenia wiązania kowalencyjnego. Charakterystyka wiązania kowalencyjnego: długość i energia wiązania . Tworzenie wiązania jonowego. |
||
Elektroujemność. Stopień utlenienia i wartościowość pierwiastków chemicznych. |
||
Substancje o budowie molekularnej i niemolekularnej. Zależność właściwości substancji od cech ich sieci krystalicznej. |
||
Różnorodność substancji nieorganicznych. Klasyfikacja substancji nieorganicznych. |
||
Ogólna charakterystyka metali głównych podgrup grup I-III w związku z ich położeniem w układzie okresowym pierwiastków chemicznych i cechami strukturalnymi ich atomów. |
||
Charakterystyka pierwiastków przejściowych - miedź, cynk, chrom, żelazo w zależności od ich położenia w układzie okresowym pierwiastków chemicznych i cech strukturalnych ich atomów. |
||
Ogólna charakterystyka niemetali głównych podgrup grup IV-VII w związku z ich położeniem w układzie okresowym pierwiastków chemicznych i cechami strukturalnymi ich atomów. |
||
Charakterystyczne właściwości chemiczne substancji nieorganicznych różnych klas: substancje proste (metale i niemetale); tlenki (zasadowe, amfoteryczne, kwasowe); zasady, amfoteryczne wodorotlenki, kwasy; sole średnie i kwasowe. |
||
Teoria budowy związków organicznych. Izomeria, homologia. |
||
Różnorodność substancji organicznych. Klasyfikacja substancji organicznych. Nazewnictwo systematyczne. |
||
seria homologiczna węglowodory. Izomery węglowodorów. strukturalne i izomeria przestrzenna. |
||
Cechy budowy chemicznej i elektronowej alkanów, alkenów, alkinów, ich właściwości. |
||
Aromatyczne węglowodory. Benzen, jego struktura elektronowa, właściwości. Homologie benzenu (toluenu). |
||
Struktura elektronowa grup funkcyjnych związków organicznych zawierających tlen. |
||
Charakterystyczne właściwości chemiczne związków organicznych zawierających tlen: ograniczające alkohole jedno- i wielowodorotlenowe, fenol; aldehydy i nasycone kwasy karboksylowe. |
||
Etery złożone. Tłuszcze. Mydło. |
||
Węglowodany: monosacharydy, disacharydy, polisacharydy . |
||
Aminokwasy jako amfoteryczne związki organiczne. Wiewiórki. |
||
Współzależność różnych klas: substancje nieorganiczne; substancje organiczne. |
||
3 | Reakcja chemiczna |
|
Klasyfikacja reakcji chemicznych w chemii nieorganicznej i organicznej. |
||
Szybkość reakcji, jej zależność od różnych czynników. |
||
Efekt cieplny reakcji chemicznej. Równania termochemiczne. |
||
Reakcje chemiczne odwracalne i nieodwracalne. bilans chemiczny. Przesunięcie równowagi pod wpływem różnych czynników. |
||
Dysocjacja elektrolitów w roztworach wodnych. Słabe i mocne elektrolity. |
||
Reakcje wymiany jonowej. |
||
Reakcje redoks. Korozja metali i metody ochrony przed nią. |
||
Hydroliza soli. Środowisko roztworów wodnych: kwaśne, obojętne, zasadowe. |
||
Elektroliza stopów i roztworów (sole, zasady). |
||
Reakcje charakteryzujące główne właściwości i metody otrzymywania: węglowodory; |
||
Naturalne źródła węglowodorów, ich przetwarzanie. |
||
Podstawowe metody syntezy związków wielkocząsteczkowych (tworzywa sztuczne, kauczuki syntetyczne, włókna). |
||
Obliczanie masy substancji rozpuszczonej zawartej w określonej masie roztworu o znanym ułamku masowym. |
||
Obliczenia: stosunki objętościowe gazów w reakcjach chemicznych. |
||
Obliczenia: masa substancji lub objętość gazów zgodnie ze znaną ilością substancji spośród osób biorących udział w reakcji. |
||
Obliczenia: efekt cieplny reakcji. |
||
Obliczenia: masa (objętość, ilość substancji) produktów reakcji, jeśli jedna z substancji jest podana w nadmiarze (ma zanieczyszczenia). |
||
Obliczenia: masa (objętość, ilość substancji) produktu reakcji, jeśli jedna z substancji jest podana w postaci roztworu o określonym ułamku masowym substancji rozpuszczonej. |
||
Znalezienie wzoru cząsteczkowego substancji. |
Unified State Examination (USE) jest formą państwowej certyfikacji końcowej przeprowadzanej w celu określenia zgodności wyników opanowania przez uczniów podstawowych programów edukacyjnych w szkolnictwie średnim ogólnokształcącym z odpowiednimi wymogami federalnymi standard edukacyjny przejdź do standardu edukacyjnego. Do tych celów wykorzystywane są kontrolne materiały pomiarowe (CMM), które są zestawami zadań o znormalizowanej formie.
Egzamin odbywa się zgodnie z prawo federalne„O edukacji w Federacja Rosyjska» z dnia 29 grudnia 2012 r. nr 273-FZ oraz Procedurę przeprowadzenia państwowej certyfikacji końcowej dla programy edukacyjneśrednie ogólnokształcące, zatwierdzone rozporządzeniem Ministerstwa Edukacji Rosji i Rosobr-nadzor z dnia 7 listopada 2018 r. Nr 190/1512.
Podejścia do doboru treści, opracowania struktury KIM USE.
Dobór treści KIM do USE in Chemistry w 2020 roku został dokonany generalnie z uwzględnieniem ogólnych wytycznych, na podstawie których powstały modele badań z lat poprzednich. Wśród tych instalacji najważniejsze z metodologicznego punktu widzenia są następujące.
KIM koncentrują się na testowaniu przyswajania systemu wiedzy, który jest uważany za niezmienny rdzeń treści istniejących programów chemii dla organizacji edukacji ogólnej. W normie ten system wiedzy przedstawiony jest w postaci wymagań dotyczących przygotowania absolwentów. Wymagania te odpowiadają poziomowi prezentacji w KIM sprawdzanych elementów treści.
Standardowe wersje KIM, które będą używane podczas egzaminu, zawierają zadania różniące się formą przedstawienia warunków i rodzajem wymaganej odpowiedzi, poziomem złożoności, a także sposobami ich oceny. wydajność. Zadania oparte są na materiale z głównych części kursu chemii. Podobnie jak w latach ubiegłych przedmiotem kontroli w ramach USE 2020 jest system poznania podstaw chemii nieorganicznej, ogólnej i organicznej. Do głównych elementów tego systemu należą: wiodące koncepcje pierwiastek chemiczny, substancja i reakcja chemiczna; podstawowe prawa i teoretyczne przepisy chemii; wiedza o zgodności i przyczynowości zjawisk chemicznych, genezie substancji, sposobach poznawania substancji. W normie ten system wiedzy przedstawiony jest w postaci wymagań dotyczących poziomu wyszkolenia absolwentów.
Darmowe pobieranie e-book w wygodnym formacie obejrzyj i przeczytaj:
Pobierz książkę USE 2020, Chemistry, Grade 11, Specification, Codifier, Project - fileskachat.com, szybko i bezpłatnie pobierz.
- USE 2020, chemia, klasa 11, wersja demonstracyjna, kodyfikator, specyfikacja, projekt
Następujące tutoriale i książki:
- W skarbonce pedagogicznego doświadczenia przyszłych nauczycieli chemii, przygotowanie do OGE i Zjednoczonego Egzaminu Państwowego, Kozhina L.F., Kosyreva IV., Tyurina IV., Vasilchikova O.A., 2019
- Unified State Examination 2020, Chemia, Standardowe warianty zadań egzaminacyjnych od twórców Unified State Examination, Miedwiediew Yu.N., 2020
- USE 2020, Chemia, 10 opcji szkoleniowych dla prac egzaminacyjnych przygotowujących do ujednoliconego egzaminu państwowego, Savinkina E.V., Zhiveinova O.G., 2019
- W kontakcie z 0
- Google+ 0
- ok 0
- Facebook 0